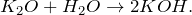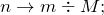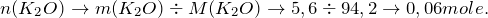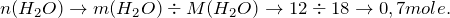- Оксид калия: способы получения и химические свойства
- Способ получения
- Химические свойства
- Оксид калия, характеристика, свойства и получение, химические реакции
- Оксид калия, характеристика, свойства и получение, химические реакции.
- Краткая характеристика оксида калия:
- Физические свойства оксида калия:
- Получение оксида калия:
- Химические свойства оксида калия. Химические реакции оксида калия:
- Применение и использование оксида калия:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- K2O + H2O = ? уравнение реакции
- Формула оксида калия (K2O), свойства, риски и использование
- Физико-химические свойства
- Реактивность и опасности
- приложений
Оксид калия: способы получения и химические свойства
Оксид калия K2O — Бинарное неорганическое вещество . Белый, термически устойчивый.
Относительная молекулярная масса Mr = 94,20; относительная плотность для тв. и ж. состояния d = 2,33; tпл = 740º C при избыточном давлении.
Способ получения
1. Оксид калия можно получить путем взаимодействия калия и гидроксида калия при 450º С, в результате образуется оксид калия и водород :
2K + 2KOH = 2K2O + H2
2. При взаимодействии надпероксида калия и калия при температуре 700º C и избыточном давлении образуется оксид калия:
Химические свойства
1. При разложении оксида калия образуется пероксид калия и калий, температура при этом должна быть 350–430º С:
2. Оксид калия взаимодействует со сложными веществами:
2.1. Оксид калия реагирует с водой . Образуется гидроксид калия:
2.2. Оксид калия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид калия с разбавленной соляной кислотой образует хлорид калия и воду:
K2O + 2HCl = 2KCl + H2O.
2.3. При взаимодействии калия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 400º C оксид калия образует карбонат калия:
2.3.2. При 150–200º C, в результате взаимодействия оксида калия, и оксидом азота (IV) образуются нитрат калия и нитрит калия:
2.3.3. Оксид калия взаимодействует с оксидом алюминия при 1000º С. При это образуется алюминат калия:
Источник
Оксид калия, характеристика, свойства и получение, химические реакции
Оксид калия, характеристика, свойства и получение, химические реакции.
Оксид калия – неорганическое вещество, имеет химическую формулу K2O.
Краткая характеристика оксида калия:
Оксид калия – неорганическое вещество бесцветного либо бледно-желтого цвета.
Так как валентность калия равна одному, то оксид калия содержит один атом кислорода и два атома калия.
Химическая формула оксида калия K2O.
В воде не растворяется, а вступает в реакцию с ней.
Растворим в органических растворителях.
Обладает высокой гигроскопичностью.
Физические свойства оксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | K2O |
| Синонимы и названия иностранном языке | potassium oxide (англ.) |
калия окись (рус.)
Получение оксида калия:
Оксид калия получается в результате следующих химических реакций:
- 1. из пероксида калия:
Вначале получают пероксид калия.
Затем пероксид калия обогащают калием.
Напрямую оксид калия путем окисления самого калия не получается.
Химические свойства оксида калия. Химические реакции оксида калия:
Химически активное вещество.
Химические свойства оксида калия аналогичны свойствам оксидов других щелочных металлов . Поэтому для него характерны следующие химические реакции:
1. реакция оксида калия с галогенами:
Оксид калия бурно реагирует с галогенами, образуя соответственно две соли:
– хлорид калия и гипохлорит калия,
– бромид калия и гипобромит калия,
– йодид калия и гипойодит калия.
2. реакция оксида калия с водой:
Оксид калия бурно реагирует с водой , образуя гидроксид калия .
3. реакция оксида калия с оксидом углерода (углекислым газом):
Оксид калия на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат калия.
4. реакция оксида калия с оксидом серы:
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит калия, во втором случае – сульфат калия.
5. реакция оксида калия с оксидом кремния:
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат калия.
Аналогично проходят реакции оксида калия и с другими кислотными оксидами.
6. реакция оксида калия с оксидом цинка :
Оксид цинка является амфотерным оксидом. Это значит, что как амфотерный оксид оксид цинка проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – цинкат калия.
Аналогично проходят реакции оксида калия и с другими амфотерными оксидами.
7. реакция оксида калия с плавиковой кислотой:
В результате химической реакции получается соль – фторид калия и вода.
Аналогично проходят реакции оксида калия и с другими кислотами.
8. реакция оксида калия с бромистым водородом (бромоводородом):
В результате химической реакции получается соль – бромид калия и вода .
9. реакция оксида калия с йодоводородом:
В результате химической реакции получается соль – йодид калия и вода .
10. реакция оксида калия с жидким аммиаком:
В результате химической реакции получается гидроксид калия и амид калия.
Применение и использование оксида калия:
Оксид калия используется в сельском хозяйстве в качестве компонента минеральных удобрений , в строительстве в составе цемента , а также в химической промышленности для получения других соединений калия.
Примечание: © Фото //www.pexels.com, //pixabay.com

оксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида калия
реакции с оксидом калия
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 482)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 489)
- Метан, получение, свойства, химические реакции (23 725)
- Этилен (этен), получение, свойства, химические реакции (22 778)
- Природный газ, свойства, химический состав, добыча и применение (21 160)
- Крахмал, свойства, получение и применение (20 568)
- Целлюлоза, свойства, получение и применение (19 411)
- Пропилен (пропен), получение, свойства, химические реакции (19 080)
- Прямоугольный треугольник, свойства, признаки и формулы (18 725)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
K2O + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме K2O + H2O. Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Какая масса продукта образуется в результате растворения 5,6 г оксида калия в 12 мл воды? Какое из исходных веществ находится в избытке?
Реакция взаимодействия между оксидом калия и водой (K2O + H2O) приводит к образованию одного сложного соединения — гидроксида калия (соединение). Молекулярное уравнение реакции имеет вид:
Теперь переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (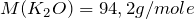
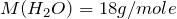
Поскольку плотность воды равна 1 г/мл, то можно утверждать, что объем воды равен её массе, тогда
Это означает, что вода находится в избытке и дальнейшие расчеты производим по оксиду калия.
Согласно уравнению реакции
Тогда масса гидроксида калия будет равна (молярная масса – 56 g/mole):
Источник
Формула оксида калия (K2O), свойства, риски и использование
оксид калия, также называется оксидом калия, ионная кислородно-калиевая соль, формула которой K2О. Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
К2Или это самый простой оксид калия, это очень реактивное и редко встречающееся соединение. Некоторые коммерческие материалы, такие как удобрения и цементы, испытывают, предполагая процентное содержание состава, которое будет эквивалентно смеси химических соединений K2О.
Оксид калия получают из гидроксида калия (едкого кали) и металлического калия при 450 ° C с образованием молекулярного водорода (ОКСИД КАЛИЯ K2O, S.F.) в соответствии с уравнением:
Его также получают путем восстановления пероксида калия в соответствии с реакцией:
Другим способом получения оксида калия является нагревание карбоната калия при высокой температуре, как показано следующей реакцией:
Однако основным способом получения оксида калия является нагревание нитрата калия для получения молекулярного азота, как показано следующей реакцией:
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 использования
- 4 Ссылки
Физико-химические свойства
Оксид калия — это желтоватые тетраэдрические кристаллы без характерного аромата (Национальный центр биотехнологической информации, 2017). Его внешний вид показан на рисунке 2 (американские элементы, С.Ф.).
Соединение имеет молекулярную массу 94,2 г / моль и плотность 2,13 г / мл при 24 ° С. Он имеет температуру плавления 740 ° C, хотя начинает разлагаться при 300 ° C (Royal Society of Chemistry, 2015).
Соединение устойчиво к нагреванию и растворим в этаноле и эфире. К2Или он кристаллизуется в структуре антифторита. По этой причине положения анионов и катионов меняются местами относительно их положений в CaF.2, с ионами калия, координированными до 4 оксидных ионов, и ионами оксида, скоординированными с 8 калиями.
К2Или это основной оксид и бурно реагирует с водой с образованием едкого гидроксида калия. Он распух и поглощает воду из атмосферы, инициируя эту энергичную реакцию.
Оксид калия обратимо окисляется до пероксида калия при 350 ° С, бурно реагирует с кислотами, такими как соляная кислота, с образованием солей калия в соответствии с реакцией:
Соединение реагирует с диоксидом азота с образованием нитрата и нитрита калия при температуре от 150 до 200 ° C:
Оксид калия реагирует при низких температурах с аммиаком с образованием амидов и гидроксида калия в соответствии с реакцией:
Реактивность и опасности
Оксид калия является нестабильным веществом. Он легко окисляется до других оксидов калия, пероксида или до окиси калия (KHO). Соединение не является горючим, но активно и экзотермически реагирует с водой с образованием гидроксида калия (KOH).
Раствор оксида калия в воде является сильным основанием, бурно реагирует с кислотой и вызывает коррозию. Бурно реагирует с водой, образующей гидроксид калия. Атакует многие металлы в присутствии воды (Национальный институт безопасности и гигиены труда, 2014).
Вещество разъедает глаза, кожу и дыхательные пути, а также при попадании в организм. Вдыхание аэрозоля может вызвать отек легких. Симптомы отека легких часто проявляются лишь через несколько часов и усиливаются при физической нагрузке..
В случае попадания в глаза вам следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза должны быть промыты проточной водой в течение не менее 15 минут с открытыми веками. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста.
Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
В случае проглатывания не вызывать рвоту. Ослабьте тесную одежду, такую как воротники рубашки, ремни или галстуки. Если пострадавший не дышит, проведите реанимацию из уст в уста. Во всех случаях следует немедленно обратиться за медицинской помощью (IPCS, S.F.).
приложений
Химическая формула К2O (или просто «K») используется в нескольких промышленных контекстах: числа N-P-K для удобрений, в формулах цемента и в формулах стекла.
Оксид калия часто не используется непосредственно в этих продуктах, но количество калия указывается в терминах K-эквивалентов.2Или для любого типа используемых соединений калия, таких как карбонат калия.
Оксид калия составляет около 83% калия по весу, а хлорид калия — только 52%. Хлорид калия обеспечивает меньше калия, чем равное количество оксида калия.
Поэтому, если удобрением является хлорид калия в количестве 30% по весу, его стандартный индекс калия, основанный на оксиде калия, будет составлять только 18,8%. Он производится и / или импортируется от 10 до 100 тонн в год этого вещества в Европейском экономическом пространстве.
Это вещество используется в лабораторных химикатах, удобрениях, полимерах и фитосанитарных продуктах. К2Или это имеет промышленное использование, которое приводит к производству другого вещества (использование промежуточных продуктов).
Оксид калия используется в областях приготовления смесей и / или переупаковки, а также в сельском хозяйстве, лесном хозяйстве и рыболовстве. Это вещество используется для производства химических продуктов, пластмассовых изделий и минеральных продуктов (например, гипса, цемента)..
Выброс в окружающую среду оксида калия, вероятно, произойдет для промышленного использования: в качестве промежуточного этапа при производстве другого вещества (использование промежуточных продуктов), составления смесей, в качестве вспомогательного средства для обработки и промышленной обработки на истирание с низкой скоростью. выпуска, резки, механической обработки или полировки металла).
Возможно, что другое высвобождение в окружающую среду этого вещества путем его использования во внутренних помещениях, например, моющих жидкостей / моющих средств, автомобильных средств по уходу, краски и покрытия или клеи, ароматизаторы и освежители воздуха..
Также для использования внутри помещений в закрытых системах с минимальным выбросом, таких как охлаждающие жидкости в холодильниках, электрические нагреватели на масляной основе.
Оксид калия используется на открытом воздухе в долговременных материалах с низкой скоростью высвобождения, например, в строительных материалах и конструкциях из металла, дерева и пластика..
В помещении он используется в долговечных материалах с низкой скоростью высвобождения, таких как мебель, игрушки, строительные материалы, занавески, обувь, кожгалантерея, бумажные и картонные изделия, электронное оборудование..
Это вещество можно найти в изделиях из камня, гипса, цемента, стекла или керамики (например, посуду, кастрюли / сковородки, контейнеры для хранения продуктов питания, строительные и изоляционные материалы) (Европейское химическое агентство, 2017).
Оксид калия является термостойким, крайне нерастворимым источником калия, подходящим для стекла, оптики и керамики. Оксидные соединения не приводят к электричеству.
Однако некоторые структурированные оксиды перовскита являются электронными проводниками, которые находят применение в катоде твердооксидных топливных элементов и системах генерации кислорода..
Они представляют собой соединения, которые содержат, по меньшей мере, один кислородный анион и один катион металла. Они чрезвычайно стабильны, что делает их полезными для изготовления керамических конструкций, таких как глиняные миски или для продвинутой электроники.
Он также используется в легких конструкционных компонентах в аэрокосмической и электрохимической промышленности, таких как топливные элементы, в которых они проявляют ионную проводимость..
Металлооксидные соединения являются основными ангидридами и поэтому могут вступать в реакцию с кислотами и сильными восстановителями в окислительно-восстановительных реакциях..
Источник