- Как диоксид углерода реагирует с водой
- Диоксид углерода: формула, свойства и области применения
- Формула
- Физические свойства
- Химические свойства
- Угольная кислота и раствор СО2
- Свойства угольной кислоты
- Качественная реакция
- Получение диоксида углерода
- Применение диоксида углерода
- Экология СПРАВОЧНИК
- Информация
- Диоксид углерода взаимодействие с водой
Как диоксид углерода реагирует с водой
Углерод
Диоксид углерода
Важную роль в процессах, протекающих в воде искусственного водоёма, играет оксид углерода (IV) или, как его чаще называют, углекислый газ. Он представляет собой соединение углерода с кислородом; в молекуле вещества один атом углерода связан с двумя атомами кислорода — CO2. Углекислый газ влияет на гидрохимические параметры воды (жесткость, pH, содержание различных веществ), он действует на рыб и других водных животных и играет важнейшую роль в развитии аквариумных растений.
Диоксид углерода содержится в воде в основном в виде растворенных молекул CO2 и лишь малая часть его (около 1%) при взаимодействии с водой образует угольную кислоту:
Диоксид углерода, гидрокарбонатные и карбонатные ионы являются основными компонентами карбонатной системы. В растворе между ними существует подвижное равновесие:
Соотношение между компонентами в значительной мере определяется величиной рН.
- При рН 4.5 и ниже из всех компонентов карбонатного равновесия в воде присутствует только свободная углекислота.
- В интервале рН=6-10 (pH водs в искусственном водоёме в нормальных условиях должен быть от 7.8 до 9) гидрокарбонатные ионы являются основной формой производных угольной кислоты (максимальное их содержание при рН=8.3-8.4).
- При рН более 10.5 главной формой существования угольной кислоты являются карбонатные ионы.
Главным источником поступления оксида углерода в воды искусственного водоёма являются процессы биохимического распада органических остатков, окисления органических веществ, дыхания водных организмов.
Одновременно с процессами поступления значительная часть диоксида углерода потребляется при фотосинтезе, а также расходуется на растворение карбонатов и химическое выветривание алюмосиликатов:
Уменьшение диоксида углерода в воде происходит также в результате его выделения в атмосферу.
Концентрация диоксида углерода в природных водах колеблется от нескольких десятых долей до 3-4 мг/дм 3 , изредка достигая 10-20 мг/дм 3 .
Обычно весной и летом содержание диоксида углерода в водоеме понижается, а в конце зимы достигает максимума. Диоксид углерода имеет исключительно важное значение для растительных организмов населяющих искусственный водоём (как источник углерода).
Как известно, водные растения состоят из органических соединений, т. е. соединений, основу (скелет) которых составляет углерод. Нарастание биомассы растений связано с необходимостью подпитки их извне соединениями углерода. Основным веществом, служащим для питания растений является углекислый газ. Растения ассимилируют (поглощают) CO2, превращая его в органические соединения — глюкозу, крахмал и другие.
Поглощение CO2 связано с изменением pH воды искусственного водоёма: сдвигом его значения в щелочную сторону. Содержание углекислого газа в воде искусственного водоёма снижается при уменьшении жесткости и уменьшении кислотности воды. Поэтому очень мягкая и особенно щелочная вода неблагоприятны для водных растений. Многие растения прекращают рост даже в слабощелочной среде (при pH около 8).
Забирая углекислый газ из воды, водные растения сами ухудшают условия своего существования; для их улучшения необходим новый источник углерода. Некоторые водные растения могут использовать в процессе фотосинтеза только свободный CO2, растворенный в воде искусственного водоёма. Если весь углекислый газ израсходован, то процесс фотосинтеза прекращается, и рост растения останавливается.
В то же время повышенные концентрации CO2 угнетающе действуют на животные организмы обитающие в пруду. Углекислый газ в больших концентрациях токсичен для водных животных. При большом содержании CO2 в воде он попадает в кровь рыб, вызывая удушье. Для нормального функционирования аквасистемы концентрация CO2 в воде искусственного водоёма не должна превышать 4 мл/л.
При высоких концентрациях CO2 воды также становятся агрессивными по отношению к металлам и бетону в результате образования растворимых гидрокарбонатов, нарушающих структуру этих материалов.
Карбонаты
Важная роль углекислого газа в гидрохимии искусственного водоёма состоит в установлении так называемого углекислотно-известкового равновесия. Это равновесие определяется главным образом тремя параметрами; концентрацией CO2 в воде, значениями pH и карбонатной жесткости dKH.Карбонат кальция CaCO3 обладает очень плохой растворимостью в воде (7 мг в 1 л), что соответствует 2° жесткости. При растворении CO2 в воде карбонаты, которые практически всегда содержатся в грунте, начинают взаимодействовать с углекислым газом, с образованием гидрокарбонатов, которые хорошо растворимы в воде:
Основным источником гидрокарбонатных и карбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, мергелей, доломитов:
Некоторая часть гидрокарбонатных ионов поступает с атмосферными осадками и грунтовыми водами. Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние могут выпадать в осадок:
В речных водах содержание гидрокарбонатных и карбонатных ионов колеблется от 30 до 400 мг HCO3 — /дм 3 , в озерах — от 1 до 500 мг HCO3 — /дм 3 , в морской воде — от 100 до 200 мг/дм 3 , в атмосферных осадках — от 30 до 100 мг/дм 3 , в грунтовых — от 150 до 300 мг/дм 3 , в подземных водах — от 150 до 900 мг/дм 3 .
Однако кислотность и карбонатная жесткость не являются единственными факторами, определяющими углекислотно-известковое равновесие воды в искусственном водоёме. Это равновесие зависит от целого ряда факторов:
1.Объем искусственного водоёма. Как правило, в искусственных водоёмах большого объема равновесные процессы более устойчивы.
2.Геометрические размеры искусственного водоёма. В искусственном водоёме с большой площадью поверхности лучше осуществляется газообмен, с воздухом.
3.Количество рыб и других водных животных, выделяющих углекислый газ при дыхании.
4.Количество водных растений в искусственном водоёме, которые, в зависимости от освещенности, выделяют или поглощают углекислый газ.
5.Интенсивность освещения, влияющая на жизнедеятельность водных растений.
6.Химический состав воды, наливаемой в искусственный водоём. Наиболее важный фактор — карбонатная жесткость (dKH).
7.Режим кормления рыб. Разлагающийся избыточный корм становится источником углекислого газа.
8.Температура воды. Влияет на растворимость карбонатов, углекислого газа, на скорость всех химических реакций.
9.Грунт. От содержания карбонатов в грунте зависит гидрохимический состав воды.
10.Движение воды за счет фильтров, ручьев, каскадов, насосов и т. п. Влияет на насыщение воды углекислым газом из воздуха и растворимость карбонатов.
Все указанные факторы говорят о сложной зависимости равновесия от условий содержания искусственного водоёма: из-за такого большого комплекса факторов часто бывает невозможно предугадать направление смещения углекислотно-известкового равновесия и соответствующее ему изменение гидрохимического состава воды искусственного водоёма.
Источник
Диоксид углерода: формула, свойства и области применения
Диоксид углерода (углекислый газ) — часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения — гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
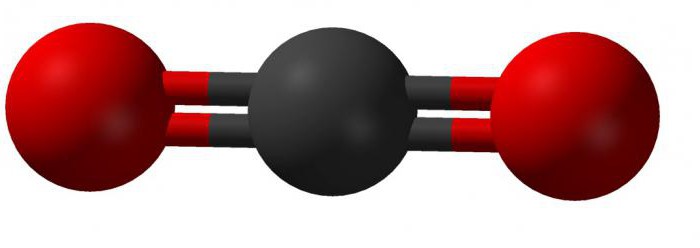
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так:
Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации — угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Угольная кислота и раствор СО2
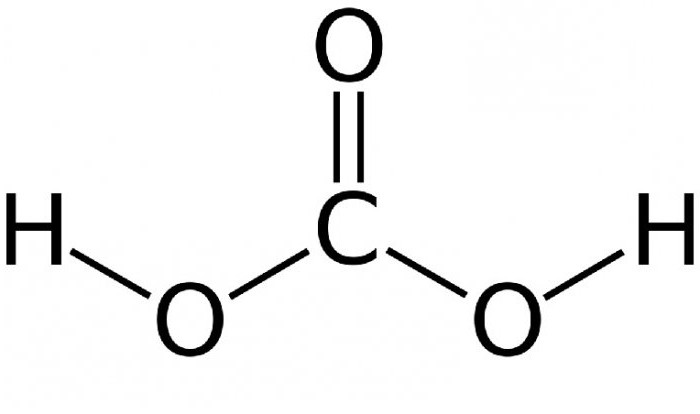
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.
Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н + и соединения НСО3 — . В очень небольшом количестве образуются ионы СО3 — .
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
Получение диоксида углерода
Если требуется получить небольшое количество СО2, можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
Источник
Экология СПРАВОЧНИК
Информация
Диоксид углерода взаимодействие с водой
Взаимодействуя с кислородом, тритий образует радиоактивные молекулы воды, которые попадают в поверхностные воды, и так же как радиоактивный диоксид углерода поглощаются растениями и животными.[ . ]
Вода водоемов содержит бикарбонаты кальция Са(НС03)2 и магния Л (НС03)2, обусловливающие ее карбонатную жесткость, а также угольную кислоту в виде растворенного диоксида углерода С02. Кислоты, поступающие в водоем вместе с производственными сточными водами, взаимодействуют с бикарбонатами, вытесняя из них углекислоту, в связи с чем количество бикарбонатов в воде (т. е. ее щелочность) уменьшается, а количество растворенного диоксида углерода увеличивается.[ . ]
Диоксид углерода, растворяясь в воде, частично вступает с ней во взаимодействие с образованием угольной кислоты. Отдельно определить содержание диоксида углерода и угольной кислоты в воде трудно, поэтому суммарную концентрацию этих компонентов принимают за концентрацию свободной угольной кислоты. Так как только около 1 % растворенного диоксида углерода образует угольную кислоту, расчет содержания свободной угольной кислоты ведется на диоксид углерода С02своб. Концентрация свободной угольной кислоты в поверхностных водах определяется парциальным давлением диоксида углерода в атмосфере. Растворимость диоксида углерода в воде, отвечающая равновесному состоянию при атмосферном давлении, приведена ниже.[ . ]
Диоксид углерода в атмосфере 238 сл. взаимодействие с водой 318 влияние на климат 240 сл.[ . ]
Растворение двууглекислого кальция приводит к разрушению бетона.[ . ]
Жесткость воды представляет собой свойство природной воды, зависящее от наличия в ней, главным образом, растворенных солей кальция и магния. Это типичные вещества в природных водах. Кальций и магний входят в состав большинства минералов, слагающих поверхностные слои земли. В естественных условиях ионы кальция, магния и других щелочноземельных металлов, обуславливающих жесткость, поступают в воду в результате взаимодействия растворенного в воде диоксида углерода с карбонатными минералами и при других процессах растворения, химического выветривания горных пород. Источником этих ионов могут являться также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий. Вследствие распространенности этих элементов в природных водах неудивительно, что они играют важную роль в жизнедеятельности организмов: влияют на проницаемость клеточных мембран, формируют состав костной ткани высших животных.[ . ]
Фенолы, растворенные в сточных водах, относительно легко окисляются кислородом воздуха. Дальнейшее окисление может привести к образованию диоксида углерода и воды. Глубина превращения фенолов зависит от параметров окисления. Многоатомные фенолы окисляются интенсивнее одноатомных, особенно при pH == 7. Например, степень разложения метилрезорциновой и диметилрезорциновой фракций [368] при температуре сточной воды 40 °С и pH = 9,5 13,0 составляет 30—50%, причем наблюдается образование продуктов уплотнения и конденсации фенолов, плохо растворимых в воде.[ . ]
Очистка растворами карбонатов. Основана на взаимодействии диоксида углерода с водными растворами карбонатов натрия и калия (обычно поташа) с активирующими добавками оксидов поливалентных металлов. Скорость абсорбции практически полностью лимитируется скоростью реакции п жидкой фазе СОг + ОН- —> НСО-3.[ . ]
Отрицательное влияние на процесс обесфеноливания сточной воды оказывают кислые примеси, такие как диоксид углерода, сероводород и синильная кислота, которые связывают едкий натр в балластные соли. Диоксид углерода к тому же способен взаимодействовать с фенолятами с образованием фенола и бикарбоната натрия.[ . ]
Фотосинтез представляет собой сложную окислительно-вос-становительную реакцию, при которой из диоксида углерода и воды синтезируются молекулы сахаров (в частности, глюкозы) с выделением свободного кислорода. Для образования органических веществ необходима энергия, которая поступает на Землю от Солнца в виде фотонов (квантов энергии). Фотон солнечного света взаимодействует с молекулой хлорофилла, в результате чего высвобождается электрон одного из ее атомов. Этот электрон перемещается внутри хлоропласта и взаимодействует с молекулой адено-зиндифосфорной кислоты (АДФ). В результате этого молекула АДФ получает дополнительную энергию, достаточную для превращения ее в молекулу аденозинтрифосфорной кислоты (АТФ), вещества, являющегося энергоносителем клетки. Возбужденная молекула АТФ в живой клетке, содержащей воду и углекислый газ, способствует протеканию реакции образования глюкозы и кислорода. При этом АТФ утрачивает часть энергии и превращается обратно в АДФ. Затем процесс повторяется вновь с использованием следующего фотона света.[ . ]
В процессе фотосинтеза энергия Солнца, поглощаемая зелеными тканями растений при помощи хлорофилла, обеспечивает взаимодействие молекул диоксида углерода и воды с образованием кислорода и углеводов. Фотосинтез способствует круговороту веществ и энергии па Земле. Круговорот веществ через живые организмы захватывает значительное число элементов — прежде всего органогенов Н, С, N, О. Все организмы используют также Р, S, Na, К, Са, Mg , Fe, Mn, Со, Си, Zn, в некоторых случаях А1, В, Br, I, V и другие элементы. В настоящее время некоторые элементы в виде подвижных соединении в результате процесса индустриализации поступают в океан н в атмосферу значительно быстрее, чем это было раньше. В круговорот вовлечены и новые вещества, в частности по Земному шару разносятся такие вредные элементы, как ртуть и свинец, а также ряд стабильных синтетических материалов — полимеров, удобрений, пестицидов, детергентов и др.[ . ]
В целом леса, имея своеобразный тип обмена веществ и энергии, влияют на почвообразование, климат, гидрологический режим, а также, взаимодействуя с атмосферой, определяют уровень обмена кислородом и диоксидом углерода. Лесные экосистемы регулируют интенсивность снеготаяния и уровень воды в реках, стабилизируют состав атмосфер, снижают скорость ветра, сохраняют под пологом леса фауну и микроорганизмы.[ . ]
Кроме того, предложен ряд эффективных технологий связывания и утилизации СО2, выделяющегося при сжигании топлива. В последнем случае СО2 сжижается и, имея большую, чем вода, плотность, остается на дне, где постепенно взаимодействует с морскими породами и карбонизирует их, переходя в твердое состояние.[ . ]
В отдельную группу можно выделить методы, основанные на низкотемпературном окислительно-восстановительном расщеплении сернокислотных отходов. Характерной особенностью подобных процессов является то, что образование десульфированного продукта не связано с термической диссоциацией серной кислоты. Серная кислота,взаимодействуя с восстановительной средой, вначале превращается в неустойчивые сульфокислоты, которые при 200-350 °С полностью расщепляются до диоксидов серы и углерода, вода и твердого или жидкого органического остатка. Восстановительной добавкой служат мазут., цилиндровый дистиллят, прямогонный гудрон и его смеси с мазуте»«. Изменением соотношения компонентов и регулированием технологических параметров можно управлять степенью окисления и уплотнения получаемых продуктов. Разработаны технологии производства котельного топлива, битумов, кокса и сульфокатионитов /29/,отличающиеся простотой аппаратурного оформления и небольшой энергоемкостью.[ . ]
Иначе происходит превращение остатков и отходов веществ синтетического и минерального происхождения. Например, отходы синтетических моющих средств (стиральных порошков), не усваиваемые микроорганизмами, накапливаются в водоемах, куда они поступают вместе со сточными водами, загрязняя их. При сжигании нефтяного топлива (мазута) и каменного угля в атмосферу вместе с дымовыми газами, содержащими оксиды углерода (СО, С02), выбрасывается диоксид серы (502), который, взаимодействуя с влагой и кислородом воздуха, образует серную кислоту — возникают так называемые кислотные дожди. Значительная часть химических веществ, выбрасываемых в биосферу, токсична, многие из них обладают канцерогенными и мутагенными свойствами.[ . ]
Источник