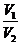Расчет рН при разбавлении и смешивании растворов
Расчеты рН в растворах сильных электролитов
Для характеристики кислотности среды обычно используют величину отрицательного десятичного логарифма молярной концентрации ионов Н + , которую называют водородным показателем рН:
для нейтральной среды рН = 7,
для кислых растворов рН 7.
Аналогичным образом реакция среды может быть охарактеризована гидроксильным показателем рОН:
С(ОН — ) – молярная концентрация ионов ОН — .
рН и рОН связаны между собой следующим образом:
Пример1:Рассчитать рН в 0,05М растворе серной кислоты.
Для расчета рН необходимо узнать молярную концентрацию ионов (Н + ). В растворах сильных электролитов концентрацию ионов можно узнать, записав уравнение диссоциации.
Это уравнение показывает, что при диссоциации 1 моль H2SO4 образуется 2 моль ионов H + и 1 моль ионов SO4 2- . Таким образом, если известна молярная концентрация самой серной кислоты, то молярная концентрация ионов H + будет в 2 раза больше.
С (H + ) = 2∙ С(H2SO4) = 2 ∙ 0,05 моль/л = 0,1 моль/л
pH = – lg C(H + ) = – lg 0,1 = – lg 10 -1 = 1
Таблица десятичных логарифмов чисел от 0 до 10
| число | ||||||||
| lg | 0,3 | 0,5 | 0,6 | 0,7 | 0,8 | 0,85 | 0,9 | 0,95 |
Пример 2.Рассчитать рН в 0,37% растворе гидроксида кальция (ρ = 1 г/мл).
Записываем уравнение диссоциации электролита:
В случае оснований нужно вначале найти молярную концентрацию ионов OH — , затем рОН, а потом рН.
В условии дана процентная концентрация раствора (ω %), ее необходимо перевести в молярную.
В этом случае нужно взять произвольную массу раствора, для удобства расчетов ее принимают за 100 г. Тогда в этой массе раствора содержится 0,37 г гидроксида кальция, или по формуле:
ω =
m (Ca(OH)2) = 
Молярная концентрация это:
С=
n(Ca(OH)2) =
Vраствора =
С(Ca(OH)2) = 
С(ОН — ) = 2 ∙ С(Ca(OH)2) = 2 ∙ 0,05моль/л = 0,1 моль/л (См. уравнение диссоциации)
Находим рОН, а затем рН.
pOH = – lg C(OH – ) = – lg 0,1 = – lg 10 -1 = 1
рН + рОН = 14, тогда
pH = 14 – pOH = 14 – 1 = 13
Пример 3.Какова молярная концентрация раствора соляной кислоты, рН которого равен 2? Чему равна ω этого раствора, если плотность 1 г/см 3 ?
Записываем уравнение электролитической диссоциации HCl:
Зная рН раствора, можно найти молярную концентрацию ионов водорода по формуле:
С (Н + ) = 10 -2 = 0,01 моль/л,
Из уравнения диссоциации следует, что концентрация HCl будет равна концентрации ионов H + , т.е. С (HCl) 0,01 моль/л (М).
Рассчитаем процентную концентрацию этого раствора.
В этом случае нужно взять произвольный объем раствора. Для удобства расчетов принимают объем равным 1 литру (1000 мл), тогда n = 0,01 моль, что следует из формулы:
С=
Находим массу вещества и массу раствора:
m (в-ва) = n ∙ V = 0,01моль ∙ 36,5 г/моль=0,365 г
m (р-ра) = V∙ρ = 1000 мл∙1 г/мл=1000 г
ω = 
Расчет рН при разбавлении и смешивании растворов
Пример 4.10 мл0,01М раствора соляной кислоты разбавили водой до 500 мл. Рассчитайте рН полученного раствора.
Чтобы узнать рН, нужно рассчитать молярную концентрация полученного раствора, т.е. С2.
Следует учесть, что число моль соляной кислоты в процессе разбавления не меняется. Поэтому сколько моль HCl было до разбавления, т.е. в первом растворе, столько моль этой же кислоты окажется и во втором растворе:
C2 = 
C2 =
2-й вариант расчета C2:



значит в 50 раз уменьшилась концентрация полученного раствора по сравнению с исходной , т.е. С1.
C2 =
Записываем уравнение электролитической диссоциации HCl:
Из уравнения диссоциации следует, что С(H + ) = С (HCl) = 0,0002 моль/л.
pH = – lg C(H +) = – lg 0,0002 = – lg 2∙10 -4 = 4 – lg 2= 4 – 0,3 = 3,7
см. таблицу логарифмов
Для перевода концентраций можно использовать формулу:
C =
ω =
В этом случае нужно брать следующие единицы измерения используемых величин:
ω – в долях от единицы,
0,37% раствор гидроксида кальция (ρ = 1 г/мл).
C =
Пример 3.
С (HCl) 0,01 моль/л, ρ = 1 г/мл.
ω = 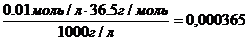
Источник
Как изменится ph раствора при разбавлении водой
Кислоты глубоко вовлечены в бесчисленные биологические, геологические и технологические процессы. Бактерии производят молочную кислоту, которая сохраняет пищу, почвенные кислоты выделяют питательные вещества из минеральных удобрений, а кислоты в батареях приводят к реакциям, которые генерируют электрическую энергию. Соляная кислота, часто сокращенно называемая HCl, является распространенным примером сильной кислоты, и конкретные значения рН могут быть достигнуты с помощью смесей соляной кислоты и воды.
Измерение кислотности
Шкала рН, которая обычно колеблется от 0 до 14, измеряет концентрацию ионов водорода в веществе. Кислоты имеют значения рН менее 7, основания имеют значения рН более 7, а значение рН 7,0 является нейтральной точкой. Шкала рН является отрицательной и логарифмической, что означает, что увеличение концентрации ионов водорода в 10 раз соответствует уменьшению на одну единицу шкалы рН. Добавление кислого вещества в воду снижает общий pH раствора.
Сломанные молекулы, свободные ионы
Когда кислоту добавляют в воду, молекулы кислоты разделяются на отдельные ионы в процессе, известном как диссоциация. Например, молекула соляной кислоты состоит из атома водорода и атома хлора. Когда эти молекулы растворяются в воде, они разделяются на положительно заряженный ион водорода и отрицательно заряженный ион хлора. Это приводит к увеличению концентрации ионов водорода и, следовательно, к снижению рН. Соляная кислота классифицируется как «сильная» кислота, что означает, что практически все молекулы диссоциируют. Многие другие кислоты, такие как уксусная кислота, обычно называемая уксусом, классифицируются как «слабые» кислоты. Лишь некоторые молекулы слабых кислот диссоциируют при добавлении в воду.
Экстремальная кислота
Чистая соляная кислота имеет теоретический pH, равный нулю, иными словами, она чрезвычайно кислая. Однако в практических ситуациях соляная кислота существует только в виде разбавленного вещества. Следовательно, эффективный рН соляной кислоты зависит от степени разбавления. Поскольку pH соляной кислоты настолько низок, большие изменения pH происходят, даже когда к нейтральному раствору, такому как вода, добавляются крошечные количества. Одним из примеров разбавленной соляной кислоты является желудочная кислота человека, которая имеет значение рН около 3.
Прогнозирование pH
Степень изменения pH, возникающая при добавлении в воду сильных кислот, таких как соляная кислота, соответствует коэффициенту разбавления, поскольку все кислые молекулы выделяют один ион водорода. Поскольку шкала рН соответствует логарифмическому соотношению, разведение с коэффициентом 10 соответствует изменению рН на одну единицу. Например, 1 миллилитр соляной кислоты, добавляемой к 10 миллилитрам pH-нейтральной воды, приводит к снижению концентрации ионов водорода на один коэффициент в десять раз. Таким образом, pH конечного раствора будет на одну единицу выше, чем pH исходной соляной кислоты. Если добавить 1 миллилитр соляной кислоты к 100 миллилитрам воды, концентрация ионов водорода уменьшается в два раза по десять, а рН увеличивается на две единицы.
Источник
Мой Аквамир
При подмене воды меняются параметры воды, на сколько сильно, можно увидеть из следующей статьи
pH — активная реакция воды или кислотность
Как известно, химическая формула воды H2O или, если угодно HOH. Структурно это выглядит так: H = O = H
Молекулы воды диссоциируют на ионы: положительный H + и отрицательный OH — .
В химически чистой воде количество положительно заряженных и отрицательно заряженных ионов одинаково, и их концентрация в одном литре равна 10 —7 моль/литр или 0,0000001 г/литр. Чтобы не писать числа с показателем степени, эту характеристику часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину «водородным ателем» или кислотностью и обозначая ее рН:
Если в воду добавить кислоту, например соляную HCl, то ее молекулы в растворе тоже будут диссоциировать на ионы: положительный H + и отрицательный Cl — .
Концентрация положительных ионов возрастет, одновременно уменьшится концентрация отрицательных ионов OH — , так как эти величины взаимосвязаны: чем больше одна, тем меньше другая, и наоборот. В результате кислотность раствора увеличится и pH упадет ниже 7. Если добавить щелочь, то процесс пойдет в обратную сторону, и pH будет увеличиваться.
Изменение значения рН на 1 соответствует изменению концентрации ионов в 10 раз, а на 2 — в 100 раз!. При рН 6 количество ионов Н + в 10 раз больше, чем при рН 7.
Помните об этом, когда изменяете кислотность воды. Небольшие изменения в рН резко изменяют химию воды.
Пример: Предположим ваш аквариум имеет объем 100 литров. Показатель pH равен 7.0, концентрация ионов H + 0.0000001 г/литр и вы хотите подменить в нем 30 литров воды.
pH подмениваемой воды равен 6.0, концентрация ионов в 10 раз больше, 0.0000001 г/литр.
Чтобы узнать pH воды после подмены, нужно определить количество ионов H + в вашем аквариуме: в 100 литрах содержится 0.00001 г ионов H + (100*0.0000001 = 0.00001 граммов). Сливаем 30 литров, получаем 0.000007 г ионов (0.0000001*70).
В в 30 литрах свежей воды содержится 0.000001*30 = 0.00003 г ионов H + . Смешиваем, получаем 0.00003+0.000007 = 0.000037 граммов ионов, их концентрация равна 0.00000037 г/литр, а итоговый pH = -lg(0.00000037) = 6.43
Помните, что эта зависимость не прямопропорциональная, а логарифмическая!
Например, если pH подмениваемой воды равен 8, то в итоге вы получите
pH = -lg(((100*0.0000001-30*0.0000001)+(0.00000001*30))/100) = 7.13
Если вы смените половину воды, получите
pH = -lg(((100*0.0000001-50*0.0000001)+(0.00000001*50))/100) = 7.26
Если вода в вашем аквариуме имеет pH=6, и вы подмение половину воды c pH=8, то в результате получите не среднеарифметический pH = (6+8)/2 = 7, а
pH = -lg(((100*0.000001-50*0.000001)+(0.000000001*50))/100) = 6.3
Меняя объемы и концентрации, вы легко сможете определить pH воды в вашем аквариуме после подмены.
При растворении в воде углекислого газ CO2 образуется слабая угольная кислота H2CO3, которая сначала диссоциирует на ионы HCO3 — и Н + , а затем происходит вторичная диссоциация иона HCO3 — на ионы HCO3 2— и еще один Н + , что значительно снижает кислотность.
kH — карбонатный буфер или временная жесткость воды
Жесткость воды определяется наличием растворенных в ней минералов и во многом определяет остальные свойства воды. Несмотря на огромное количество всяких растворенных в воде минералов, только некоторые определяют ее жесткость.
Жесткость воды делится на две части: постоянную — gH и временную или переменную (карбонатную) — kH. Карбонатная жесткость обусловлена присутствием в воде солей угольной кислоты кальция Ca(HCO3)2 и магния Mg(HCO3), а точнее концентрацией ионов карбонатов CO3 — и бикарбонатов HCO3 — . Временной жесткость называется потому, что при кипячении гидрокарбонаты разлагаются, и образующиеся карбонаты кальция и магния в значительном количестве выпадают в осадок, а углекислый газ испаряется:
Выпадающий осадок образует так называемую накипь на стенках посуды, в которой кипятится вода. За счет кипячения и удаления гидрокарбонатов из воды она умягчается.
Карбонатная жесткость характеризует буферную способность воды противостоять изменению рН. Это происходит потому что ионы HCO3 — связывают свободные ионы H + , происходит так называемая нейтрализация:
Когда количество свободных ионов H + превысит количество ионов HCO3 — , буфер заполнится и pH начнет снижаться. То есть этот процесс и происходит при добавлении в воду углекислого газа: сначала образуется угольная кислота, ионы H + связываются буфером kH и pH при этом какое-то время остается постоянным. Потом количество свободных ионов H + увеличивается и pH падает.
Почему при добавлении углекислого газа изменяется kH?
Это происходит потому, что, как уже было сказано, при подаче CO2 в воде образуется небольшое количество угольной кислоты (0.1-0.2%), она диссоциирует на ион H + и бикарбонат HCO3 — (основа KH), концентрации этих ионов увеличиваюется, что приводит к понижению рН и увеличению kH. Взаимосвязь
Другими словами, значение kH — это количество бикарбонатов HCO3 — в воде, которые нейтрализуют действие постоянно образующихся в аквариуме кислот, например нитратов, понижающих pH, удерживая тем самым pH от понижения. Соответственно чем больше бикарбонатов HCO3 — в воде (путем подачи CO2), тем ниже уровень pH и выше уровень kH.
Выводы
Таким образом из статьи можно сделать следующие выводы:
1. pH меняется при:
- подменах воды !
- при подаче CO2
- при накоплении в аквариуме
2. Рассчитать pH после подмены можно по следующей формуле:
Источник