- Метанол: химические свойства и получение
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Как метанол реагирует с водой
- Симптомы острого отравления:
- Лечение отравлений:
- Нормативные документы, связанные с веществом:
- Критическая температура (в °C):
- Критическое давление (в МПа):
- Критическая плотность (в г/см 3 ):
- Дополнительная информация:
- Дополнительная информация:
- Источники информации:
- Физические свойства
- Химические свойства
- Строение молекулы
- Номенклатура
- Физические свойства
- Получение метанола
- Металлорганический синтез
- Химическая характеристика
- Окисление спиртов
- Дегидратация
- Применение метилового спирта
- Влияние метанола на организм человека
Метанол: химические свойства и получение
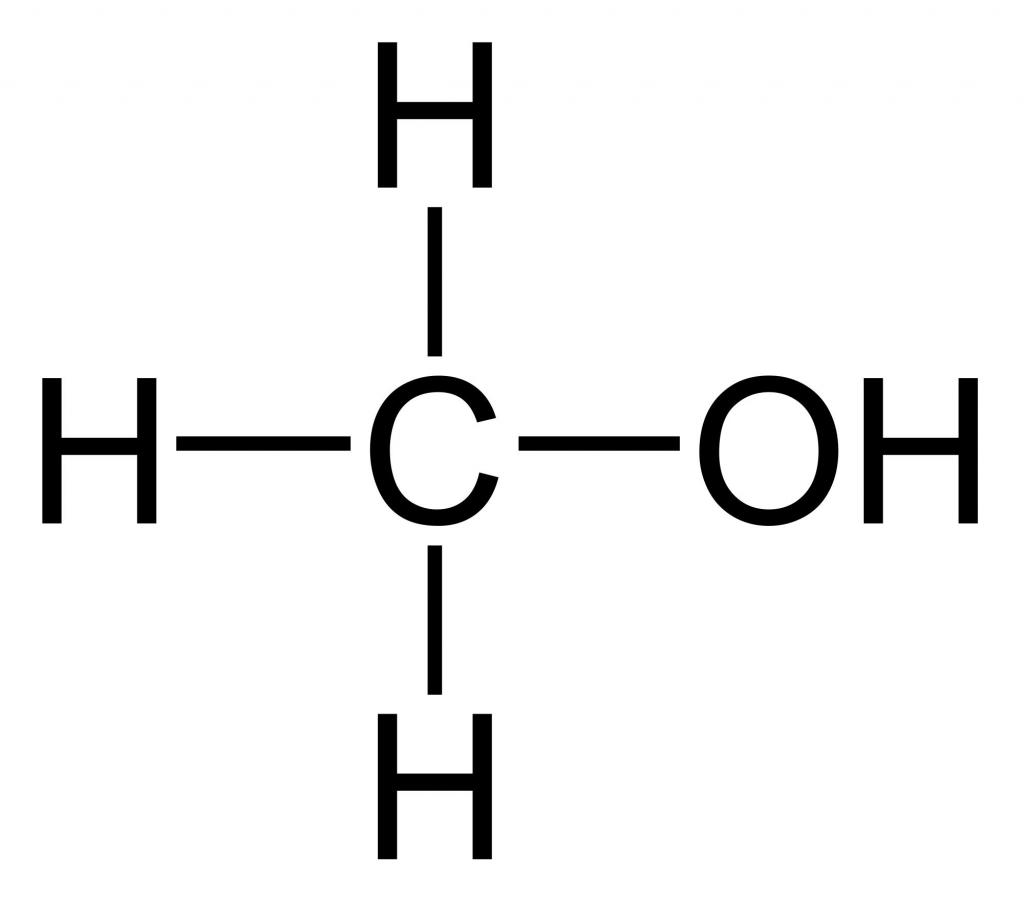
Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Получение метанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Источник
Как метанол реагирует с водой
Смертельня доза для человека при приеме внутрь 40-250 мл.
Доза вызывающая слепоту 5-10 мл.
Симптомы острого отравления:
Симптомы отравления зависят от дозы. При легком отравлении отмечается быстрая утомляемость, головная боль, тошнота. Отравления средней тяжести сопровождаются сильной головной болью, головокружением, тошнотой, рвотой и угнетением центральной нервной системы. Расстройства зрения начинаются через 2-6 дней и могут быть временными и постоянными в виде полной слепоты. При тяжелом отравлении после таких начальных симтомов, как головная боль, тошнота и рвота, опьянение, быстро развивается кома. Дыхание поверхностное, цианоз, зрачки расширены, артериальное давление понижается. Смерть наступает от паралича дыхания и ослабления сердечно-сосудистой деятельности (примерно у 25% больных с тяжелыми отравлениями) на фоне выраженного декомпенсированного метаболического ацидоза.
Лечение отравлений:
При попадании метилового спирта внутрь нужно срочно вызвть рвоту и промыть желудок водой или, лучше, 1-2% раствором гидрокарбоната натрия, дать солевое слабительное. В качестве антидота применяют этиловый спирт: вначале дают 100 мл 30% раствора внутрь, затем каждые 2 часа по 50 мл 4-5 раз, в последующие сутки 2-3 раза по 100 мл в день. В коматозном состоянии этиловый спирт вводят внутривенно капельно в виде 5-10% раствора (до 1 мл на килограмм в сутки в расчете на 96% спирт). Обязателен форсированный диурез и ощелачивание плазмы. Показан преднизолон (30-60 мг внутривенно). При амблиопии (слепоте) внутривенно капельно вводят 200 мл 40% раствора глюкозы и 20 мл 2% раствора новокаина, 20 ЕД инсулина под кожу, АТФ — 2-3 мл 1% раствора вводят внутримышечно повторно.
Нормативные документы, связанные с веществом:
- ГОСТ № 6995-77 «Реактивы. Метанол-яд. Технические условия.» (Описание документа: Метанол категорий хч, чда, ч.)
- Гигиенические нормативы (ГН) № 2.1.5.1315-03 «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования » (Описание документа: ПДК в питьевой воде)
— предельно допустимая концентрация (мг/л) в питьевой воде = 3 - МУК № 4.1.598-96 «Методические указания по газохроматографическому определению ароматических, серусодержащих, галогенсодержащих веществ, метанола, ацетона и ацетонитрила в атмосферном воздухе»
- ПНД Ф № 14.1:2:4.201-03 «Методика выполнения измерений массовой концентрации ацетона и метанола в пробах питьевых, природных и сточных вод газохроматографическим методом»
- Постановление правительства РФ № 964 от 29.12.2007 «Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации» (Описание документа: Списки ядовитых и сильнодействующих веществ.)
- Приказ федерального агентства по рыболовству № 20 от 18.01.2010 «Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения» (Описание документа: ПДК для водных объектов, имеющих рыбохозяйственное значение.)
— предельно допустимая концентрация (мг/л) в природной воде = 0,1 (санитарный показатель) - Санитарные правила (СП) № 2.3.3.2892-11 «Санитарно-гигиенические требования к организации и проведению работ с метанолом.»
- Санитарные правила и нормы (СанПиН) № 2.1.4.1074-01 от 26.09.2001 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества» (Описание документа: ПДК в воде централизованного водоснабжения)
— предельно допустимая концентрация (мг/л) в питьевой воде = 3
Критическая температура (в °C):
Критическое давление (в МПа):
Критическая плотность (в г/см 3 ):
Дополнительная информация:
Тройные неазеотропные смеси: метанол — этанол — вода, метанол — вода — ацетон, метанол — вода — пропионовый альдегид, метанол — вода — метилацетат, метанол — вода — изопропанол, метанол — вода — диметоксиметан, метанол — вода — винилацетат, метанол — вода — метилакрилат, метанол — вода — 2-метилпропан, метанол — вода — бензол, метанол — вода — циклогексен, метанол — вода — гексан, метанол — вода — бензойная кислота, метанол — вода — толуол, метанол — этанол — ацетон, метанол — ацетон — изопропанол, метанол — метилацетат — бензол, метанол — триметилборат — тетрагидрофуран, метанол — бензол — толуол.
Хорошо поглощает пары воды, углекислый газ. Хорошо растворяет газы.
Дополнительная информация:
Не дает азеотропов с водой, тетрафторэтиленом, ацетальдегидом, окисью этилена, уксусной кислотой, 1,2-дибромэтаном, ацетамидом, нитроэтаном, хлорэтаном, этанолом, этиленгликолем, диметилсульфоксидом, пропионитрилом, метилхлоорацетатом, пропаналем, аллиловым спиртом, пропанамидом, 1-нитропропаном, 2-нитропропаном, изопропанолом, метилцеллозольвом, глицерином, пиразином, бутаналем, 1-иодбутаном, изобутанолом, 1-бутанолом, трет-бутанолом, метилбутиратом, этилпропионатом, пиперидином, 1-пентанолом, нитробензолом, этилбензолом.
Источники информации:
- CRC Handbook of Chemistry and Physics. — 90ed. — CRC Press, 2010. — С. 5-20
- Dean J.A. Lange’s handbook of chemistry. — 1999. — С. 5.83
- Seidell A. Solubilities of organic compounds. — 3ed., vol.2. — New York: D. Van Nostrand Company, 1941. — С. 43-55
- Smallwood I.M. Handbook of organic solvent properties. — 1996. — С. 61-63
- Wilhoit R. C., Zwolinski B. J. Physical and Thermodynamic Properties of Aliphatic Alcohols. — American Chemical Society, 1973. — С. 1-40 — 1-54
- Гурвич Я.А. Справочник молодого аппаратчика-химика. — М.: Химия, 1991. — С. 229
- Караваев М.М., Леонов В.Е., Попов И.Г., Шепелев Е.Т. Технология синтетического метанола. — М.: Химия, 1984
- Краткая химическая энциклопедия. — Т. 3: Мальтаза-Пиролиз. — М.: Советская энциклопедия, 1964. — С. 190-194
- Некрасов Б.В. Основы общей химии. — Т.1. — М.: Химия, 1973. — С. 557-558
- Неотложная помощь при острых отравлениях: Справочник по токсикологии. — Под ред. Голикова С.Н. — М.: Медицина, 1977. — С. 105
- Овчинников В.И., Назимок В.Ф., Симонова Т.А. Производство терефталевой кислоты и ее диметилового эфира. — М.: Химия, 1982. — С. 229-230
- Огородников С.К., Лестева Т.М., Коган В.Б. Азеотропные смеси: Справочник. — Л.: Химия, 1971. — С. 684-687
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 161
- Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. — 2-е изд., Ч.1. — М.: Бином. Лаборатория знаний, 2005. — С. 222
- Справочник по растворимости. — Т.1, Кн.1. — М.-Л.: ИАН СССР, 1961. — С. 374
- Справочник химика. — 2 изд., Т.1. — Л.-М.: Химия, 1966. — С. 555 (плотность)
- Справочник химика. — Т.2. — Л.-М.: Химия, 1964. — С. 786-787
- Справочник химика. — Т.3. — М.-Л.: Химия, 1965. — С. 380-381
- Хёрд Ч.Д. Пиролиз соединений углерода. — Л.-М.: ГОНТИ РКТП СССР, 1938. — С. 137-138
- Химическая энциклопедия. — Т.3. — М.: Советская энциклопедия, 1992. — С. 63-64
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
- Написать вопрос на форум сайта (требуется зарегистрироваться на форуме). Там вам ответят или подскажут где вы ошиблись в запросе.
- Отправить пожелания для базы данных (анонимно).
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер
Физические свойства
Метанол (метиловый спирт) СН3ОН представляет собой бесцветную легкоподвижную жидкость с температурой кипения 64,65 о С, температурой кристаллизации -97,9 о С и плотностью 0,792 т/м 3 . Критическая температура метанола равна 239,65 о С. [7]
Метанол смешивается во всех отношениях с водой, спиртами, бензолом, ацетоном и другими органическими растворителями, образуя с некоторыми из них азеотропные смеси. Не растворим в алифатических углеводородах. В водных растворах образует эвтектику, содержащую 93,3% молекулярного метанола.
Метанол хорошо растворяет многие газы, в том числе оксиды углерода, ацетилен, этилен и метан, вследствие чего используется в технике для абсорбции примесей из технологических газов.
Метиловый спирт в твердом состоянии существует в двух кристаллических формах, переходящих одна в другую при -115,75 о С. Пары сухого метанола образуют с воздухом взрывчатые смеси с пределами взрываемости: нижний 6% объемных и верхний 34,7% объемных. Метанол токсичен и очень ядовит. [7]
Химические свойства
Химические свойства метанола типичны для всех одноатомных спиртов. [7]
- 1. Реакции с разрывом связи О-Н:
- а) реакции с щелочными металлами:
Метанол более слабая кислота, чем вода. Его соли (алкоголяты) полностью гидролизуются:
б) образование сложных эфиров под действием минеральных и органических кислот:
R-CO-OH+ CH3OH>R-CO-O-CH3 + Н2О
Атом водорода отщепляется от спирта, а группа ОН — от кислоты.
- 2. Реакции с разрывом связи С-О.
- а) слабые основные свойства метанола проявляются в обратимых реакциях с галогеноводородами:
- б) межмолекулярная дегидратация с образованием простых эфиров:
- 2СН3ОН>СН3-О-СН3+Н2О
- 3. Важная промышленная реакция — синтез формальдегида:
В отличие от углеводородов, кислородсодержащие органические вещества имеют комплекс атомов, называемый функциональной группой. Метанол – это предельный спирт, имеющий в составе своей молекулы гидроксильную группу. Она и определяет основные характеристики данного соединения. В нашей статье мы рассмотрим способы получения метилового спирта, важнейшие химические реакции и применение метанола.
Строение молекулы
Для того чтобы выяснить строение метилового спирта, нужно вспомнить, какой вид имеет молекула простейшего предельного углеводорода – метана. Она выражается формулой CH4 и содержит один атом карбона, связанный с помощью простых сигма-связей с атомами водорода.
Если один из них заместить на гидроксильную группу –OH, получим формулу CH3OH. Это метанол. Валентный угол, построенный направлением связи C-O-H, составляет примерно 110⁰, поэтому молекулы одноатомных спиртов имеют угловую форму. Вследствие того, что электроотрицательность кислорода (3,5 эВ) больше, чем карбона (2,5 эВ), связь кислород – углерод очень поляризована, а гидроксогруппа играет роль заместителя, имеющего отрицательный индуктивный эффект. Таким образом, метанол – это спирт, у которого дипольный момент равен 1,69D.
Номенклатура
Рассмотрим три способа образования названия вещества, имеющего формулу CH3OH. Исторически оно образуется от названия углеводородного радикала, к которому присоединилась гидроксильная группа. Радикал CH3 — это метил, поэтому спирт CH3OH именуют метиловым. По Женевской номенклатуре, к названию соответствующего углеводорода – алкана – прибавляют суффикс –ол. Соединение будет называться метанолом. Это название наиболее распространено и используется достаточно часто. В рациональной номенклатуре рассматриваемое нами соединение называется карбинолом.
Физические свойства
Низшие спирты, содержащие до трех атомов карбона, куда входит и метанол, – это жидкости, смешивающиеся с водой в любых пропорциях. Карбинол имеет выраженный алкогольный запах, однако совершенно непригоден для употребления внутрь, так как является сильнейшим нейротоксичным соединением. Плотность его меньше единицы и составляет 0,791 D4 20 . Температуры плавления и кипения равны -97,9 ⁰C и +94,5 ⁰C соответственно.
Получение метанола
Гидролиз соответствующих галогеноалкилов в присутствии гидроксидов активных металлов, например, щелочных или щелочноземельных, и при нагревании – это распространенный метод получения карбинола. В качестве исходных веществ берут хлор- или бромметан, результатом реакции будет замещение атома галогена функциональной группой –OH и получение метанола.
Еще один метод, ведущий к образованию первичных предельных спиртов – это восстановление альдегидов или карбоновых кислот. Для данной окислительно-восстановительной реакции применяют такие сильные восстановители, как натрийборгидрид или литийалюминийгидрид. Исходными соединениями являются муравьиная кислота или формальдегид. Один из современных методов получения карбинола – это его синтез из углерода, воды, водорода и монооксида углерода. Процесс проходит при температуре +250 °C, повышенном давлении и в присутствии окислов цинка и меди в качестве катализаторов. Новым, но экономически оправданным можно назвать метод получения спирта из микроскопических водорослей океанов и морей, биомасса которых действительно огромна. Растительный субстрат подвергают брожению, выделяющийся метан собирают и далее окисляют до метанола. Большими преимуществами производства биометанола считают отсутствие потребности в использовании запасов пресной воды, электроэнергии и чистоту технологии.
Металлорганический синтез
Если на органические вещества с карбонильной группой в составе молекул подействовать магнийорганическими соединениями, можно получить одноатомные спирты. Металлоорганические реагенты добывают при взаимодействии магниевых металлических стружек и бромсодержащих производных алканов в среде сухого диэтилового эфира. Из муравьиного альдегида данной реакцией можно получить не только метанол, применение которого ограничено, но и другие первичные предельные спирты.
Химическая характеристика
У карбинола нет ярко выраженных свойств кислот или оснований, к тому же водный раствор вещества не действует на индикаторы. Типичные реакции метанола – это взаимодействие с активными металлами и карбоновыми кислотами. В первом случае образуются алкоголяты металлов, во втором – сложные эфиры. Например, натрий вытесняет атомы водорода в функциональной гидроксильной группе спирта:
Взаимодействие между метиловым спиртом и уксусной кислотой приводит к образованию метилацетата, или метилового эфира уксусной кислоты:
Приведенная выше реакция именуется этерификацией и имеет важное практическое значение.
Окисление спиртов
Реакции метанола, приводящие к получению альдегидов, рассмотрим на примере его взаимодействия с оксидом меди. Если в раствор метанола опустить раскаленную проволоку из меди, покрытую оксидом, то ощущается особый неприятный запах образовавшегося формальдегида. А тусклая поверхность проволоки становится яркой и блестящей вследствие восстановления чистой меди.
Дегидратация
При нагревании и при наличии гигроскопических веществ от молекул спиртов происходит отщепление частиц воды. В продуктах можно обнаружить непредельные углеводороды ряда этилена. В условиях высокой концентрации воды и при пониженной температуре можно получить простые эфиры. Так, из метанола можно добыть диметиловый эфир.
Применение метилового спирта
Метиловый спирт используют в качестве ингибитора гидратов, образующихся в газовых трубопроводах, так как важные свойства метанола — это хорошая растворимость в воде и низкая температура замерзания. Основной объем метилового спирта используется в производстве фенолформальдегидных смол. Высокое октановое число, характерное для карбинола, позволяет применять его в качестве экологически чистого топлива для автомобилей. В лакокрасочной промышленности карбинол используют в качестве растворителя.
Влияние метанола на организм человека
Древесный спирт абсолютно непригоден для использования в качестве алкогольного напитка, так как является сильнейшим токсическим веществом. Попав в желудочно-кишечный тракт, он начинает окисляться до муравьиной кислоты и муравьиного альдегида. Продукты окисления поражают зрительные нервы и сетчатку глаза, содержащую рецепторы. Наступает слепота. Муравьиная кислота, обладающая высокой кумулятивной способностью, разносится кровью к печени и почкам, разрушая эти жизненно важные органы. В результате отравления метанолом имеет место летальный исход, так как способы очистки крови от метаболитов оказываются неэффективными.
В нашей статье мы ознакомились со свойствами, применением и способами получения метанола.
Источник