- Химическое разложение веществ действием воды
- Альтернативные вопросы в кроссвордах для слова гидролиз
- Определение слова гидролиз в словарях
- Примеры употребления слова гидролиз в литературе.
- Классификация реакций
- Разложение вещества под воздействием воды
- Альтернативные вопросы в кроссвордах для слова гидролиз
- Определение слова гидролиз в словарях
- Примеры употребления слова гидролиз в литературе.
- Реакции разложения
- См. также
- Примечания
- Полезное
- Смотреть что такое «Реакции разложения» в других словарях:
- Что такое реакция разложения в химии? Примеры реакции разложения
- Что называется реакциями в химии, какие виды их бывают и от чего они зависят
- Что такое реакция разложения (расщепления)
- Как выглядит уравнение рассматриваемой реакции
- Виды реакций расщепления
- Реакция разложения перманганата калия (KMnO4)
- Термолиз хлората калия (KClO3)
- Электролиз и радиолиз воды (Н20)
- Расщепление алканов: метан
- Разложение этана
Химическое разложение веществ действием воды
Последняя бука буква «з»
Ответ на вопрос «Химическое разложение веществ действием воды «, 8 (восемь) букв:
гидролиз
Альтернативные вопросы в кроссвордах для слова гидролиз
Определение слова гидролиз в словарях
Википедия Значение слова в словаре Википедия
Гидро́лиз — сольволиз водой. Это химическая реакция взаимодействия вещества с водой , при которой происходит разложение этого вещества и воды с образованием новых соединений. Гидролиз соединений различных классов ( соли , углеводы , белки , сложные эфиры.
Примеры употребления слова гидролиз в литературе.
В цистерне произошел гидролиз белка на его составляющие элементы, как это, скорее всего, происходит на планете.
Опыты с озимой пшеницей Украинка показали, что у неяровизированных растений процесс ферментативного образования сахарозы превалирует над процессом гидролиза, распада этого вещества.
Всего 4,2 процента водорода в объеме помещения достаточно, чтобы началась взрывная реакция гидролиза, в результате которой образуется всего-навсего обыкновенная вода.
В силу этого при так называемом обмене веществ очень простые и порой однообразные химические реакции окисления, восстановления, гидролиза, фосфоролиза, альдольного уплотнения, разрыва углеродной связи и т.
Опарину удалось показать, что озимые всегда характеризуются более высоким отношением ферментативного синтеза к гидролизу, т.
Источник: библиотека Максима Мошкова
Источник
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Разложение вещества под воздействием воды
Последняя бука буква «з»
Ответ на вопрос «Разложение вещества под воздействием воды «, 8 (восемь) букв:
гидролиз
Альтернативные вопросы в кроссвордах для слова гидролиз
Определение слова гидролиз в словарях
Википедия Значение слова в словаре Википедия
Гидро́лиз — сольволиз водой. Это химическая реакция взаимодействия вещества с водой , при которой происходит разложение этого вещества и воды с образованием новых соединений. Гидролиз соединений различных классов ( соли , углеводы , белки , сложные эфиры.
Большая Советская Энциклопедия Значение слова в словаре Большая Советская Энциклопедия
(от гидро. и греч. lýsis ≈ разложение, распад), реакция ионного обмена между различными веществами и водой. В общем виде Г. можно представить уравнением: где А≈В ≈ гидролизующееся вещество, А≈Н и В≈ОН ≈ продукты Г. Равновесие в процессе Г. солей подчиняется.
Примеры употребления слова гидролиз в литературе.
В цистерне произошел гидролиз белка на его составляющие элементы, как это, скорее всего, происходит на планете.
Опыты с озимой пшеницей Украинка показали, что у неяровизированных растений процесс ферментативного образования сахарозы превалирует над процессом гидролиза, распада этого вещества.
Всего 4,2 процента водорода в объеме помещения достаточно, чтобы началась взрывная реакция гидролиза, в результате которой образуется всего-навсего обыкновенная вода.
В силу этого при так называемом обмене веществ очень простые и порой однообразные химические реакции окисления, восстановления, гидролиза, фосфоролиза, альдольного уплотнения, разрыва углеродной связи и т.
Опарину удалось показать, что озимые всегда характеризуются более высоким отношением ферментативного синтеза к гидролизу, т.
Источник: библиотека Максима Мошкова
Источник
Реакции разложения
Реакции разложения — химические реакции, в которых из одного, более сложного вещества образуются два или более других, более простых веществ [1] .
Фактором, вызывающим разложение, могут являться различные физические воздействия. Соответственно, выделяют различные виды реакций разложения:
- биодеградация (биологический распад, биоразложение) — разложение в результате деятельности живых организмов;
- сольволиз — реакция обменного разложения между растворенным веществом и растворителем:
- алкоголиз — растворителем выступает какой-либо спирт;
- гидролиз — растворителем выступает вода;
- и т. д.
- радиолиз — разложение под действием ионизирующих излучений;
- термолиз — под действием повышенной температуры:
- пиролиз — термическое разложение органических соединений без доступа воздуха.
- и др.
См. также
Примечания
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Реакции разложения» в других словарях:
Энергия активации реакции разложения H2O2 — Условия реакции Энергия активации, кДж/моль некаталитическая 76 катализатор Pt 57 катализатор каталаза 29 … Химический справочник
РАЗЛОЖЕНИЯ РЕАКЦИИ — РАЗЛОЖЕНИЯ РЕАКЦИИ, химические реакции, при которых из одного сложного вещества (см. СЛОЖНОЕ ВЕЩЕСТВО) образуется несколько более простых веществ (см. ПРОСТОЕ ВЕЩЕСТВО). Реакции разложения, являясь эндотермическим процессом, часто сопровождаются… … Энциклопедический словарь
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
Разложения реакции — Реакции химические, в которых из одного вещества образуются два или более веществ. Например, окись ртути при нагревании разлагается на ртуть и кислород: 2HgO = 2Hg + O2; хлористое серебро при действии света разлагается на серебро и хлор:… … Большая советская энциклопедия
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
Химические реакции — Этим термином называется тот процесс, во время которого взятые тела превращаются в новые, ранее не существовавшие. В русском языке мы имеем два слова для выражения этого понятия: X. взаимодействие и X. превращение. Из них нужно отдать… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ЦЕПНЫЕ РЕАКЦИИ — ЦЕПНЫЕ РЕАКЦИИ, хим. реакции, каждый элементарный акт к рых с определенной, отличной от нуля вероятностью влечет за собой еще один элементарный акт. Этот второй акт с той же вероятностью повлечет за собой третий и т. д. Средняя длина (число… … Большая медицинская энциклопедия
МОНОМОЛЕКУЛЯРНЫЕ РЕАКЦИИ — (от моно . и молекула), химические реакции, в которых изменяется состав или строение только одной частицы (молекулы (см. МОЛЕКУЛА), радикала (см. РАДИКАЛЫ СВОБОДНЫЕ), иона (см. ИОНЫ)). Мономолекулярные реакции эндотермичны и для их начала… … Энциклопедический словарь
Топохимические реакции — Реакции химические, происходящие на границе раздела твёрдых фаз. Примеры Т. р.: дегидратация кристаллогидратов, восстановление окислов, термический распад азидов тяжёлых металлов и т.д. Особенности Т. р.: 1) они начинаются не во всём… … Большая советская энциклопедия
Источник
Что такое реакция разложения в химии? Примеры реакции разложения
Реакции разложения играют большую роль в жизни планеты. Ведь именно они способствуют уничтожению отходов жизнедеятельности всех биологических организмов. Кроме того, этот процесс ежедневно помогает человеческому телу усваивать различные сложные соединения путем расщепления их на простые (катаболизм). Помимо всего перечисленного, данная реакция способствует образованию простых органических и неорганических веществ из сложных. Давайте узнаем больше об этом процессе, а также рассмотрим практические примеры химической реакции разложения.
Что называется реакциями в химии, какие виды их бывают и от чего они зависят
Прежде чем изучить информацию о разложении, стоит узнать о химических процессах в целом. Под этим названием подразумевается способность молекул одних веществ взаимодействовать с другими и образовывать таким способом новые соединения.
К примеру, если между собою провзаимодействуют кислород и две молекулы водорода, в результате получится две молекулы оксида гидрогена, который мы все знаем под названием вода. Данный процесс можно записать с помощью такого химического уравнения: 2Н2↑ + О2↑ → 2Н2О.
Хотя существуют разные критерии, по которым различают химические реакции (тепловой эффект, катализаторы, наличие/отсутствие границ раздела фаз, изменение степеней окисления реагентов, обратимость/необратимость), чаще всего их классифицируют по типу превращения взаимодействующих веществ.
Таким образом, выделяется четыре вида химических процессов.
Все вышеперечисленные реакции графически записываются с помощью уравнений. Общая их схема выглядит таким образом: А → Б.
В левой части этой формулы находятся исходные реагенты, а в правой – вещества, образующиеся вследствие реакции. Как правило, для ее начала необходимо воздействие температурой, электричеством или использование катализирующих добавок. Их наличие также должно указываться в химическом уравнении.
Что такое реакция разложения (расщепления)
Для этого вида химического процесса характерно образование двух и больше новых соединений из молекул одного вещества.
Говоря более простым языком, реакцию разложения можно сравнить с домиком из конструктора. Решив построить машинку и кораблик, ребенок разбирает начальное строение и из его деталей сооружает желаемое. При этом структура самих элементов конструктора не меняется, так же как это происходит с атомами вещества, участвующего в расщеплении.
Как выглядит уравнение рассматриваемой реакции
Несмотря на то, что на разъединение сложного вещества на более простые составляющие способны сотни соединений, все подобные процессы происходят по одному принципу. Изобразить его можно с помощью схематической формулы: АБВ → А+Б+В.
В ней АБВ – это начальное соединение, подвергшееся расщеплению. А, Б и В – это вещества, образованные из атомов АБВ в процессе реакции разложения.
Виды реакций расщепления
Как уже было сказано выше, чтобы начать какой-то химический процесс, часто необходимо оказать определенное воздействие на реагенты. В зависимости от типа подобной стимуляции, выделяют несколько видов разложения:
- Биорасщепление (биологическое разложение). Его суть — в распаде более сложных соединений на простые под воздействием живых организмов (микроорганизмов). Иллюстрацией данного процесса может быть гниение или разложение мусора.
Термолизом называется расщепление веществ под воздействием высоких температур. У этого вида есть подвид – пиролиз. При реакции разложения такого вида для ее проведения вещества не только подогревают, но и лишают доступа кислорода и других окислителей к ним.
Электролизом именуется расщепление соединений с помощью электрического тока.
Радиолиз – распад вещества под воздействием ионизирующего излучения. Кстати, этот процесс активно используется в лучевой терапии.
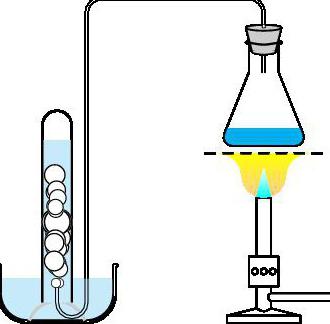
Реакция разложения перманганата калия (KMnO4)
Разобравшись с теорией, стоит рассмотреть практические примеры процесса расщепления веществ.
Первым из них станет распад KMnO4 (в простонародье именуется марганцовкой) вследствие нагревания. Уравнение реакции разложения перманганата калия выглядит таким образом: 2KMnO4 (t 200°С) → K2MnO4 + MnO2 + O2↑.
Из представленной химической формулы видно, что для активации процесса необходимо нагреть исходный реагент до 200 градусов по Цельсию. Для лучшего протекания реакции марганцовку помещают в вакуумный сосуд. Из этого можно сделать вывод, что данный процесс является пиролизом.
В лабораториях и на производстве он проводится для получения чистого и контролируемого кислорода.
Термолиз хлората калия (KClO3)
Реакция разложения бертолетовой соли — это еще один пример классического термолиза в чистом виде.
Проходит упоминаемый процесс в два этапа и выглядит таким образом:
Также термолиз хлората калия можно провести и при более низких температурах (до 200 °С) в один этап, но для этого нужно, чтобы в реакции приняли участие катализирующие вещества – оксиды различных металлов (купрум, ферум, манган и т. п.).
Уравнение такого рода будет выглядеть таким образом: 2KClO3 (t 150 °С , MnO2) → KCl + 2О2.
Как и перманганат калия, бертолетова соль используется в лабораториях и промышленности для получения чистого кислорода.
Электролиз и радиолиз воды (Н20)
Еще одним интересным практическим примером рассматриваемой реакции будет разложение воды. Его можно произвести двумя способами:
- Под воздействием на оксид гидрогена электрического тока: Н2О → Н2↑ + О2↑. Рассматриваемый способ получения кислорода используют подводники на своих субмаринах. Также в будущем его планируют употреблять для получения водорода в больших количествах. Главным препятствием для этого сегодня являются огромные энергетические затраты, необходимые для стимуляции реакции. Когда будет найден способ их минимизировать, электролиз воды станет основным способом производства не только водорода, но и кислорода.
- Расщепить воду можно и при воздействии на нее альфа-излучением: Н2О → Н2О + +е — . В результате этого молекула оксида гидрогена теряет один электрон, ионизируясь. В таком виде Н2О + снова вступает в реакцию с другими нейтральными молекулами воды, образуя высокореактивный гидроксид-радикал: Н2О+ Н2О + → Н2О + ОН. Потерянный электрон, в свою очередь, также параллельно реагирует с нейтральными молекулами оксида гидрогена, способствуя их распаду на радикалы Н и ОН: Н2О + е — → Н + ОН.
Расщепление алканов: метан
Рассматривая различные способы разъединения сложных веществ, стоит уделить особое внимание реакции разложения алканов.
Под этим названием скрываются предельные углеводороды с общей формулой СХН2Х+2. В молекулах рассматриваемых веществ все атомы карбона соединены одинарными связями.
Представители этого ряда встречаются в природе во всех трех агрегатных состояниях (газ, жидкость, твердое тело).
Все алканы (реакция разложения представителей этого ряда — ниже) легче воды и не растворяются в ней. При этом они сами являются отличными растворителями для других соединений.
Среди основных химических свойств таких веществ (горение, замещение, галогенирование, дегидрирование) — и способность расщепляться. Однако данный процесс может происходить как полностью, так и частично.
Вышеупомянутое свойство можно рассмотреть на примере реакции разложения метана (первый член алканового ряда). Этот термолиз происходит при 1000 °С: СН4↑ → С+2Н2↑.
Однако если проводить реакцию разложения метана при более высокой температуре (1500 °С), а потом резко снизить ее, этот газ расщепится не полностью, образуя этилен и водород: 2СН4↑ → C2H4↑ + 3H2↑.
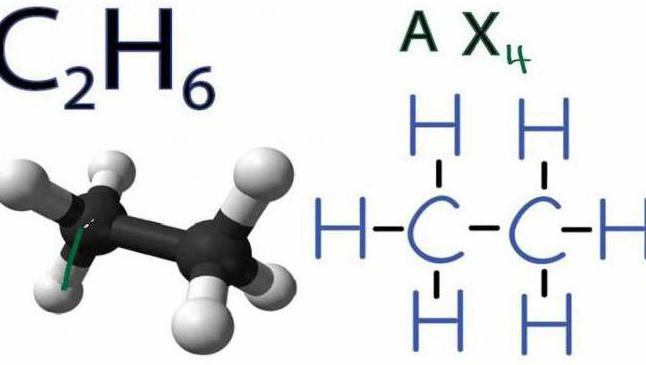
Разложение этана
Второй член рассматриваемого алканового ряда — это С2Н4 (этан). Реакция разложения его происходит также под воздействием высокой температуры (50 °С) и при полном отсутствии кислорода или других окислителей. Выглядит она следующим образом: C2H6↑ → C2H4↑ + H2↑.
Представленное выше уравнение реакции разложения этана до водорода и этилена нельзя считать пиролизом в чистом виде. Дело в том, что данный процесс происходит с присутствием катализатора (например, металла никеля Ni или водяного пара), а это противоречит определению пиролиза. Поэтому о представленном выше примере расщепления корректно говорить как о процессе разложения, происходящем при пиролизе.
Стоит отметить, что рассмотренная реакция в промышленности широко используется для получения самого производимого органического соединение в мире – газа этилена. Однако из-за взрывоопасности C2H6 чаще этот простейший алкен синтезируют из других веществ.
Рассмотрев определения, уравнение, виды и различные примеры реакции разложения, можно сделать вывод, что она играет очень большую роль не только для человеческого организма и природы, но и для промышленности. Также с ее помощью в лабораториях удается синтезировать многие полезные вещества, что помогает ученым проводить важных химические исследования.
Источник