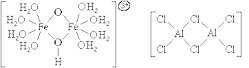Соединение вещества с водой (6 букв)?
Вам ответить страшно рад:
ляжет в клеточки гидрат,
и кроссвордная эрудиция
должна этим термином вполне удовлетвориться.
когда обжигают мел,
получают известь негашеную СаО,
а потом гасят водой ее.
Тут очень все просто:
это и есть известка.
Соединение вещества с водой называется гидратом. Следовательно, в слове «гидрат» необходимые шесть букв. Если оксиды взаимодействуют с водой, то их соединения в общем виде наз. гидроксидами. Ответ: гидрат.
Чтобы ответить на этот вопрос, нужно вспомнить, какой же элемент главный в формуле воды. Правильно, это гидроген! Вот благодаря его названию вещества, соединенные с водой, называют гидратами. А иногда — просто растворами. Но раствор может быть в разных жидкостях.
Если нет воды, то обращаться нужно в водоканал. У них у всех есть телефоны аварийной службы (круглосоточные). Звоните и узнаете. Также можно дозвониться и до УК, также Вам подскажут в чем проблема и когда она будет устранена.
Думаю самое удивительное свойство воды — память, давно доказано что вода может реагировать на звуковые вибрации и положительную или отрицательную энергетику, и при этом менять форму своих кристаллов в зависимости от ситуации.
Диффузия теплой воды в холодную происходит, но это процесс медленный и в реальности он происходит в точке перехода от изолированной трубы к не изолированной, т.е. в очень небольшом объеме. Процессу мешает периодическое открывание крана, так как не изолированная труба в этот момент заполняется холодной водой.
Как уже отмечалось под водой может гореть много что, достаточно создать условия. В воде могут гореть те вещества и составы, которые выделяют достаточно тепла, чтоб вода их не погасила и которые либо содержат окислитель в своем составе, либо для которых воды является окислителем.
Охотничьи спички, бикфордов шнур — это скорее горение вещества под водой, так как там созданы условия, предотвращающие контакт воды с горящим веществом. Газовые горелки с подачей горючего газа и окислителя — тоже вариант горения под водой.
Термит может гореть в/под водой, если он был подожжен на воздухе. Натрий и калий загораются при контакте с водой и могут гореть в ней при насильном погружении (они легче воды), правда их горение легко переходит во взрывную реакцию. Щелочноземельные металлы (магний, кальций) горят в воде, если их предварительно поджечь на воздухе или сильно разогреть в толще воды источником тепла. Есть много активных металлов, которые подожженные на воздухе, при достаточном объеме горения, могут продолжать гореть в толще воды (алюминий, цирконий, уран и др.).
Источник
Как называется соединение вещества с водой
1.2. Химические свойтсва воды
Вода активное в химическом отношении вещество.
1. Вода реагирует со многими металлами с выделением водорода .
Железо реагирует с водой при нагревании по реакции:
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях такого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
С + H2O = H2 + СО (при сильном нагревании)
2. Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
3. Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения.
4. Некоторые оксиды металлов также могут вступать во взаимодействие с водой.
СаО + Н2О = Са(ОН)2 гидроксид кальция или гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически нерастворима в воде и поэтому с водой не реагирует. Это ZnO, TiO2, Cr2O3, из которых приготавливают стойкие к воде краски. Оксиды железа и алюминия также не растворимы в воде и не реагируют с ней.
5. Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
NaOH + H2O = NaOH H2O гидрат едкого натра
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С помощью их, например, удаляют водяные пары из влажного атмосферного воздуха.
6. Особая реакция воды – синтез растениями крахмала (С6Н10О5)n и других подобных соединений (углеводов), происходящая с выделением кислорода.
7. В комплексных соединениях вода является лигандом и координируется как катионами [Cr(H2O)6]Cl3, [Pt(H2O)2Cl4], так и анионами [A(H2O)m]n-.
8. При взаимодействии с солями происходит гидролиз последних с образованием кислых, основных и средних солей:
Процесс ступенчатого гидролиза солей используют при очистке воды с помощью коагулянтов. Например, при использовании в качестве коагулянта сернокислого алюминия, ступенчатый гидролиз соли протекает по схеме:
Источник
Утилизация Нефтесодержащих Отходов в РФ
Давайте вспомним все уже известные нам реакции, в которых участвует вода. Для этого вновь напишем уравнения встречавшихся ранее реакций и систематизируем их. Оказывается, вода – весьма активное в химическом отношении вещество.
Давайте вспомним все уже известные нам реакции, в которых участвует вода. Для этого вновь напишем уравнения встречавшихся ранее реакций и систематизируем их. Оказывается, вода – весьма активное в химическом отношении вещество.
1) Вода реагирует со многими металлами с выделением водорода:
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O = H2 + CO (при сильном нагревании)
2) Электролиз. Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
Химические свойства воды. 1 Вода реагирует со многими металлами с выделением водорода.
Возможно, Н означает, что полимер относится к типу углеводородных: в сети можно встретить
Соединение вещества с водой (6 букв)?
Соединение вещества с водой называется гидратом. Следовательно, в слове «гидрат» необходимые шесть букв. Если оксиды взаимодействуют с водой, то их соединения в общем виде наз. гидроксидами. Ответ: гидрат.
Чтобы ответить на этот вопрос, нужно вспомнить, какой же элемент главный в формуле воды. Правильно, это гидроген! Вот благодаря его названию вещества, соединенные с водой, называют гидратами. А иногда – просто растворами. Но раствор может быть в разных жидкостях.
Первые две аббревиатуры – это, несомненно, сокращения полимеров. Почему два? Потому что кувшин сделан из двух полимеров: из одного – наружный корпус (бесцветный), а из другого – часть ручки и внутренняя временная емкость для фильтрующейся воды (тоже прозрачный, но синего цвета).
Проще всего оказалось расшифровать РС, потому что это сокращение очень распространенное: polycarbonate, поликарбонат (такое название, потому что мономером служит эфир угольной кислоты). Из поликарбонатов делают линзы, компакт-диски, защитные шлемы и многое другое. Сложнее было узнать, что такое SAN. Это САН-пластик, по-английски сокращение от styrene acrylonitrile copolimer, сополимер стирола и акрилонитрила. Он отличается высокой химической стойкостью. А вот что означает H003, выяснить не удалось, хотя эти знаки кое-где встречаются, например:
Возможно, Н означает, что полимер относится к типу углеводородных: в сети можно встретить
А цифры 003 могут быть просто номером полимера по каталогу.
Скорее всего, это флуоресцеин. На солнечном свету щелочной раствор флуоресцеина, даже при ничтожной концентрации вещества, имеет очень яркий изумрудно-зеленый цвет – в результате флуоресценции. В проходящем свете этот раствор имеет желтый цвет, а сухое вещество красно-коричневый порошок, который довольно легко синтезировать даже в простейшей лаборатории. Но я никогда не знал, что это пищевой краситель. Думаю, что это ошибка.
А «применение» флуоресцеина очень «красочно» описал американский физик Роберт Вуд, известный многими своими проказами. Вот выдержка из книги Вильяма Сибрука «Роберт Вильямс Вуд» (с добавлением – «Современный чародей физической лаборатории»). Эта книга есть в интернете, в ней описаны многие его «фокусы». Итак,
Думаю самое удивительное свойство воды – память, давно доказано что вода может реагировать на звуковые вибрации и положительную или отрицательную энергетику, и при этом менять форму своих кристаллов в зависимости от ситуации.
Гидратация –присоединение молекул воды к молекулам, атомам или ионам. Гидратация может быть с разрушением и без разрушения молекул воды.
В основном все те животные, которые живут в воде то и рожают в ней же. Есть очень редкие исключению, но всё равно большинство рожает именно в воде. Таких животных по научному называют – Аквипары, а слово это образовалось от латинских слов » aqua «, что означает » вода » и » parere » – » рождать «. Самыми крупными из них являются киты и дельфины, именно они и рожают своих детёнышей в воде. Следует напомнить, то детёныши дельфинов рождаются даже хвостом вперёд, а в это время женская половина дельфинов окружает роженицу во время » схваток «, тем самым поддерживая и оберегая от хищников её.
Таким образом ответом на данный вопрос следует считать – Аквипары ( 8 букв ).
Сложнее было узнать, что такое SAN. Соединение вещества с водой называется гидратом.
26. У смесей не бывает … агрегатного состояния.
Тесты по химии 8 класс. Тема: “Чистые вещества и смеси”
Правильный вариант ответа отмечен знаком +
1. Какой метод подходит для выделения йода из раствора K[I3]+H2O+C2H5OH?
2. Дайте определение понятию «твёрдая смесь»:
+ это смесь, в которой одна жидкость распределяется в другой
– это смесь, в которой пузырьки газа распределяются в жидком веществе
– это смесь, в которой один газ распределяется в другом газе
– это смесь, в которой газ распределяется внутри твёрдого вещества
3. Какой материал не относится к фильтровальным?
4. Для проведения химической реакции не используется:
5. Выберите смеси, которые разделяются фильтрованием:
– вода и растительное масло
– глина и речной песок
6. Как называется химический прибор, который используют как в фильтровальных целях, так и с целью переливания жидкостных веществ в ёмкость с узким горлом?
7. Как называется способ разделения смесей, суть которого заключается в разной пропускной способности частиц смеси сквозь фильтрующие материалы?
8. Каким методом можно разделить водный раствор NaCl на чистые соединения?
9. Из предложенных вариантов выберите тот, где указаны чистые вещества:
+ пищевая сода, кислород, вода
– минеральная вода, чай, природный газ
– латунь, молоко, горные породы
тест 10. Насколько правильна представленная ниже трактовка относительно правил техники безопасности при выполнении работ в химической лаборатории?
А. Пробирку необходимо фиксировать в держателе штатива возле её отверстия.
Б. Как только пробирка прогрелась по всей поверхности, следует нагревать соединения, вступающие в реакцию.
+ правильна лишь трактовка А
– правильна только трактовка Б
– неправильны обе трактовки
11. Основное отличие чистых веществ от смесей – это …:
– сохранение химических свойств
– стабильный качественный, количественный состав
+ сохранение как физических, так и химических свойств
– стабильные физические свойства
12. К чистым веществам относится:
– «гремучая смесь» (смесь водорода с кислородом)
– «царская водка» (смесь концентрированных соляной и азотной кислот)
13. Правдивы ли следующие утверждения?
А. Запрещается зажигать одну спиртовку от другой.
Б. Для тушения пламени спиртовки следует как можно сильнее подуть на него.
– правдивы оба утверждения
+ правдиво лишь утверждение А
– правдиво только утверждение Б
– неправдивы оба утверждения
14. Выберите способы, при которых смесь разделяется только в процессе нагревания:
– применение магнита, фильтрование
15. Фильтрованием легко разделяется смесь, которая состоит из:
– древесных и железных опилок
16. К неоднородным смесям относятся:
– воздух, гранит, морская вода
– стекло, раствор марганцовки, сахарный сироп
– спиртовая настойка йода, молоко, кровь
17. Оцените, насколько верны приведённые ниже суждения относительно поведения в химической лаборатории:
А. Строго запрещено принимать пищу в химической лаборатории.
Б. Находясь в химической лаборатории, нельзя отбирать вещества специальными пипетками, предназначенными для забора порции жидких растворов.
– неверны оба суждения
– верно лишь суждение Б
+ верно лишь суждение А
18. Выберите из списка однородную смесь:
– смесь поваренной соли с песком
19. Чистым веществом является:
тест-20. К неоднородной смеси относится:
21. В результате смешивания … можно получить однородную смесь.
– воды с речным песком
– мыльной пены с зубной пастой
22. Выберите вариант, где указаны только чистые вещества:
– дым, жир с водой, туман
+ поваренная соль, графит, кислород
– воздух, питьевая сода, гранит
– нефть, мрамор, речной песок
23. Правильны ли следующие утверждения?
А. Закрепление в держателе штатива пробирки выполняется так, чтобы она легко поворачивалась при надобности.
Б. Для удержания воронки в штативе используется кольцо.
– правильно утверждение А
– правильно утверждение Б
+ правильны и А, и Б утверждения
– неправильны оба утверждения
24. Однородной смесью является:
25. Какое свойство не сказывается на растворимости CO₂ в H₂O?
+ скорость пропускания тока газа через воду, химическое взаимодействие газа с водой
26. У смесей не бывает … агрегатного состояния.
27. В какой отрасли не используется мрамор?
28. Морская вода содержит в составе соль …
29. Какое из соединений относится к твердой смеси?
тест_30. Как изменяется растворимость твёрдого вещества в процессе растворения с повышением температуры?
У смесей не бывает агрегатного состояния. – нефть, мрамор, речной песок. – неправдивы оба утверждения.
Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; при образовании комплексного соединения из более простых веществ она не меняется.
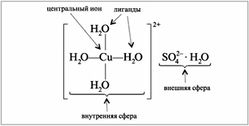
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ С ВОДОЙ
Это целое отдельное исследование, информацию по которому можно найти в специальной литературе. При анализе данной проблемы следует знать гидрохимию, качественный и количественный состав гидросферы, способность ионов металлов и тяжелых металлов в составе гидросферы к гидролизу и гидролитической полимеризации, а также лигандный состав самой гидросферы – наличие в ней органических гуминовых кислот и, следовательно, формы существования в них комплексообразующих ионов металлов.
Комплексные соединения — это частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH, Cl, PO4 3 и др.), а также катион водорода. Различают унидентатные или монодентатные лиганды (связанные с центральным атомом через один из своих атомов, то есть, одной -связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя -связями), тридентатные и т. д.
По заряду комплексные частицы могут быть катионами, анионами, а также нейтральными молекулами. Комплексные соединения, включающие такие частицы, могут относиться к различным классам химических веществ (кислотам, основаниям, солям). Примеры: (H3O)[AuCl4] – кислота, [Ag(NH3)2]OH – основание, NH4Cl и K3[Fe(CN)6] – соли.
Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; при образовании комплексного соединения из более простых веществ она не меняется.
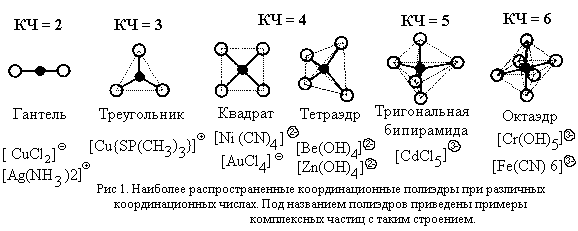
Координационное число определяется количеством лигандов и зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Пример комплексного соединения
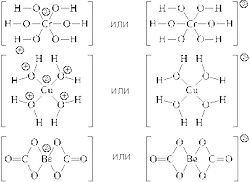
Под действием создаваемого ионом электрического поля молекулы воды определенным образом ориентируются и затем притягиваются к иону противоположно заряженным концом диполя. За счет такого притяжения в растворе образуется гидратированный ион. Если впоследствии раствор будет концентрироваться из него станут выделяться кристаллы растворенного вещества, заключающие в своем составе данный ион. Если при этом непосредственно окружающие его в молекулы воды связаны с ним непрочно, то вода не войдет в состав кристалла. Если связь иона с молекулами воды достаточно прочна, то в состав кристалла он войдет с некоторым числом молекул связанной «кристаллизационной» воды. В результате получится кристаллогидрат данного вещества, представляющий собой комплексное соединение. Например, фиолетовый кристаллогидрат СrСl3 ·6Н2 О является в действительности комплексным соединением [Сr(ОН2 )6 ]Сl3 , в котором комплексообразующий ион (Сr 3+ ) удерживает во внутренней сфере шесть молекул воды. Подобным же образом как комплексные соединения следует рассматривать и многие другие кристаллогидраты солей.
Образование комплексного соединения может происходить при взаимодействии иона не только с водой в водной среде, но и с другими нейтральными молекулами. Например, при действии аммиака на водный раствор СuСl2 образуется комплекс состава [Cu(NH3 )4 ]Cl2 , диссоциирующий на ионы [Cu(NH3 )4 ] 2+ и 2Сl – .
Комплексообразование не обязательно должно протекать в водном растворе – комплексные соединения часто образуются и при взаимодействии твердых веществ с газообразными. Например, безводный СаСl2 в атмосфере газообразного аммиака дает комплекс состава [Ca(NH3 )8 ]Cl2 . При этом сущность самого процесса остается при этом той же самой и заключается в присоединении нейтральных молекул к тому или иному иону соли за счет возникающего между ними взаимного притяжения.
Используются два вида структурных формул комплексных частиц: с указанием формального заряда центрального атома и лигандов, или с указанием формального заряда всей комплексной частицы. Примеры:
Для характеристики формы комплексной частицы используется представление о координационном полиэдре (многограннике).
Входящие в состав комплексных соединений комплексные частицы довольно разнообразны. Поэтому для их классификации используется несколько классификационных признаков: число центральных атомов, тип лиганда, координационное число и другие.
По числу центральных атомов комплексные частицы делятся на одноядерные и многоядерные. Центральные атомы многоядерных комплексных частиц могут быть связаны между собой либо непосредственно, либо через лиганды. И в том, и в другом случае центральные атомы с лигандами образуют единую внутреннюю сферу комплексного соединения:
По типу лигандов комплексные частицы делятся на
1) Аквакомплексы, то есть комплексные частицы, в которых в качестве лигандов присутствуют молекулы воды. Более или менее устойчивы катионные аквакомплексы [M(H2O)n] m , анионные аквакомплексы неустойчивы. Все кристаллогидраты относятся к соединениям, содержащим аквакомплексы, например:
2) Гидроксокомплексы, то есть комплексные частицы, в которых в качестве лигандов присутствуют гидроксильные группы, которые до вхождения в состав комплексной частицы были гидроксид-ионами, например: [Zn(OH)4] 2 , [Cr(OH)6] 3 , [Pb(OH)3].
Гидроксокомплексы образуются из аквакомплексов, проявляющих свойства катионных кислот:
3) Аммиакаты, то есть комплексные частицы, в которых в качестве лигандов присутствуют группы NH3 (до образования комплексной частицы – молекулы аммиака), например: [Cu(NH3)4] 2 , [Ag(NH3)2], [Co(NH3)6] 3 .
Аммиакаты также могут быть получены из аквакомплексов, например:
Окраска раствора в этом случае меняется с голубой до ультрамариновой.
4) Ацидокомплексы, то есть комплексные частицы, в которых в качестве лигандов присутствуют кислотные остатки как бескислородных, так и кислородсодержащих кислот (до образования комплексной частицы – анионы, например: Cl, Br, I, CN, S 2 , NO2, S2O3 2 , CO3 2 , C2O4 2 и т. п.).
Примеры образования ацидокомплексов:
Последняя реакция используется в фотографии для удаления с фотоматериалов непрореагировавшего бромида серебра.
(При проявлении фотопленки и фотобумаги незасвеченная часть бромида серебра, содержащегося в фотографической эмульсии, не восстанавливается проявителем. Для ее удаления и используют эту реакцию ( процесс носит название “фиксирования”, так как неудаленный бромид серебра в дальнейшем на свету постепенно разлагается, разрушая изображение)
5) Комплексы, в которых лигандами являются атомы водорода, делятся на две совершенно разные группы: гидридные комплексы и комплексы, входящие в состав ониевых соединений.
При образовании гидридных комплексов – [BH4], [AlH4], [GaH4] – центральный атом является акцептором электронов, а донором – гидридный ион. Степень окисления атомов водорода в этих комплексах равна –1.
В ониевых комплексах центральный атом является донором электронов, а акцептором – атом водорода в степени окисления +1. Примеры: H3O или [OH3] – ион оксония, NH4 или [NH4] – ион аммония. Кроме того существуют и замещенные производные таких ионов: [N(CH3)4] – ион тетраметиламмония, [As(C6H5)4] – ион тетрафениларсония, [OH(C2H5)2] – ион диэтилоксония и т. п.
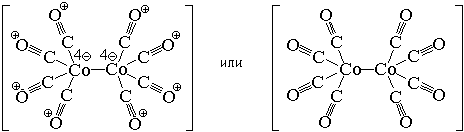
6) Карбонильные комплексы – комплексы, в которых в качестве лигандов присутствуют группы CO (до образования комплекса – молекулы монооксида углерода), например: [Cr(CO)6], [Fe(CO)5], [Ni(CO)4] и др.
7) Анионгалогенатные комплексы – комплексы типа [I(I)2].
По типу лигандов выделяют и другие классы комплексных частиц. Кроме того существуют комплексные частицы с различными по типу лигандами; простейший пример – аква-гидроксокомплекс [Zn(H2O)3(OH)].
Таким образом, комплексные соединения могут быть весьма разнообразны, так и химия комплексных соединений.
Комплексные соединения, включающие такие частицы, могут относиться к различным классам химических веществ кислотам, основаниям, солям. 6 Карбонильные комплексы комплексы, в которых в качестве лигандов присутствуют группы CO до образования комплекса молекулы монооксида углерода , например Cr CO 6 , Fe CO 5 , Ni CO 4 и др.
Источник