Перекись водорода и обезжелезивание воды.
Обезжелезивание и удаление сероводорода из воды. Дозирование перекиси водорода.
Перекись водорода – один из самых сильных окислителей. Окисление железа и сульфида требует меньшей концентрации перекиси водорода в сравнении с хлором. Окислительный потенциал перекиси водорода в 28 раз выше чем у хлора. Перекись водорода в отличии от хлор-реагентов содержит только атомы водорода и кислорода и не создает побочные продукты. Перекись расщепляется в воде с выделением активного атома кислорода. Предварительная стадия окисления перекисью водорода состоит из обычного перистальтического насоса, резервуара для хранения водного раствора пероксида, статического миксера для интенсификации массопереноса и фильтра-обезжелезивателя с противоточным способом промывки для удаления окисленного железа. Для окисления железа применяют стандартный 7% водный раствор перекиси водорода, безопасный в бытовом варианте использования.
После обработки воды перекисью водорода для удаления окисленного железа и серы применяют фильтр с гранулированной загрузкой и противоточной регенерацией. При выборе среды предпочтение отдают гранулированному активированному углю, в идеале – активированному углю с усиленными каталитическими свойствами (Chemviron Carbon Centaur, Sorboscarbon GAC PLUS, Jacobi Aquasorb CX-MCA). Популярные фильтрующие загрузки Birm и Pyrolox с перекисью водорода в качестве окислителя НЕ ПРИМЕНЯЮТСЯ – перекись водорода разрушает эти загрузки. Стандартные и каталитические угли вместе с окисленным железом и сероводородом (сульфидом) расщепляют и удаляют остаточную перекись.
Стабильность раствора и хранение.
Перекись водорода не отличается стабильностью. При применяемой в водоподготовке стандартной концентрации в 7 % в баке для хранения раствора перекись водорода разлагается до Н2О и теряет в месяц около 2% концентрации. Скорость разложения перекиси водорода еще выше с ростом концентрации — 50% раствор снижает в течении месяца концентрацию до 25% (!). Стабилизированная бензоатом натрия (0,05%) 6…7%-перекись водорода сохраняет свою концентрацию приблизительно в 5 раз дольше.
При применении 35 % раствора (концентрация — 350 гр/л, 350000 ppm) его разбавляют до 7% раствора (70 гр/л, 70000 ppm) водой (к 1 части 35% раствора Н2О2 добавляют 4 части дистиллированной воды). Разбавление осуществляют максимально чистой водой, так как перекись водорода реагирует с примесями. Вода, очищенная обратным осмосом, также может применяться для разбавления.
Максимальная концентрация железа – 10 мг/л.
Максимальная концентрация сероводорода не ограничена.
Удаление железа из расчета 0,4 мг/л пероксида водорода на 1 мг/л железа в воде.
Удаление сероводорода из расчета 1 мг/л пероксида водорода на 1 мг/л сероводорода в воде при рН = 7. Повышение рН будет требовать увеличения дозы.
Скорость реакции окисления пероксидом железа и сероводорода намного больше чем у хлорсодержащих окислителей. Практически это означает, что в бытовом варианте применения вместо контактной емкости достаточно статического миксера, ускоряющего массоперенос.
Для дозирования пероксида применяют перистальтический насос с низкой скоростью подачи. Наличие контактной емкости не обязательно. Вместо контактной емкости применяют статический миксер, установленный по направлению потока после точки дозирования пероксида. Дозирование с фиксированной скоростью в воду, подаваемую насосом из скважины, осуществляется в трубопровод до гидроаккумулятора. Фильтр с активированным углем устанавливают после гидроаккумулятора. Ионообменный умягчитель устанавливают после фильтра с активированным углем.
Пример расчета дозирования в воду раствора Н2О2 7%.
Объемная скорость потока воды — 37,5 л/мин ( 10 GPM).
Концентрация железа в воде — 5 мг/л.
Исходная концентрация в растворе 7% Н2О2 — 70000 ppm ( 70 гр/л, 70000 мг/л).
Необходимая концентрация Н2О2 = 5 мг/л Fe x 0,4 мг/л = 2 ppm (2мг/л).
1440 — количество минут в сутки.
Объем дозируемого раствора 7% Н2О2 = 37,5 л/мин (10 GPM) x 2 ppm (5мг/л Fe) x 1440 / 70000=0,41 GPM = 1,55 литра в сутки раствора 7% Н2О2 или 0,065 литров в час раствора 7% Н2О2.
Источник
Применение перекиси водорода для окисления железа подземных вод
Окисление железа является одним из ключевых процессов технологии кондиционирования подземных вод при подготовке к фильтрованию через зернистый слой.
Необходимость обезжелезивания подземных вод при их использовании для хозяйственно-питьевого водоснабжения определяется, в первую очередь, негативным влиянием соединений железа на организм человека. Избыток железа оказывает токсическое действие на печень, селезенку, головной мозг, усиливает воспалительные процессы в организме, приводит к дефициту некоторых микроэлементов (медь, цинк и др.).
Требования по извлечению железа из используемой воды вызваны не только гигиеническими соображениями, а целым рядом нежелательных последствий эстетического, технического и экономического характера: следы на белье, посуде и бытовом водопотребляющем оборудовании; коррозия и отложения в трубопроводах; быстрый выход из строя водонагревательных и водоумягчительных систем.
Следует отметить, что разложение перекиси водорода с одновременным окислением йона двухвалентного железа в трехвалентное и ее каталитическое разложение, вызываемое ионами двух- и трехвалентного железа, изучены достаточно подробно. Ион закисного железа окисляется перекисью водорода согласно следующей стехиометрической реакции:
Эта реакция протекает количественно при избытке иона двухвалентного железа, тогда как при избытке перекиси водорода наряду с окислением закисного железа протекает разложение перекиси водорода с выделением кислорода.
Принято считать, что взаимодействие Н2O2 с аква-ионом Fe 2+ приводит к образованию ÓH-радикала в качестве первичной реакционно-способной частицы. Однако образование гидроксил-радикала в этой реакции – лишь частный случай окислительно-восстановительных превращений промежуточного комплекса Fe 2+ с Н2O2.
Первичный акт взаимодействия Fe 2+ с Н2O2 состоит в замещении координированной молекулы воды:
Образование радикалов ÓH в процессе Фентона в кислой среде свидетельствует о том, что в этих условиях образовавшийся пероксо-комплекс распадается преимущественно на продукты одноэлектронного переноса:
Рост скорости окисления двухвалентного железа при рН>3 связан с диссоциацией координированной воды в комплексе, поскольку диссоциация перекиси водорода приводит к уменьшению ее окислительной способности, тогда как диссоциация воды – к существенному снижению окислительно-восстановительного потенциала пары Fe 4+ /Fe 2+ , что приводит к облегчению внутрисферного двухэлектронного переноса с последующим образованием гидролизованного феррил-иона:
Эта частица может участвовать либо в окислении воды с образованием ÓH-радикала, либо взаимодействовать со вторым ионом железа без образования свободных радикалов:
(OH – )FeО 2+ → Fe 3+ (OH – )2 + ÓH, (6)
(OH – )FeО 2+ + Fe 2+ → 2Fe 3+ OH – . (7)
Вследствие протекания реакций (4,5) с ростом рН эффективная константа скорости окисления Fe 2+ перестает зависеть от рН.
Негидролизованный комплекс FeН2O2 2+ , также как и феррил-ион, может взаимодействовать с «третьей» частицей, в частности, со вторым ионом железа также без образования свободных радикалов:
Другой тип реакций связан с модификацией промежуточного пероксо-комплекса путем замещения координированной воды на вторую молекулу перекиси водорода. В результате возможно осуществление молекулярного (каталазного) механизма разложения перекиси:
Установлено, что в нейтральной водной среде увеличение концентрации как ионов Fe 2+ , так и ионов Fe 3+ приводит к росту скорости процесса распада Н2О2, причем этот рост практически не зависит от рН и концентрации перекиси водорода. Установлено также, что спонтанное разложение Н2O2 в этих условиях происходит на микроколлоидных частицах гидроокиси железа и протекает по нерадикальному механизму.
Очевидно, что при использовании перекиси водорода для окисления железа подземных вод возможно протекание всех перечисленных реакций. Процесс значительно усложняется в слабокислых средах, где более вероятно образование ÓH-радикалов, при наличии в воде органических примесей, а также в присутствии примесей доноров водорода, взаимодействующих с феррил-ионом, и при наличии в воде ионов меди, являющихся сокатализаторами процессов распада Н2O2 и окисления органических веществ. Это делает химию процесса обезжелезивания воды с использованием перекиси водорода достаточно сложной.
Тем не менее, такая технология представляет определенный интерес, особенно в тех случаях, когда традиционные методы обезжелезивания оказываются неэффективными. Впервые технология с использованием перекиси водорода испытана применительно к подземным водам севера Тюменской области. Отличительными особенностями состава этих вод являются низкие значения жесткости (0,15÷0,40 мг-экв/дм 3 ), щелочности (0,29÷0,38 мг-экв/дм 3 ) и температуры воды (0,3÷1,4 0 С). Содержание железа общ. составляет 5,5 ÷ 6,2 мг/дм 3 , в том числе двухвалентного – 4,7÷5,5 мг/дм 3 . Применение классических методов обезжелезивания для воды такого состава не обеспечивает получения нормативного содержания железа в очищенной воде.
Выполненные лабораторные исследования процесса обезжелезивания подземных вод по схеме «окисление Н2O2 – фильтрование» подтвердили высокую эффективность этого метода.
Работа проводилась в условиях действующего водозабора водопроводных очистных сооружения (ВОС) г. Новый Уренгой в осенне-зимний период, при минимальной температуре обрабатываемой воды.
На первом этапе было изучено окисление двухвалентного железа в свободном объеме. В качестве реакционного сосуда был использован химический стакан емкостью 2 л, установленный на магнитной мешалке. Дозирование перекиси водорода в виде 0,1М раствора производилось при помощи лабораторной пипетки. Отбор пробы воды для определения остаточного железа производился через 1 мин. после внесения реагента.
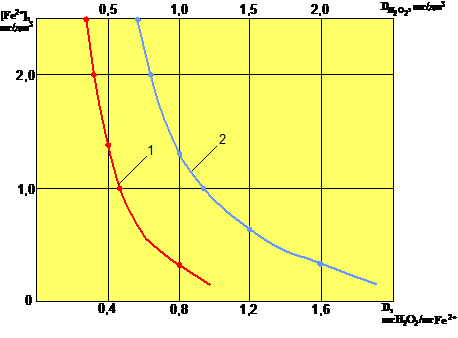
На рис.1 представлена зависимость остаточного содержания двухвалентного железа в нефильтрованной воде от исходной концентрации перекиси водорода и удельной дозы окислителя.
Рис. 1: Зависимость остаточного содержания железа(+2) в нефильтрованной воде от исходной концентрации перекиси водорода (1) и от удельной дозы перекиси водорода (2).
Как показывает зависимость остаточного содержания железа(+2) в нефильтрованной воде от удельной дозы перекиси водорода, теоретическая доза окислителя (0,3 мг/мг) обеспечивает окисление не более 20% закисного железа в исходной воде. По-видимому, это может быть объяснено протеканием в реакционном объеме наряду с окислением двухвалентного железа процессов каталитического разложения Н2O2. Для данных условий проведения реакции (без последующего фильтрования) для достижения остаточной концентрации железа(+2) 0,2 мг/дм 3 необходим 3-кратный избыток окислителя.
На втором этапе работы исходная вода после обработки перекисью водорода сразу же подвергалась фильтрованию через лабораторный песчаный фильтр (Н = 1,2 м, dф. = 0,8 ÷1,6 мм). В отсутствие Н2O2 фильтрование исходной воды через тот же песчаный фильтр не приводит к заметному снижению содержания в воде ионов железа.
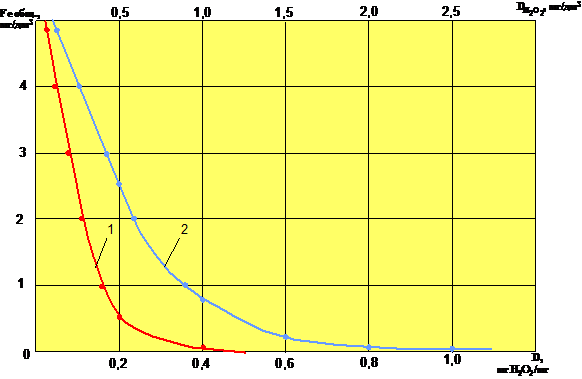
На рис. 2 представлена зависимость остаточного содержания общего железа в фильтрованной воде от исходной концентрации перекиси водорода и удельной дозы окислителя.
Рис. 2: Зависимость остаточного содержания общего железа в
фильтрованной воде от исходной концентрации перекиси водорода (1)
и от удельной дозы перекиси водорода (2).
Как видно из приведенных данных, применение перекиси водорода в качестве окислителя позволяет практически полностью очистить воду от соединений железа: может быть достигнута его остаточная концентрация менее 0,1 мг/дм 3 .
Соответствующая зависимость остаточного содержания общего железа в фильтрованной воде от удельной дозы перекиси водорода показывает, что при протекании основной части процесса в фильтрующем слое реакция окисления железа(+2) преобладает. Для получения остаточной концентрации общего железа на уровне 0,05 ÷ 0,10 мг/дм 3 избыток окислителя не превышает 30% от стехиометрической (расчетной) дозы.
Полученные в лабораторных условиях результаты проверены на пилотной установке производительностью 2,5 м 3 /час. Конструкция установки предусматривала возможность обработки как исходной (холодной) воды, подаваемой из распределительной камеры водогрейных резервуаров, так и подогретой воды, подаваемой из распределительного трубопровода фильтровальной станции ВОС г. Новый Уренгой.
Доза окислителя назначалась нами недостаточной для полного окисления закисного железа, остаточная концентрация железа(+2) находилась в пределах 0,1 ÷ 0,2 мг/дм 3 .
Содержание железа в воде до обработки и после фильтрования приведено в табл.1. Следует отметить, что при обработке холодной воды потребовалось увеличение дозы перекиси водорода в среднем на 11,5 %.
Источник
Удаление железа из воды в бассейне. Пошаговая инструкция.
В природной воде Москвы и Московской области не прошедшей предварительной очистки, очень много загрязняющих элементов. Одним из основных элементов является железо. Прежде чем купаться в такой воде необходимо провести её очистку. Poollife даст рекомендации о том как удалить железо из воды в бассейне и сделать воду максимально прозрачной и чистой.
Шаг 1. Заливаем воду в бассейн.
Шаг 2. С поверхности воды собираем сачком плавающий мусор.
Шаг 3. Рассчитываем необходимую дозу перекиси водорода для вашего объёма. (можно воспользоваться нашими калькуляторами расчёта перекиси водорода).
Шаг 4. Заливаем нужную дозу концентрата перекиси в воду таким образом, чтобы не было брызг. Используем защитные очки и перчатки.
Шаг 5. Через 8-12 часов железо в воде окислится и выпадет в осадок на дно чаши бассейна.
Шаг 6. Осадок необходимо аккуратно собрать со дна пылесосом.
Шаг 7. Если через 12 часов вода стала не достаточно прозрачная (мутная) добавляем жидкий коагулянт в соответствии с инструкцией.
Важный момент!
При высокой концентрации железа в воде, необходимо своевременно делать промывку вашего фильтра т.к. кварцевый песок в фильтре будет забиваться быстрее. Необходимо запускать насос в режим «Обратная промывка» и сливать через него воду пока вода не станет чистой.
Шаг 8. На вторые сутки железо в воде окончательно окислится и полностью выпадет в осадок. Важно, чтобы всё это время работал ваш фильтр и как можно чаще собирать появляющийся осадок со дна пылесосом.
Всё. После того, как вода окончательно станет прозрачной можно купаться.
Для тех, кто любит идеальную воду — после прохождения вышеуказанных шагов можно проверить уровень PH в бассейне использую тестовые полоски индикаторы. Уровень PH должен оставаться не уровне 6,7-7,4.
Источник