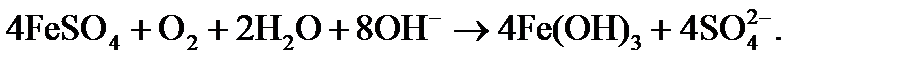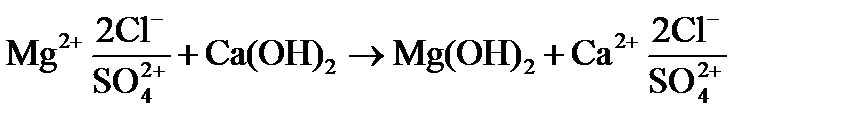Известковая вода
Известковая вода
| Гидроксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Отн. молек. масса | 74.093 а. е. м. |
| Молярная масса | 74.093 г/моль |
| Физические свойства | |
| Плотность вещества | 2.211 г/см³ |
| Состояние (ст. усл.) | белые кристаллы |
| Термические свойства | |
| Температура плавления | 512 °C |
| Химические свойства | |
| Растворимость в воде | 0.185 г/100 мл |
| Классификация | |
| номер CAS | [1305-62-0] |
Гидрокси́д ка́льция — химическое вещество, сильное основание, формула Ca(OH)2. Представляет собой порошок белого цвета, плохо растворимый в воде.
Содержание
Тривиальные названия
- гашёная известь — так как получают путём «гашения» (то есть взаимодействия с водой) «негашёной» извести оксида кальция;
- известковая вода — прозрачный (близкий к насыщенному) водный раствор;
- известковое молоко — водная суспензия.
- пушонка — сухой гидроксид кальция.
Часто называют просто известь или извёстка (так же называют и оксид кальция).
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция экзотермическая, идёт с выделением 16 ккал (67 кДж) на моль.
Свойства
Внешний вид — белый порошок, мало растворимый в воде:
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет щелочную реакцию.
Как и все гидроксиды, реагирует с кислотами (см. реакция нейтрализации) с образованием соответствующих солей кальция:
по этой же причине раствор гидроксида кальция мутнеет на воздухе, так как гидроксид кальция, как и другие сильные основания, реагирует с растворённым в воде углекислым газом:
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
причём при нагревании раствора гидрокарбонат снова разрушается и выпадает осадок карбоната кальция:
Гидроксид кальция реагирует с монооксидом углерода при температуре около 400°C:
Применение
- при побелке помещений;
- для приготовления известкового строительного раствора. Известь применялась для строительной кладки с древних времён. Смесь обычно приготавливают в такой пропорции: к 1 части смеси оксида кальция (негашёной извести) с водой добавляют 3—4 части песка (по массе). При этом происходит затвердевание смеси по реакции:
Это экзотермическая реакция, выделение энергии составляет 27 ккал (113 кДж). Одновременно происходит и образование силиката кальция:
Как видно из реакции, в ходе её выделяется вода. Это является отрицательным фактором, так как в помещениях, построенных с помощью известкового строительного раствора долгое время сохраняется повышенная влажность. В связи с этим, а также благодаря ряду других преимуществ перед гидроксидом кальция, цемент практически вытеснил его в качестве связующего строительных растворов;
- для приготовления силикатного бетона. Состав силикатного бетона одинаков с составом известкового строительного раствора, однако он готовится другим методом — смесь оксида кальция и кварцевого песка обрабатывается не водой, а перегретым (174,5—197,4°C) водяным паром в автоклаве при давлении 9—15 атмосфер;
- для устранения карбонатной жёсткости воды (умягчение воды). Реакция идёт по уравнению:
- для производства хлорной извести;
- для производства известковых удобрений;
- каустификация карбоната натрия и калия;
- дубление кож;
- получение других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч;
- в пищевой промышленности зарегистрирован в качестве пищевой добавкиE526.
- Известковая вода — прозрачный раствор гидроксида кальция. Она используется для обнаружения углекислого газа. При взаимодействии с ним она мутнеет, так как образуется нерастворимый карбонат кальция:
Ca(OH)2 + CO2 → CaCO3↓ + H2O - Известковое молоко — взвесь (суспензия) гидроксида кальция в воде, белая и непрозрачная. Она используется для производства сахара и приготовления смесей для борьбы с болезнями растений, побелки стволов
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Известковая вода» в других словарях:
ИЗВЕСТКОВАЯ ВОДА — водный раствор кальция гидроксида … Большой Энциклопедический словарь
ИЗВЕСТКОВАЯ ВОДА — ИЗВЕСТКОВАЯ ВОДА, насыщенный раствор ГИДРООКИСИ КАЛЬЦИЯ (гашеная известь, Са(ОН)2). Используется для обнаружения углекислого газа (СО2), который выпадает в молочно белый осадок в виде карбоната кальция (СаСО3) и поднимается со дна в виде… … Научно-технический энциклопедический словарь
известковая вода — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN limewater … Справочник технического переводчика
ИЗВЕСТКОВАЯ ВОДА — Aqua calcis. Свойства. Раствор гидрата окиси кальция. Представляет собой 0,15 0,17 % водный раствор кальция гидроокиси. Прозрачная бесцветная без запаха жидкость щелочной реакции. Действие и применение. Местно действует вяжуще и подсушивающе. Пр … Отечественные ветеринарные препараты
известковая вода — водный раствор кальция гидроксида. * * * ИЗВЕСТКОВАЯ ВОДА ИЗВЕСТКОВАЯ ВОДА, водный раствор кальция гидроксида (см. КАЛЬЦИЯ ГИДРОКСИД) … Энциклопедический словарь
известковая вода — kalkių vanduo statusas T sritis chemija apibrėžtis Vandeninis Ca(OH)₂ tirpalas. atitikmenys: angl. lime water rus. известковая вода … Chemijos terminų aiškinamasis žodynas
Известковая вода — насыщенный водный раствор гидроокиси кальция Ca(OH)2 (гашёной извести). 1 л И. в. при 20°С содержит около 1,2 г CaO. В технике применяется как дешёвая щёлочь. См. Кальция гидроокись … Большая советская энциклопедия
Известковая вода — (Aq. Calcis) лечебное средство, получаемое взбалтыванием одной части жженой извести на 10 ч. дистиллированной воды. После взбалтывания воду сливают, смешивают ее с 25 ч. дистиллированной воды. Она употребляется внутрь при изжоге, при английской… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ИЗВЕСТКОВАЯ ВОДА — вод. раствор кальция гидроксида … Естествознание. Энциклопедический словарь
Вода — С древнейших времен стали понимать великое значение воды не только для людей и всяких животных и растительных организмов, но и для всей жизни Земли. Некоторые из первых греческих философов ставили воду даже во главе понимания вещей в природе, и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Источник
ИЗВЕСТКОВАНИЕ ВОДЫ
Известкование производится при обработке исходной воды в осветлителях суспензией гашеной извести Са(ОН)2, называемой известковым молоком. Основное назначение известкования – снижение щелочности обрабатываемой воды. При этом происходит частичное снижение общей жесткости воды, солесодержания, кремнийсодержания, концентрации соединений железа и одновременно из воды удаляются грубодисперсные примеси.
Сущность процесса известкования состоит в том, что при вводе извести достигается повышение рН обрабатываемой воды до значения 9,5 – 10,3, при котором бикарбонаты 
В упрощенном виде при известковании протекают следующие реакции:
1) при вводе извести происходит её диссоциация, приводящая к повышению рН:
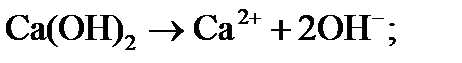
2) в воде появляются ионы ОН — , которые связывают свободную углекислоту с последующей диссоциацией по схеме:
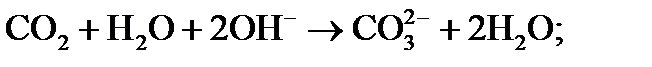
3) происходит диссоциация гидрокарбонатных ионов (бикарбонатов), определяющих щелочность воды:
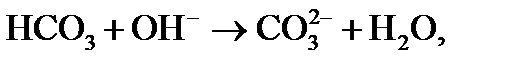
причем по реакции (3) из одного одновалентного иона 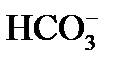
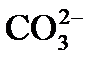
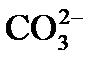
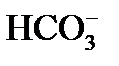
4) выделение в осадок почти нерастворимого СаСО3 происходит при достижении произведения растворимости по карбонату кальция, так как в воде есть кальций, содержащийся в исходной воде, введенный с известью, и вновь образованные карбонаты:
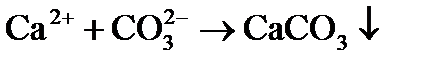
5) при превышении дозы извести над её количеством, необходимым для образования карбонатов в воде, появляется избыток ионов ОН — и может быть превышено произведение растворимости по 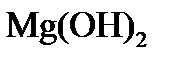

Подсчитаем дозу извести, необходимую для декабонизации, снижения щелочности и переведения ионов Mg 2+ в 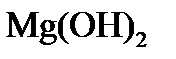
1) для переведения 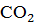
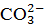
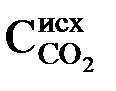
2) для перевода бикарбонатных ионов в карбонатные – в количестве, эквивалентном исходной концентрации 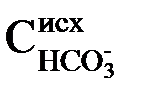
3) для переведения ионов Mg 2+ в 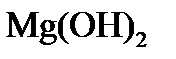

Таким образом, ионы 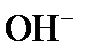
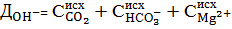
Одновременно с известью вводятся ионы кальция.
Реакции, протекающие при известковании обратимы, поэтому для их смещения в нужном направлении приходится вводить некоторый избыток Са(ОН)2 в количестве 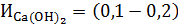
Поэтому практическая доза извести с учетом избытка равна
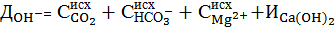
При совмещении процессов известкования и коагуляции в качестве коагулянта используют обычно сульфат двухвалентного железа в дозировке Дк. На образование гидроксида железа при известковании требуется дополнительный расход извести как источника гидроксид-ионов, что должно учитываться при расчете дозы извести согласно реакции
Тогда в формуле (7) следует учесть дозу коагулянта в виде:
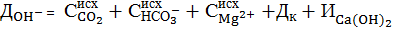
При расчете дозы извести необходимо учитывать ионный состав обрабатываемой воды. Для практического использования расчетная доза извести Ди, мг-экв/дм 3 , определяется для большинства типов вод, для которых 
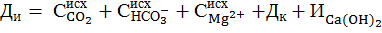
Приведенные реакции (1-9) позволяют определить требуемую дозу извести в процессе известкования с дополнительным осаждением магния. Этот режим называется гидратным и происходит при рН = 10,0 – 10,3.
Формула (9) учитывает расход извести на осаждение магния, но во многих случаях осаждение магния не обязательно.
Режим, в котором осаждение магния не происходит или происходит не полностью, называется карбонатным. В этом случае выделяется, главным образом, СаСО3 при рН = 9,5. Возможны два случая ведения этого режима.
Для вод, имеющих отношение 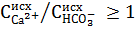
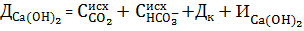
Контроль режима известкования ведется по значению концентрации кальция в известкованной воде, которая должна быть примерно равна:
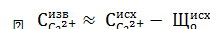
где 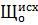
Для вод, имеющих отношение 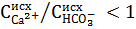
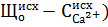
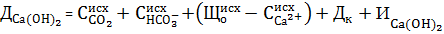
В карбонатном режиме шлам имеет структуру песка, быстро оседает, но столб жидкости над границей раздела осветляется плохо.
В промышленных условиях вести строгий режим дозирования извести, обеспечивающий отсутствие гидратной щелочности, практически невозможно. Поэтому обычно процесс известкования проводят в гидратном режиме с остаточной гидратной щелочностью, равной 0,1 – 0,3 мг-экв/дм 3 (формула 8). В гидратном режиме образуется шлам, имеющий однородную творожную структуру с крупными хорошо осаждающимися хлопьями. К преимуществам гидратного режима известкования относится также то, что присутствие гидроксида магния в осадке способствует снижению кремнийсодержания на 25 – 30 % за счет адсорбции ионов 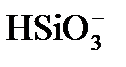
Передозировка извести по отношению к доле выделенного магния Mg 2+ при гидратном режиме не сопровождается снижением жесткости и щелочности, а вызывает замену некарбонатной магниевой жесткости на кальциевую по реакции
К моменту прохождения всех стадий известкования остаточная карбонатная щелочность (т.е. сумма 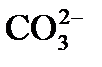
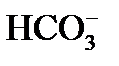
Ухудшение реальных результатов по щелочности, концентрациям ионов Са 2+ (на 0,15 – 0,3 мг-экв/дм 3 ) и Mg 2+ (на 0,1 – 0,15 мг-экв/дм 3 ) в процессе известкования по сравнению с равновесными их значениями связывают с влиянием кинетических факторов: достаточно медленной кристаллизацией образующейся твердой фазы СаСО3 и Mg(OH)2 при приближении системы к состоянию равновесия и «тормозящей» роли органических примесей (защитных коллоидов) исходной воды, а также с выносом из осветлителя микрокристаллов твердой фазы.
6. Лабораторная работа № 1
М е т о д и к а п р о в е д е н и я р а б о т ы и о б р а б о т к а
р е з у л ь т а т о в о п ы т о в
Работа выполняется в следующей последовательности:
а) выполняются анализы исходной воды согласно методикам аналитического контроля, приведенным в прил. 1: необходимо определить окисляемость, общую жесткость и общую щелочность;
сначала проводят анализ окисляемости, для чего ставят кипятить пробу с исходной водой в термостойкой колбе с добавленными в неё реактивами, засекают время с момента закипания;
пока кипятится проба на окисляемость, проводят анализы исходной воды на общую жесткость и щелочность;
затем заканчивают анализ окисляемости согласно методике;
аналогично выполняется анализ окисляемости для контрольной пробы с дистиллятом;
б) для проведения процесса коагуляции в коническую колбу емкостью 750 мл отбирают 500 мл исходной воды и нагревают её до 40 о С, контролируя температуру нагрева воды лабораторным термометром; по указанию преподавателя корректируют значение рН, добавляя в исходную подогретую воду 0,1 н раствор НCl или 0,1 н раствор NaOH из бюреток в заданном количестве;
в) проводят процесс коагуляции, для чего в воду добавляют дозу коагулянта, указанную преподавателем (1% раствор Al2(SO4)3 или FeSO4); содержимое колбы осторожно перемешивают 5 – 8 минут, затем оставляют в покое в течение 15 — 25 минут;
г) фильтруют коагулированную воду через бумажный фильтр, уложенный в воронку, осторожно сливая отстоявшуюся прозрачную жидкость; к концу фильтрования переносят на фильтр осадок;
д) проводят в коагулированной воде определение окисляемости, общей жесткости и общей щелочности;
е) результаты анализов заносят в отчет.
С о д е р ж а н и е о т ч е т а
Отчет по работе должен содержать:
— описание процесса коагуляции;
— описание условий проведения коагуляции (корректировка рН, доза и тип коагулянта);
— рабочие записи при выполнении анализов воды, в которых указывается методика определения, реактивы, используемые для анализа, расчет результатов титрования;
— результаты анализов оформляются в виде табл. 1;
— выводы, поясняющие эффективность процесса коагуляции;
— ответы на контрольные вопросы.
Таблица 1. Результаты измерений
| Исследуемая вода | Окисляемость | рН | Щелочность, мг-экв/дм 3 | Жесткость, мг-экв/дм 3 |
| мг О2/дм 3 | % сни- жения | Общая | Некарбо- натная | |
| Исходная | ||||
| После коагуляции |
Некарбонатную жесткость вычисляют по формуле: Жнк=Жо – Жк; карбонатную жесткость Жк принимают равной бикарбонатной щелочности, определенной в результате анализов исходной и коагулированной воды.
К о н т р о л ь н ы е в о п р о с ы
1. Какие примеси природных вод удаляются в процессе коагуляции?
2. Какие коагулянты используются в процессах обработки воды?
3. Почему при использовании коагулянта Al2(SO4)3 необходимо поддерживать определенные значения рН?
4. Как изменяется щелочность воды при коагуляции?
5. Как изменяется жесткость воды при коагуляции?
6. С какой целью воду перед коагулированием подогревают?
Источник