- Химия, Биология, подготовка к ГИА и ЕГЭ
- Ртуть
- Что нейтрализует ртуть? Раствор для демеркуризации ртути
- Жидкий металл
- Ртуть дома
- Такой привычный градусник
- Живое и ртуть
- Что происходит?
- Если это случилось
- Уборка разбитого ртутного градусника по шагам
- Что нейтрализует ртуть?
- Что лучше — хлорка или марганцовка?
- Для полного спокойствия
Химия, Биология, подготовка к ГИА и ЕГЭ
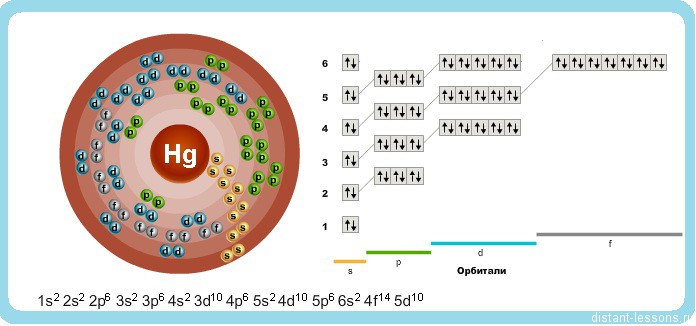
Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
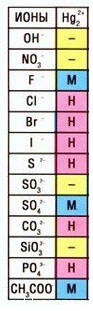
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Оксид — HgO (относят к слабым основным или даже амфотерным оксидам);Гидроксид — не выделен
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Источник
Ртуть
Общие сведения и методы получения
Ртуть ( Hg ) — серебристо-белый тяжелый металл, жидкий при комнатной температуре. При замерзании ртуть становится белой, в твердом состоянии легко поддается обработке и имеет зернистый излом. Самородная ртуть была известна за 2000 лет до н. э. Народы древней Индии н Китая, а также греки и римляне применяли киноварь (природный HgS ) как краску, лекарственное и косметическое средство. Греческий врач Диоскорид (I в. до н.э.), нагревая киноварь в железном сосуде с крышкой, получил ртуть в виде паров, которые конденсировались на ее внутренней поверхности. Продукт реакции был назван hydrargyros
(от греческого hydor — «вода» и argyros — «серебро»), т.е. жидким серебром. Происхождение русского названия «ртуть» не установлено
Твердая ртуть впервые получена в 1759 г. в Петербурге М. П. Брауном и М. В. Ломоносовым, которым удалось заморозить ее в смеси снега с концентрированной азотной кислотой.
Ртуть — весьма редкий элемент. Ее среднее содержание в земной коре —4,5- 10 _б % (по массе). Примерно в таком же количестве она содержится в изверженных горных породах. Известно 35 рудных минералов, содержащих ртуть в таких концентрациях, при которых промышленное использование этих минералов технически возможно и экономически целесообразно. Основной рудный минерал — киноварь HgS
с содержанием ртути 86,2 %. Из других минералов следует отметить метацинабарит, самородную ртуть или лнвингстонит, кордероит, ртуть-содержащие сульфасоли и т. д.
Ртутные руды делятся на богатые (
1 % Hg ), рядовые (0,2—0,3 % Hg ) и бедные (0,06—0,12% Hg ). Основное промышленное значение имеют телетермальные месторождения ртутных руд, которые разрабатываются подземным способом. Встречается ртуть также в разрабатываемых открытым способом вулканогенных месторождениях.
Существуют два основных способа извлечения ртути — пиро- и гидрометаллургический. В первом случае руды или концентраты, содержащие ртуть в виде HgS , подвергают окислительному обжигу. Полученная в результате обжига жидкая ртуть стекает в специальные приемники. Для последующей очистки ее пропускают через высокий (1,0—1,5 м) сосуд с 10 %-ной HN 03, промывают водой, высушивают и перегоняют в вакууме. Второй способ получения ртути состоит в растворении HgS в сернистом натрии н последующем вытеснении ртути алюминием. Разработаны способы извлечения ртути путем электролиза сульфидных растворов.
Атомные характеристики. Атомный номер 80, атомная масса 200,59 а. е. м., атомный объем 14,26*10 -6 м 3 /моль, атомный радиус 0,157 нм, нонный радиус Hg 2+ 0,110 нм. Конфигурация внешних электронных оболочек 5d 10 6s 2 . Потенциалы ионизации J (эВ): 10,43; 18,76; 34,21. Электроотрицательность 1,44. Твердая ртуть имеет ромбоэдрическую решетку с периодами а=0,3463 и с=0,671 нм. Известно семь устойчивых изотопов ртути с массовыми числами: 196 (распространенность 0,2 %), 198 (10%), 199 (16,8%), 200 (23,1 %), 201 (13,2%), 202 (29,8 %) и 204 (6,9%).
В соединениях проявляет степень окисления +2 и +1.
Ртуть является относительно стойким в химическом отношении элементом. По отношению к кислороду занимает место вблизи золота н серебра. Из металлов подгруппы цннка ртуть наименее активна вследствие высокой энергии ионизации. Нормальные электродные потенциалы реакций диссоциации 2 Hg ->-( Hg 2 ) 2+ + 2 e , ( Hg 2 ) 2+ ^-2 Hg 2 ++2 e н Hg ->—»- Hg 2+ +2 e равны соответственно 0,80; 0,91 н 0,86 В. Электрохимический эквивалент ртутн со степенью окисления +1 2,0789 мг/Кл, а со степенью окисления +2 1,03947 мг/Кл. Ртутные соединения относительно нестойки нз-за постоянной тенденции ртутн к переходу в атомную форму.
В соляной и разбавленной серной кислотах, а также в щелочах ртуть не растворяется. Легко растворяется в азотной кислоте, а при нагревании в концентрированной серной. Растворима в царской водке. Со слабыми кислотами ртуть не дает солей нли образует неустойчивые соли типа Hg 2 CQ 3 , которая прн нагревании до 180 °С разлагается на ртуть, ее оксид н С02.
С галогенами ртуть образует почти недиссоцнирующие, в большинстве своем ядовитые соединения. Практическое значение имеют йодная ртуть Hgl 2 , хлористая ртуть (каломель) Hg 2 Cl 2 н хлорная ртуть (сулема) HgCl 2 . Йодную ртуть получают воздействием ноднстого калия на растворенные в воде солн ртути. В аналитической химии с помощью этой реакции выявляют присутствие ртутн. Йодная ртуть существует в двух модификациях — красной и желтой. Переход из красной модификации в желтую происходит при 127 °С; обратный переход протекает медленно н требует переохлаждения. Каломель представляет собой бесцветные тетраэдрнческне кристаллы, постепенно темнеющие вследствие распада под действием света на сулему и ртуть. Сулема имеет внд бесцветных кристаллов ромбической формы. Чаще всего сулему получают прямым восстановлением ртутн.
Ртуть растворяется в расплавленном белом фосфоре, однако химических соединений не образует и прн остывании выделяется из расплава в химически неизменном виде.
Сернистую ртуть можно получить простым растиранием ртути с серным цветом при комнатной температуре. Сульфид ртутн HgS можно легко получить, воздействуя на ртуть сероводородом прн повышенных температурах.
На воздухе ртуть прн комнатной температуре не окисляется. При продолжительном нагреве до температур, близких к температуре кипения, ртуть соединяется с кислородом воздуха, образуя красный оксид (И) ртути HgO , который прн дальнейшем нагревании снова распадается на ртуть н кислород. В этом соединении степень окисления ртути равна + 2 Известен и другой окснд ртутн — черного цвета. Степень окисления ртутн в нем равна +1, его формула Hg 2 0 Во всех соединениях ртути (I) ее атомы связаны между собой, образуя двухвалентные группы — Hg 2 — илн — Hg — Hg —. Подобная связь сохраняется и в растворах солей ртути (I).
Известно существование гидрида HgH 2 , получаемого в результате взаимодействия нодида ртутн и литий — алюминий гидрида. Однако гидрид ртути очень неустойчив и распадается уже при 148 К.
Гидроксиды ртутн неизвестны. В тех случаях, когда можно ожидать нх образования, они вследствие своей неустойчивости немедленно отщепляют воду, образуя безводные оксиды.
Помимо галогенидов, известны и другие соли ртути Среди них сернистая ртуть HgS ; известны соли ртутн (И) цианистой и роданистой кислот, а также «гремучая ртуть» — соль гремучей кислоты— Hg ( ONC )2. Почти все солн ртути (И) плохо растворимы в воде. Исключение составляет нитрат Hg ( N 03)2. При воздействии на солн ртути аммиака образуются многочисленные комплексные соединения, например белый плавкий преципитат HgCl -2 NH 3 , белый неплавкий преципитат HgNH 2 Cl и т. п. Известны два основных типа ртутьорганнческнх соединений: R — Hg — R ‘ н R — HgX , где R и R ‘ — органические радикалы, X —кислотный остаток. Этн соединения могут быть получены прн взаимодействии солей ртути с магний- нли литийорганнческими соединениями при замещении в органических соединениях водорода ртутью (меркуриро-вание), путем прнсоедннення солей ртутн к ненасыщенным соединениям н, наконец, разложением солей дназония в присутствии солей ртути (реакция Несмеянова).
При растворении металлов в ртутн образуются амальгамы (амальгамированию подвержены только металлы, смачиваемые ртутью). Они не отличаются от обычных сплавов, хотя прн избытке ртути представляют собой полужидкие смеси. Прн этом амальгамы могут быть либо обыкновенными (истинными) растворами ( Sn , Pb ) и смесями ( Zn , Cd ), либо химическими соединениями (элементы I группы). По взаимодействию с ртутью металлы можно условно разделить на пять групп:
— металлы, растворимость которых точно не установлена (Та, Si , Re , W , Sb );
— металлы, практически нерастворимые в ртути [растворимость не выше 2- Ю- 5 % (по массе): Cr , Со, Fe , V, Be ];
— металлы с очень низкой растворимостью (на уровне металлов, указанных выше), но образующие с ней химические соединения ( Ni , Ti , Mo , Мп, U );
— металлы, не реагирующие с ртутью прн обычных температурах
но взаимодействующие с ней при повышенных температурах или после предварительного измельчения ( Al , Си, Hf , Ge );
— металлы, образующие с ртутью твердые растворы, а некоторые из них и химические соединения.
Соединения, получающиеся в результате амальгамирования, легко разлагаются ниже температуры их плавления с выделением избытка ртути.
Диаграммы состояния Au — Hg , Ag — Hg , Pt — Hg и Sn — Hg имеют характерные переходные точки, соответствующие разложению химических соединений, образующихся прн амальгамировании в различных температурных условиях. С этими соединениями ртуть образует ряд металлических соединений Стали, легированные углеродом, кремнием, хромом, никелем, молибденом и ниобием, не амальгамируются.
Ртуть широко применяется прн изготовлении различных приборов (барометры, термометры, манометры, вакуумные насосы, нормальные элементы, полярографы, электрометры и др.); в ртутных лампах, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом; в качестве катализатора прн синтезе уксусной кислоты; в металлургии для амальгамирования золота и сребра; при изготовлении взрывчатых веществ (гремучая ртуть); в медицине (каломель, сулема, ртутьоргаиическне и другие соединения); в качестве пигмента (киноварь); в сельском хозяйстве в качестве протравителя семян и гербицида (органические соединения ртутн); в судостроении для окраски (компонент краски) морских судов, а также в медицинской практике.
Источник
Что нейтрализует ртуть? Раствор для демеркуризации ртути
Несмотря на то что медицинские технологии постоянно развиваются и электронные приборы медицинского назначения успешно используются в домашних условиях, ртутный градусник для измерения температуры тела остается по-прежнему наиболее часто встречающимся домашним подспорьем. Случается, что градусник бьется, и тогда возникает два вопроса: «Как убрать содержимое градусника?» и «Что нейтрализует ртуть?»
Жидкий металл
С детства все знают, что металл — это что-то прочное, твердое, блестящее. Определение химическим элементам, относящимся к группе металлов, дал еще Михайло Ломоносов два с половиной столетия назад. Но, как всегда практически и бывает, каждое правило имеет свои исключения. Вот и металлы не всегда выглядят так, как по определению великого русского ученого должны выглядеть. Вот ртуть. Это металл, занимающий 80-ю ячейку таблицы химических элементов, разработанной великим ученым-химиком Д. И. Менделеевым. Но в привычных для людей условиях ртуть — не твердое вещество, это жидкость. И это единственный жидкий металл из всех, которые известны науке на сегодняшний день.
Об удивительных свойствах этого химического элемента можно говорить довольно много. Но именно благодаря своим качествам ртуть — особый химический элемент. Где применяется ртуть в современной промышленности, проявляя свои характерные особенности? Таких отраслей много — от известного всем медицинского термометра до атомно-водородной энергетики.
Ртуть дома
Международным сообществом ртуть признана одним из самых агрессивных веществ, загрязняющих природу. Но без этого химического элемента невозможно представить многие сферы жизнедеятельности человека. Дома наверняка у многих есть градусники, где индикатором температуры выступает столбик ртути, лампы люминесцентные, колбы которых наполнены парами ртути в смеси с инертным газом аргоном, некоторые аккумуляторы в мобильных телефонах. Сами по себе эти предметы не опасны, а необходимы и полезны. Но при повреждении они могут стать причиной серьезных проблем со здоровьем всех домашних. Единственный вопрос, который следует задать, если дома вдруг появился разбитый градусник: «Что делать?»
Такой привычный градусник
Со стеклянными градусниками с наполненной ртутью тонкой вакуумной колбой — капилляром, и шкалой делений все знакомы с самого детства. Это самый привычный и необходимый медицинский прибор в любой семье. Да, сейчас можно купить электронные градусники самых разных форм — от предназначенного для грудничков в виде соски до бесконтактного. Но все же абсолютное большинство людей считают именно ртутные термометры самыми точными и практичными. Вот только о таящейся в градуснике опасности задумываются немногие.
Зачем, казалось бы, нужно было придумывать ртутный термометр, если вещество, помогающее измерять температуру тела, очень опасно? Но именно ртуть стала той жидкостью, которая удовлетворяет потребностям точного измерения температуры, равномерно расширяясь при ее увеличении, поднимаясь вверх по капилляру термометра. Изобретен ртутный термометр был в 18 веке, как улучшенный вариант спиртового термометра. В нашей стране принята для отсчета температуры шкала Цельсия, в странах Запада и в Америке температуру измеряют по Фаренгейту. Используя ртутный термометр в домашних условиях, мало кто задумывается над ответом на вопрос «что нейтрализует ртуть», если вдруг градусник разобьется.
Живое и ртуть
Человечеству ртуть известна с древних времен. Красивые, алые на разломе камни киновари — природного ртутного минерала, люди добывали, чтобы получить яркую краску, не зря камень в переводе с древнеперсидского называется «кровь дракона». И уже тогда ртуть использовали для амальгамирования — одного из способов очистки золота. Тогда же было известно о ядовитых свойствах соединений ртути, например сулемы, которая и по сегодняшний день используется в качестве дезинфицирующего средства. Ртуть — уникальный металл, она начинает плавиться при температуре приблизительно -39 градусов по шкале Цельсия. Все наслышаны, что она очень ядовита. Чем опасна для человека ртуть из разбившегося градусника, нужно уточнить.
Если ртуть попадает на открытый воздух, она начинает испаряться, как вода, причем активное испарение начинается уже при 18 градусах Цельсия. Пары ртути насыщают воздух помещения, особенно если оно не проветривается. И такой воздух становится опасным и для человека, и для домашних животных, и даже для комнатных растений и рыбок в аквариуме. Особенностью этого химического элемента является то, что он способен аккумулировать, то есть накапливаться, в живом организме, а вывести его практически невозможно. Ртуть копится, пока не наступит критический предел ее концентрации в организме. Причем на первых этапах такого отравления симптомы настолько слабо выражены, что их можно принять за усталость, легкую простуду, но никак не за серьезную проблему со здоровьем, опасную для жизни.
Что происходит?
Ртуть опасна для всего живого, она нарушает обменные процессы, человек чувствует поначалу слабость и апатию, которые с течением времени перерастают в нарушения работы всех органов: почки, печень, сердце, легкие страдают от избытка ртути в организме. Летальный исход может иметь причиной отравление ртутью из градусника. Симптомы и последствия вдыхания ртутных паров или, что еще хуже, попадания ртути в организм человека через рот могут быть очень страшны.
Отравление ртутью, как и любыми другими токсичными и опасными веществами, может быть острым, а может быть хроническим. Острое отравление характеризуется головной болью, рвотой и слюнотечением, болью в горле и в животе, набуханием и кровоточивостью десен, может повышаться температура тела. Острое отравление проявляется примерно через 2 часа после значительной дозы ртути, попавшей в организм.
Хроническое отравление — результат длительного вдыхания паров ртути в малых концентрациях. Оно часто развивается у тех людей, в жилище которых когда-то был разбит ртутный термометр, но уборка и нейтрализация вещества не были проведены так, как это следовало бы сделать.
Если это случилось
Разбитый термометр — это, казалось бы, такая мелочь. Нужно просто собрать осколки, убрать ртутные шарики, ну еще пол помыть. Но все совсем не так. Разбившийся ртутный градусник — это серьезная опасность для всех домашних. Отравление парами ртути начинается, как только это вещество из запаянной стеклянной колбы попадает на открытый воздух. Вопрос о том, что нейтрализует ртуть, отходит на второй план, уступая место вопросу о том, как ее собрать. Начинается подметание, подключается пылесос, влажные тряпки. Но то, чем люди обычно наводят уборку, использовать категорически запрещено, убирая разбившийся градусник.
Ртуть — жидкость, и собрать ее, допустим, как пластилин, в шарик не получится, и сухими тряпками вытереть ее тоже невозможно. От удара, который разбивает капсулу градусника, вещество распадается на мельчайшие частицы, разлетающиеся по комнате. Работа веником только усугубляет ситуацию, так как веточки сорго или синтетические щетинки дробят ртутные шарики на еще более мелкие части. Не поможет и пылесос, так как, с одной стороны, он убирает ртуть, а с другой, вместе с отработанным воздухом в виде мельчайшей пыли отправляет обратно по всей комнате, к тому же убиравший ртуть пылесос придется затем утилизировать, ведь очистить его от мельчайших частиц ртути, забившихся во все детали, не получится.
Мокрыми тряпками ртуть не убрать, а частицы вещества, начавшего свою отравляющую работу, могут попасть в щели пола, в шерстяные волокна ковра. Если в комнате, где разбился градусник, есть на полу ковер или палас, то их проще утилизировать, завернув в плотный полиэтиленовый пакет и убрав из комнаты. А вот с пола ртутные шарики удобнее всего убирать при помощи обычной медицинской груши, собирая ртуть в стеклянную банку.
Уборка разбитого ртутного градусника по шагам
Если есть разбитый градусник, что делать? Ответ на этот вопрос будет состоять из следующих рекомендаций:
- Вывести из комнаты, а лучше и из квартиры, всех домочадцев, включая животных, на прогулку, пока уборка не будет закончена.
- Закрыть дверь комнаты.
- Открыть все окна настежь. Приток холодного воздуха сдержит активное испарение ртути и будет уменьшать ее концентрацию.
- Надеть медицинскую маску, а лучше респиратор, и резиновые перчатки, переодеться в одежду, с которой не жалко будет расстаться после уборки.
- Приготовить медицинскую грушу — спринцовку, стеклянную банку с плотно закручивающейся крышкой, марганцовку или хлорку, холодную воду.
- Включить яркое освещение, так как ртуть — блестящий металл, и ее будет хорошо видно при ярком свете.
- Шарики ртути удобнее всего собирать, засасывая их при помощи спринцовки и опуская в банку; этим медицинским предметом проще выудить ртуть из щелей в полу и под плинтусами. Встречаются рекомендации по уборке ртути металлической проволокой, листами бумаги, но ртуть постоянно скатывается и рассыпается на мелкие капельки при малейшем неосторожном движении, поэтому удобнее спринцовки в домашних условиях нет ничего.
- После того как ртуть собрана, место, где был разбит градусник, нужно обработать концентрированным раствором дезинфицирующих средств — марганцовки или хлорки, разведя их холодной водой.
- Банку с собранной ртутью, спринцовку, осколки разбитого градусника, марлевую повязку, респиратор, одежду нужно отнести в СЭС, где их обязаны принять на утилизацию. Выкидывать на помойку эти предметы ни в коем случае нельзя.
Что нейтрализует ртуть?
Ртуть — опасное для живого вещество. Оно относится к 1 классу опасности в соответствии с нормативным документом — ГОСТом 17.4.1.02-83. Раствор для демеркуризации ртути в промышленных масштабах — это порошок серы. Он вступает с металлом в химическую реакцию, превращая его в нелетучее соединение — сульфид ртути. Это вещество уже достаточно просто убрать, так как оно твердое, в отличие от самого жидкого металла, норовящего разлететься от любого прикосновения на мелкие шарики.
В домашних же условиях редко найдется порошок серы для уборки разбившегося ртутного градусника. Но ртуть и марганцовка, или ртуть и хлорсодержащие моющие средства позволят нейтрализовать вредный жидкий металл. Да, лучше всего сначала убрать ртуть как можно тщательнее, а затем обработать хлоркой или марганцовкой все поверхности в комнате. Пол можно просто залить концентрированным раствором хлорсодержащего моющего средства, например для дезинфекции унитазов. Повторную уборку «начисто» лучше всего провести через сутки.
Что лучше — хлорка или марганцовка?
Это только в фильмах-катастрофах или экшн-сказках появляется герой, который всех спасает и избавляет от неминуемой гибели. В жизни при любых критических ситуациях лучше все делать самому и тщательно, не рассчитывая на помощь извне, потому что только в крупных городах есть службы, профессионально занимающиеся утилизацией домашних бытовых проблемных отходов и уборкой помещений в соответствии с возникшей опасностью. Чтобы самостоятельно избавиться от опасных последствий разбившегося градусника, лучше всего использовать подручные средства не менее эффективные, чем средства специалистов.
Нейтрализовать остатки ртути можно марганцовкой или хлоркой. Растворы должны быть концентрированными, а значит, достаточно едкими. В 1 литр раствора марганцовки следует влить 1 столовую ложку уксусной эссенции и добавить 1 столовую ложку обычной соли. Марганцовка для уборки будет иметь практически черный оттенок, и она обязательно оставит несмываемые следы на поверхности пола. Удобнее и проще использовать хлорсодержащие средства для уборки и дезинфекции дома, ту же «Белизну» например. Этим средством обрабатывают поверхность после ртути в течение 15 минут, затем промывая чистой водой. Такую уборку следует повторять как можно чаще в течение 2-3 недель.
Для полного спокойствия
Итак, ртутный термометр все-таки разбился. Но демеркуризация проведена правильно, тщательно, все опасные вещи утилизированы по правилам в специальную организацию, занимающуюся подобными проблемами. И чтобы успокоить себя и своих домашних, для проверки результата можно использовать специальный анализатор паров ртути. Он представляет собой тестовые полоски, которые при взаимодействии с парами ртути изменяют окраску. Это более дешевый и доступный способ проверить безопасность помещения, чем вызывать специалистов для проведения подобного обследования дома. Инструкция по использованию тест-полосок прилагается к каждому комплекту анализатора, а приобрести его можно в специализированных магазинах.
Источник