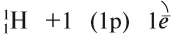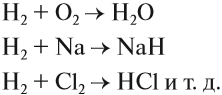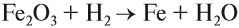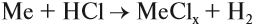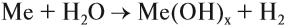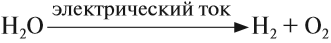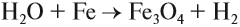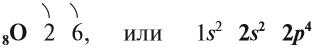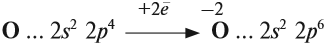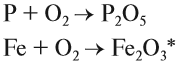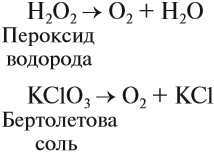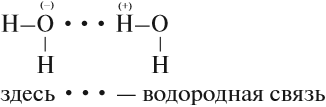Проект Заряд
Автономное энергоснабжение. Свободная и альтернативная энергия будущего. Бестопливные генераторы и «вечные двигатели» в каждый дом!
Генератор водорода путем ослабления межатомных связей высокой температурой
Предложенный способо основан на следующем:
- Электронная связь между атомами водорода и кислорода ослабевает пропорционально повышению температуры воды. Это подтверждается практикой при сжигании сухого каменного угля. Перед тем как сжигать сухой уголь, его поливают водой. Мокрый уголь дает больше тепла, лучше горит. Это происходит от того, что при высокой температуре горения угля вода распадается на водород и кислород. Водород сгорает и дает дополнительные калории углю, а кислород увеличивает объем кислорода воздуха в топке, что способствует лучшему и полному сгоранию угля.
- Температура воспламенения водорода от 580 до 590 o C, разложение воды должно быть ниже порога зажигания водорода.
- Электронная связь между атомами водорода и кислорода при температуре 550 o C еще достаточна для образования молекул воды, но орбиты электронов уже искажены, связь с атомами водорода и кислорода ослаблена. Для того, чтобы электроны сошли со своих орбит и атомная связь между ними распалась, нужно электронам добавить еще энергии, но уже не тепла, а энергию электрического поля высокого напряжения. Тогда потенциальная энергия электрического поля преобразуется в кинетическую энергию электрона. Скорость электронов в электрическом поле постоянного тока возрастает пропорционально квадратному корню напряжения, приложенного к электродам.
- Разложение перегретого пара в электрическом поле может происходить при небольшой скорости пара, а такую скорость пара при температуре 550 o C можно получить только в незамкнутом пространстве.
- Для получения водорода и кислорода в больших количествах нужно использовать закон сохранения материи. Из этого закона следует: в каком количестве была разложена вода на водород и кислород, в таком же количестве получим воду при окислении этих газов.
Возможность осуществления изобретения подтверждается примерами, осуществляемыми в трех вариантах установок.
Все три варианта установок изготавливаются из одинаковых, унифицированных изделий цилиндрической формы из стальных труб.
Первый вариант
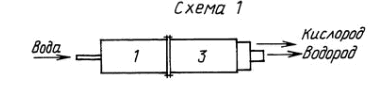
Работа и устройство установки первого варианта (схема 1)
Во всех трех вариантах работа установок начинается с приготовления перегретого пара в незамкнутом пространстве с температурой пара 550 o C. Незамкнутое пространство обеспечивает скорость по контуру разложения пара до 2 м/с.
Приготовление перегретого пара происходит в стальной трубе из жаропрочной стали /стартер/, диаметр и длина которого зависит от мощности установки. Мощность установки определяет количество разлагаемой воды, литров/с.
Один литр воды содержит 124 л водорода и 622 л кислорода, в пересчете на калории составляет 329 ккал.
Перед пуском установки стартер разогревается от 800 до 1000 o C /разогрев производится любым способом/.
Один конец стартера заглушен фланцем, через который поступает дозированная вода для разложения на рассчитанную мощность. Вода в стартере нагревается до 550 o C, свободно выходит из другого конца стартера и поступает в камеру разложения, с которой стартер соединен фланцами.
В камере разложения перегретый пар разлагается на водород и кислород электрическим полем, создаваемым положительным и отрицательным электродами, на которые подается постоянный ток с напряжением 6000 В. Положительным электродом служит сам корпус камеры /труба/, а отрицательным электродом служит труба из тонкостенной стали, смонтированная по центру корпуса, по всей поверхности которой имеются отверстия диаметром по 20 мм.
Труба — электрод представляет собой сетку, которая не должна создавать сопротивление для входа в электрод водорода. Электрод крепится к корпусу трубы на проходных изоляторах и по этому же креплению подается высокое напряжение. Конец трубы отрицательного электрода оканчивается электроизоляционной и термостойкой трубой для выхода водорода через фланец камеры. Выход кислорода из корпуса камеры разложения через стальной патрубок. Положительный электрод /корпус камеры/ должен быть заземлен и заземлен положительный полюс у источника питания постоянного тока.
Выход водорода по отношению к кислороду 1:5.
Второй вариант
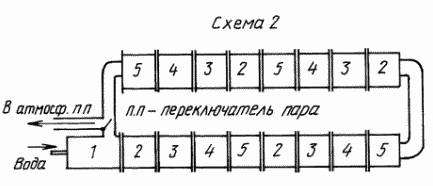
Работа и устройство установки по второму варианту (схема 2)
Установка второго варианта предназначена для получения большого количества водорода и кислорода за счет параллельного разложения большого количества воды и, окисления газов в котлах для получения рабочего пара высокого давления для электростанций, работающих на водороде /в дальнейшем ВЭС/.
Работа установки, как и в первом варианте, начинается с приготовления перегретого пара в стартере. Но этот стартер отличается от стартера в 1-м варианте. Отличие заключается в том, что на конце стартера приварен отвод, в котором смонтирован переключатель пара, имеющий два положения — «пуск» и «работа».
Полученный в стартере пар поступает в теплообменник, который предназначен для корректировки температуры восстановленной воды после окисления в котле /К1/ до 550 o C. Теплообменник /То/ — труба, как и все изделия с таким же диаметром. Между фланцами трубы вмонтированы трубки из жаропрочной стали, по которым проходит перегретый пар. Трубки обтекаются водой из замкнутой системы охлаждения.
Из теплообменника перегретый пар поступает в камеру разложения, точно такую же, как и в первом варианте установки.
Водород и кислород из камеры разложения поступают в горелку котла 1, в которой водород поджигается зажигалкой, — образуется факел. Факел, обтекая котел 1, создает в нем рабочий пар высокого давления. Хвост факела из котла 1 поступает в котел 2 и своим теплом в котле 2 подготавливает пар для котла 1. Начинается непрерывное окисление газов по всему контуру котлов по известной формуле:
В результате окисления газов восстанавливается вода и выделяется тепло. Это тепло в установке собирают котлы 1 и котлы 2, превращая это тепло в рабочий пар высокого давления. А восстановленная вода с высокой температурой поступает в следующий теплообменник, из него в следующую камеру разложения. Такая последовательность перехода воды из одного состояния в другое продолжается столько раз, сколько требуется получить от этого собранного тепла энергии в виде рабочего пара для обеспечения проектной мощности ВЭС.
После того, как первая порция перегретого пара обойдет все изделия, даст контуру расчетную энергию и выйдет из последнего в контуре котла 2, перегретый пар по трубе направляется в переключатель пара, смонтированный на стартере. Переключатель пара из положения «пуск» переводится в положение «работа», после чего он попадает в стартер. Стартер отключается /вода, разогрев/. Из стартера перегретый пар поступает в первый теплообменник, а из него в камеру разложения. Начинается новый виток перегретого пара по контуру. С этого момента контур разложения и плазмы замкнут сам на себя.
Вода установкой расходуется только на образование рабочего пара высокого давления, которая берется из обратки контура отработанного пара после турбины.
Недостаток силовых установок для ВЭС — это их громоздкость. Например, для ВЭС на 250 МВт нужно разлагать одновременно 455 л воды в одну секунду, а для этого потребуется 227 камер разложения, 227 теплообменников, 227 котлов /К1/, 227 котлов /К2/. Но такая громоздкость стократ будет оправдана уже только тем, что топливом для ВЭС будет только вода, не говоря уже о экологической чистоте ВЭС, дешевой электрической энергии и тепле.
Третий вариант
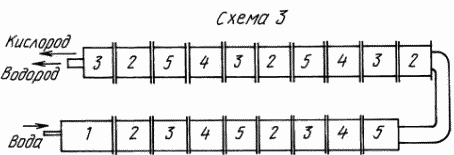
3-й вариант силовой установки (схема 3)
Это точно такая же силовая установка, как и вторая.
Разница между ними в том, что эта установка работает постоянно от стартера, контур разложения пара и сжигания водорода в кислороде не замкнут сам на себя. Конечным изделием в установке будет теплообменник с камерой разложения. Такая компоновка изделий позволит получать кроме электрической энергии и тепла, еще водород и кислород или водород и озон. Силовая установка на 250 МВт при работе от стартера будет расходовать энергию на разогрев стартера, воду 7,2 м 3 /ч и воду на образование рабочего пара 1620 м 3 /ч/вода используется из обратного контура отработанного пара/. В силовой установке для ВЭС температура воды 550 o C. Давление пара 250 ат. Расход энергии на создание электрического поля на одну камеру разложения ориентировочно составит 3600 кВт/ч.
Силовая установка на 250 МВт при размещении изделий на четырех этажах займет площадь 114 х 20 м и высоту 10 м. Не учитывая площадь под турбину, генератор и трансформатор на 250 кВА — 380 х 6000 В.
ИЗОБРЕТЕНИЕ ИМЕЕТ СЛЕДУЮЩИЕ ПРЕИМУЩЕСТВА
- Тепло, полученное при окислении газов, можно использовать непосредственно на месте, причем водород и кислород получаются при утилизации отработанного пара и технической воды.
- Небольшой расход воды при получении электроэнергии и тепла.
- Простота способа.
- Значительная экономия энергии, т.к. она затрачивается только на разогрев стартера до установившегося теплового режима.
- Высокая производительность процесса, т.к. диссоциация молекул воды длится десятые доли секунды.
- Взрыво- и пожаробезопасность способа, т.к. при его осуществлении нет необходимости в емкостях для сбора водорода и кислорода.
- В процессе работы установки вода многократно очищается, преобразуясь в дистиллированную. Это исключает осадки и накипь, что увеличивает срок службы установки.
- Установка изготавливается из обычной стали; за исключением котлов, изготавливаемых из жаропрочных сталей с футеровкой и экранированием их стенок. То есть не требуются специальные дорогие материалы.
Изобретение может найти применение в промышленности путем замены углеводородного и ядерного топлива в силовых установках на дешевое, распространенное и экологически чистое — воду при сохранении мощности этих установок.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Способ получения водорода и кислорода из пара воды, включающий пропускание этого пара через электрическое поле, отличающийся тем, что используют перегретый пар воды с температурой 500 — 550 o C, пропускаемый через электрическое поле постоянного тока высокого напряжения для диссоциации пара и разделения его на атомы водорода и кислорода.
Источник
Урок 12. Водород и кислород
Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
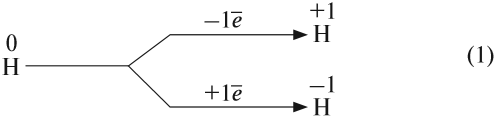
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
Источник