- Отвечаем на вопрос: какая вода замерзает скорее — пресная или соленая, и почему?
- Какая превратится в лед быстрее?
- Сравнительные показатели
- Температура замерзания
- Почему несоленая замерзнет при 0 градусов, а соленая – меньше 0 градусов?
- Факторы и их влияние
- Как происходит кристаллизация в различных растворах?
- Видео по теме статьи
- Заключение
- Опыт «Какая вода быстро замерзнет — соленая или пресная?»
- Почему вода превращается в лед не при 0 градусов
- Почему так происходит
- Какая температура замерзания соленой воды
- Какая превратится в лед быстрее?
- Сравнительные показатели
- Температура замерзания
- Почему несоленая замерзнет при 0 градусов, а соленая – меньше 0 градусов?
- Факторы и их влияние
- Как происходит кристаллизация в различных растворах?
- Видео по теме статьи
- Заключение
- Влияние солености
- Этапы замерзания
- Виды льда
- Температура таяния
- Замерзание солёной воды: Видео
- Теплофизические свойства раствора CaCl2 (кальций хлористый)
- Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
- Теплопроводность раствора CaCl2 в зависимости от температуры
- Теплоемкость раствора CaCl2 при 0°С
- Температура замерзания растворов солей NaCl и CaCl2
- Плотность раствора NaCl в зависимости от температуры
- Теплопроводность раствора NaCl в зависимости от температуры
- Удельная теплоемкость раствора NaCl при 0°С
- Теплофизические свойства раствора NaCl
- Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
- Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
- Солёность морской воды
- Химический состав морской воды
- Замерзание морской воды
- и не забудьте поделиться с друзьями
- Дистиллированная вода замерзает при -42℃
- Соленая вода замерзает при очень низких температурах
- Интересные факты
- Вывод
Отвечаем на вопрос: какая вода замерзает скорее — пресная или соленая, и почему?
Пресная и соленая вода – это различные по составу растворы. Их физические свойства различаются. Незначительно, но это влияет на их хозяйственное использование.
Температура замерзания – это одна из ее качественных характеристик. О том, какая вода замерзает быстрее — пресная или соленая, и почему, расскажем в статье.
Какая превратится в лед быстрее?
При одинаковых внешних факторах скорость кристаллизации пресной воды будет выше, чем соленой. При резком охлаждении молекулы воды начинают сцепляться друг с другом, и формируется осколок льда.
Скорость образования льда из питьевой воды при -43°С составляет одну миллионную секунды (0,000001 с). В нормальных условиях кристаллизация пресной воды начинается при 0°С.

Соленая вода не имеет четко установленной температуры замерзания. Этот показатель зависит от концентрации растворенных веществ.
Рассчитать показатели, при которых начинается образование льда можно по формуле:
Результат всегда будет ниже 0 градусов. Кроме этого, механизм образования льда такого раствора отличается от процессов, проходящих в питьевой воде.
Сравнительные показатели
Наличие примесей существенно влияет на физические свойства вещества:
- Изменяется плотность,
- температурные режимы,
- поведение при переходах из одного агрегатного состояния в другое.
Температура замерзания
Минерализация питьевой воды составляет 0,1%, поэтому температура замерзания 0 градусов Цельсия. Концентрация минеральных добавок в соленой воде варьируется. Температуру замерзания рассчитывают по формуле t3 = -0,0545*S, то есть изменение происходит на -0,54°С на каждые 10 промилле солености.
Например, при минерализации раствора равной 24,7 промилле (морская вода) показатель равен -1,33°С. В Мертвом море насыщенность минеральными добавками достигает 350 промилле. Вода в нем будет кристаллизоваться при -19° Цельсия.
Почему несоленая замерзнет при 0 градусов, а соленая – меньше 0 градусов?
Соленые и пресные воды отличаются по составу. Это 2 различных раствора. Они отличаются по физическим показателям. Поэтому температуры кристаллизации отличаются.
Факторы и их влияние
На начало процесса образования льда в питьевой воде оказывает влияние 2 фактора – процент растворенных минеральных веществ и давление.
Если понизить давление, то процесс кристаллизации замедлится. При изменении показателя на 1 атмосферу температура повышается на 0,01°C.
Факторы, влияющие на температуру образования льда из соленой воды:
- концентрация минеральных веществ;
- внешние условия – погода, наличие ветра, лабораторные условия или естественная среда.
Как происходит кристаллизация в различных растворах?
Процесс кристаллизации жидкости отличается в зависимости от степени ее минерализации:
 Пресная – после образования начального кристалла льда начинается хаотическое изменение ее агрегатного состояния. Могут сформироваться шестиугольный и кубический лед.
Пресная – после образования начального кристалла льда начинается хаотическое изменение ее агрегатного состояния. Могут сформироваться шестиугольный и кубический лед. Они состоят из гексаэдров с атомами кислорода в вершине, но относительное расположение колец отличается. Кубический лед встречается на высоте несколько тысяч метров
Дальнейший процесс зависит от внешних факторов. Соленая вода замерзает, начиная от края емкости, в центре образуется непрозрачный стержень. В нем содержится большая часть минеральных добавок. Эта часть замерзает последней.
Если процесс идет в естественных условиях, то верхняя охлажденная часть будет опускаться вниз. На поверхность поднимаются теплые потоки.
Видео по теме статьи
Какая вода замерзнет быстрее — соленая или пресная, видео-эксперимент:
Заключение
Сравнивать скорость замерзания пресной и соленой воды некорректно. Так как это разные растворы с различными физическими характеристиками.
В одинаковых условиях лед в емкости с первой образуется раньше, чем в пробирке со второй. Ведь их способы и механизмы кристаллизации различны, как и плотность растворов.
Источник
Опыт «Какая вода быстро замерзнет — соленая или пресная?»
Абдулова Джюме Сиражутдиновна
Опыт «Какая вода быстро замерзнет — соленая или пресная?»
Цель исследования: определить различия в замерзании различных жидких веществ и продуктов
Проблема: Почему вода в океане не замерзает?
Материалы: формочки, пресная вода соль.
Описание: Какая вода быстрей растает пресная или соленая? Как это проверит? Почему в океане вода зимой не замерзает?Подумать, спросит у взрослых, почитать в книжке, посмотреть в интернете, сделать опыт.
Я набрала в две формочки пресную воду, а другие две соленую, положила в морозильник.
Через некоторое время проверила, пресная вода начала замерзать, а соленая нет.
Жидкости замерзают с разной скоростью
Но если жидкость охлаждать долго, тогда она переходит в твердое состояние. Поэтому я решила оставить всё на ночь, а утром проверить, замёрзнет солёная вода или нет?
Результат. Вывод: : солёная вода и утром осталась не замёрзшей, а это значит,что солёная вода может совсем не замерзать. В океане вода соленая, поэтому она и не замерзает зимой.
«Волшебница вода, или Чудесное превращение воды». Проект по экологическому развитию в средней группе Видео «Волшебница вода или волшебное превращение воды» проект в средней группе по экологическому развитию Проект «Волшебница — вода» Вид проекта:.
Конспект НОД по познавательно-исследовательской деятельности в подготовительной группе «Соленая история» Конспект занятия по познавательно-исследовательской деятельности в подготовительной группе «Соленая история» Цель: Способствовать развитию.
Конспект занятия «Берегите воду! или Всем нужна вода!» для детей второй младшей группы Цель: Развивающая: — Расширять и углублять знания и представления детей об окружающем мире формировать начало экологической культуры.
Конспект занятия по экспериментированию «Сюрприз от котика или волшебная вода» (ранний возраст) Цель: Формирование у детей познавательного интереса к объектам природы. Задачи: 1. Знакомить детей со свойствами воды: чистая, окрашивается.


Педагогический проект «Какая бывает вода» Педагогический проект на тему: «Какая бывает вода»Возраст детей: средний дошкольный Срок реализации: 2 недели Автор: Орлова Е. В. Презентация.
Проект для разновозрастной группы «Вода, вода-кругом вода» Название проекта Вода, вода, кругом вода Тип проекта Исследовательский, творческий, краткосрочный, групповой Цель Расширение и углубление.
Проект тематического дня «Вода — какая она?» Вид проекта: исследовательско — творческий, краткосрочный. Участники: дети старшего дошкольного возраста. Продукт детской деятельности:.
Сценарий осеннего праздника в старшей группе «Ах, какая осень, ах, какая» Сценарий осеннего праздника в старшей группе «Ах, какая осень, ах, какая…» Дети входят в зал под музыку(«Под музыку Вивальди…» М. Таривердиев,.
Источник
Почему вода превращается в лед не при 0 градусов
Стандартное утверждение о том, что вода замерзает при достижении температуры в 0 градусов Цельсия, на самом деле некий стереотип. Температурных порогов, при которых замерзает вода, существует не так уж мало, и зависят они от разных свойств воды и окружающей обстановки. К примеру, чистая вода может даже замерзнуть при -42°С, в зависимости от условий, в которых она охлаждается.
Почему так происходит
Для формирования кристаллов льда могут использоваться различные частицы и дефекты тары
Чтобы кристаллы льда сформировались, необходима основа, а ею могут стать различные вещества и мелкие тела, например, пылевые частицы. А ожидать, что чистая вода замерзнет, согласно распространенному мнению, при нулевой температуре, не стоит. Ядрами кристаллизации, как известно из курса физики, могут выступать растворенные в воде минеральные и органические частицы, но и не только они.
Кристаллизация может «выбрать» в качестве основы различные дефекты тары, в которой вода в этот момент находится, такие как сколы и трещины, а также воздушные пузырьки. Кстати, так как у горячей воды число ядер кристаллизации больше, то и замерзает она быстрее, чем холодная. Этот интересный факт известен любому старшекласснику. Если сосуд чист, и сама вода тоже, то она может какое-то время при отрицательной температуре находиться в обычном жидком состоянии. Но оно считается неустойчивым, потому что стоит появиться какой-либо посторонней частице, например, пылинке, как вокруг нее немедленно начнет образовываться ледяной кристалл, и вся остальная вода вокруг тоже становится льдом.
Источник
Какая температура замерзания соленой воды
Какая превратится в лед быстрее?
При одинаковых внешних факторах скорость кристаллизации пресной воды будет выше, чем соленой. При резком охлаждении молекулы воды начинают сцепляться друг с другом, и формируется осколок льда.
Скорость образования льда из питьевой воды при -43°С составляет одну миллионную секунды (0,000001 с). В нормальных условиях кристаллизация пресной воды начинается при 0°С.

Соленая вода не имеет четко установленной температуры замерзания. Этот показатель зависит от концентрации растворенных веществ.
Рассчитать показатели, при которых начинается образование льда можно по формуле:
t3 = -0,0545*S, где S – это уровень насыщения воды минеральными веществами.
Результат всегда будет ниже 0 градусов. Кроме этого, механизм образования льда такого раствора отличается от процессов, проходящих в питьевой воде.
Сравнительные показатели
Наличие примесей существенно влияет на физические свойства вещества:
- Изменяется плотность,
- температурные режимы,
- поведение при переходах из одного агрегатного состояния в другое.
Температура замерзания
Минерализация питьевой воды составляет 0,1%, поэтому температура замерзания 0 градусов Цельсия. Концентрация минеральных добавок в соленой воде варьируется. Температуру замерзания рассчитывают по формуле t3 = -0,0545*S, то есть изменение происходит на -0,54°С на каждые 10 промилле солености.
Например, при минерализации раствора равной 24,7 промилле (морская вода) показатель равен -1,33°С. В Мертвом море насыщенность минеральными добавками достигает 350 промилле. Вода в нем будет кристаллизоваться при -19° Цельсия.
Почему несоленая замерзнет при 0 градусов, а соленая – меньше 0 градусов?
Соленые и пресные воды отличаются по составу. Это 2 различных раствора. Они отличаются по физическим показателям. Поэтому температуры кристаллизации отличаются.
Факторы и их влияние
На начало процесса образования льда в питьевой воде оказывает влияние 2 фактора – процент растворенных минеральных веществ и давление.
Если количество примесей стремится к нулю, и по физическим показателям питьевая вода приближается к химически чистому веществу, то она может оставаться в жидкой форме при температуре ниже 0 градусов.
Если понизить давление, то процесс кристаллизации замедлится. При изменении показателя на 1 атмосферу температура повышается на 0,01°C.
Факторы, влияющие на температуру образования льда из соленой воды:
- концентрация минеральных веществ;
- внешние условия – погода, наличие ветра, лабораторные условия или естественная среда.
Как происходит кристаллизация в различных растворах?
Процесс кристаллизации жидкости отличается в зависимости от степени ее минерализации:
 Пресная – после образования начального кристалла льда начинается хаотическое изменение ее агрегатного состояния. Могут сформироваться шестиугольный и кубический лед.
Пресная – после образования начального кристалла льда начинается хаотическое изменение ее агрегатного состояния. Могут сформироваться шестиугольный и кубический лед. Они состоят из гексаэдров с атомами кислорода в вершине, но относительное расположение колец отличается. Кубический лед встречается на высоте несколько тысяч метров
Дальнейший процесс зависит от внешних факторов. Соленая вода замерзает, начиная от края емкости, в центре образуется непрозрачный стержень. В нем содержится большая часть минеральных добавок. Эта часть замерзает последней.
Если процесс идет в естественных условиях, то верхняя охлажденная часть будет опускаться вниз. На поверхность поднимаются теплые потоки.
Перемешивание продолжается до тех пор, пока не достигнет точки переохлаждения. После этого соленая вода замерзает иглами на всю глубину.
Видео по теме статьи
Какая вода замерзнет быстрее — соленая или пресная, видео-эксперимент:
Заключение
Сравнивать скорость замерзания пресной и соленой воды некорректно. Так как это разные растворы с различными физическими характеристиками.
В одинаковых условиях лед в емкости с первой образуется раньше, чем в пробирке со второй. Ведь их способы и механизмы кристаллизации различны, как и плотность растворов.
А какова Ваша оценка данной статье?
Вода в морях и океанах очень сильно отличается от речной и озерной. Она соленая – и это определяет многие ее свойства. От этого фактора зависит и температура замерзания морской воды. Она не равняется 0 °C, как в случае с пресной водой. Чтобы покрыться льдом, морю требуется мороз покрепче.
Влияние солености
Сказать однозначно, при какой температуре замерзает морская вода, невозможно, так как этот показатель зависит от степени ее солености. В разных местах мирового океана она разная.
Самое соленое – Красное море. Здесь концентрация соли в воде достигает 41‰ (промилле). Меньше всего соли в водах Балтийского залива – 5‰. В Черном море этот показатель равен 18‰, а в Средиземном – 26‰. Соленость Азовского моря – 12‰. А если брать в среднем, соленость морей составляет 34,7‰.
Чем выше соленость, тем больше должна охладиться морская вода для перехода в твердое состояние.
Это хорошо видно из таблицы:
| Соленость, ‰ | Температура замерзания, °C | Соленость, ‰ | Температура замерзания, °C |
|---|---|---|---|
| 0 (пресная вода) | 20 | -1,1 | |
| 2 | -0,1 | 22 | -1,2 |
| 4 | -0,2 | 24 | -1,3 |
| 6 | -0,3 | 26 | -1,4 |
| 8 | -0,4 | 28 | -1,5 |
| 10 | -0,5 | 30 | -1,6 |
| 12 | -0,6 | 32 | -1,7 |
| 14 | -0,8 | 35 | -1,9 |
| 16 | -0,9 | 37 | -2,0 |
| 18 | -1,0 | 39 | -2,1 |
Там, где соленость еще выше, как, например, в озере Сиваш (100 ‰), заливе Кара-Богаз-Гол (250 ‰), в Мертвом море (свыше 270 ‰), вода может замерзнуть только при очень большом минусе – в первом случае – при -6,1 °C, во втором – ниже -10 °C.
За средний же показатель для всех морей можно принять -1,9 °C.
Этапы замерзания
Очень интересно наблюдать, как замерзает морская вода. Она не покрывается сразу равномерной ледяной коркой, как пресная. Когда часть ее превращается в лед (а он пресный), остальной объем становится еще более соленым, и для его замерзания требуется еще более крепкий мороз.
Виды льда
По мере охлаждения в море образуется лед разных видов:
Если море еще не замерзло, но очень близко к этому, и в это время выпадает снег, он при соприкосновении с поверхностью не тает, а пропитывается водой и образует вязкую кашеобразную массу, которая называется снежурой. Смерзаясь, эта каша превращается в шугу, которая очень опасна для кораблей, попавших в шторм. Из-за нее палуба мгновенно покрывается ледяной коркой.
Когда столбик термометра достигает нужной для замерзания отметки, в море начинают образовываться ледяные иглы – кристаллы в форме очень тонких шестигранных призм. Собрав их сачком, смыв с них соль и растопив, вы обнаружите, что они пресные.
Сначала иглы растут горизонтально, потом они принимают вертикальное положение, и на поверхности видны только их основания. Они напоминают пятна жира в остывшем супе. Поэтому лед на этой стадии называют салом.
Когда еще больше холодает, сало начинает смерзаться и образует ледяную корку, такую же прозрачную и хрупкую, как стекло. Такой лед называют нилас, или склянка. Он соленый, хотя и образован из пресных игл. Дело в том, что во время смерзания иглы захватывают мельчайшие капли окружающей соленой воды.
Только в морях наблюдается такое явление, как плавучие льды. Возникает оно потому, что вода здесь быстрее остывает у берегов. Образующийся там лед примерзает к береговой кромке, почему и получил название припай. По мере усиления морозов во время тихой погоды он быстро захватывает новые территории, достигая порой десятков километров в ширину. Но стоит подняться сильному ветру – и припай начинает разламываться на куски различной величины. Эти льдины, часто огромных размеров (ледяные поля), разносятся ветром и течением по всему морю, создавая проблемы судам.
Температура таяния
Тает морской лед не при той же температуре, при которой замерзает морская вода, как можно было бы подумать. Он менее соленый (в среднем в 4 раза), поэтому его превращение обратно в жидкость начинается раньше достижения этой отметки. Если средний показатель замерзания морской воды – -1,9 °C, то среднее значение температуры таяния образовавшегося из нее льда – -2,3 °C.
Замерзание солёной воды: Видео
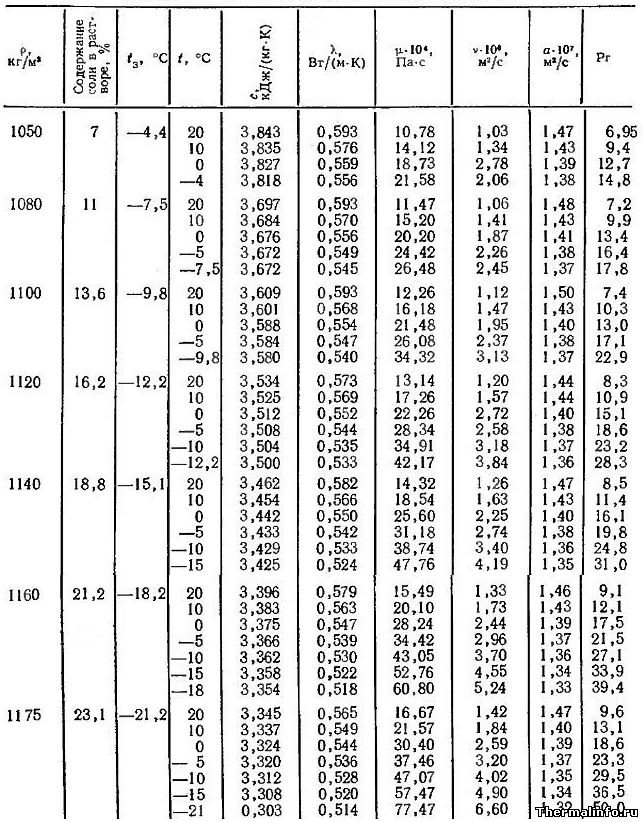
Теплофизические свойства раствора CaCl2 (кальций хлористый)
В таблице представлены теплофизические свойства раствора хлористого кальция CaCl2 в зависимости от температуры и концентрации соли: удельная теплоемкость раствора, теплопроводность, вязкость водных растворов, их температуропроводность и число Прандтля. Концентрация соли CaCl2 в растворе от 9,4 до 29,9 %. Температура, при которой приведены свойства определяется содержанием соли в растворе и находится в диапазоне от -55 до 20°С.
Водный раствор хлорида кальция CaCl2 может не замерзать до температуры минус 55°С. Для достижения этого эффекта концентрация соли в растворе должна быть 29,9%, а его плотность составит величину 1286 кг/м3.
При увеличении концентрации соли в растворе увеличивается не только его плотность, но и такие теплофизические свойства, как динамическая и кинематическая вязкость водных растворов, а также число Прандтля. Например, динамическая вязкость раствора CaCl2 с концентрацией соли 9,4 % при температуре 20°С равна 0,001236 Па·с, а при увеличении концентрации хлорида кальция в растворе до 30% его динамическая вязкость увеличивается до значения 0,003511 Па·с.
Следует отметить, что на вязкость водных растворов этой соли наиболее сильное влияние оказывает температура. При охлаждении раствора хлорида кальция с 20 до -55°С его динамическая вязкость может увеличиться в 18 раз, а кинематическая — в 25 раз.
Даны следующие теплофизические свойства раствора CaCl2:
- плотность раствора, кг/м3;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость водных растворов, Па·с;
- кинематическая вязкость раствора, м2/с;
- коэффициент температуропроводности, м2/с;
- число Прандтля.
Плотность раствора хлористого кальция CaCl2 в зависимости от температуры
В таблице указаны значения плотности раствора хлористого кальция CaCl2 различной концентрации в зависимости от температуры.
Концентрация хлорида кальция CaCl2 в растворе от 15 до 30 % при температуре от -30 до 15°С. Плотность водного раствора хлористого кальция увеличивается при снижении температуры раствора и увеличением в нем концентрации соли.
Теплопроводность раствора CaCl2 в зависимости от температуры
В таблице представлены значения теплопроводности раствора хлористого кальция CaCl2 различной концентрации при отрицательных температурах.
Концентрация соли CaCl2 в растворе от 0,1 до 37,3 % при температуре от -20 до 0°С. По мере роста концентрации соли в растворе его теплопроводность снижается.
Теплоемкость раствора CaCl2 при 0°С
В таблице представлены значения массовой теплоемкости раствора хлористого кальция CaCl2 различной концентрации при 0°С. Концентрация соли CaCl2 в растворе от 0,1 до 37,3 %. Следует отметить, что с повышением концентрации соли в растворе, его теплоемкость снижается.
Температура замерзания растворов солей NaCl и CaCl2
В таблице приведена температура замерзания растворов солей хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации соли. Концентрация соли в растворе от 0,1 до 37,3 %. Температура замерзания солевого раствора определяется концентрацией соли в растворе и для хлорида натрия NaCl может достигать значения минус 21,2°С для эвтектического раствора.
Необходимо отметить, что раствор хлористого натрия может не замерзать до температуры минус 21,2°С, а раствор хлористого кальция не замерзает при температуре до минус 55°С.
Плотность раствора NaCl в зависимости от температуры
В таблице представлены значения плотности раствора хлористого натрия NaCl различной концентрации в зависимости от температуры.
Концентрация соли NaCl в растворе от 10 до 25 %. Значения плотности раствора указаны при температуре от -15 до 15°С.
Теплопроводность раствора NaCl в зависимости от температуры
В таблице даны значения теплопроводности раствора хлористого натрия NaCl различной концентрации при отрицательных температурах.
Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре от -15 до 0°С. По данным таблицы видно, что теплопроводность водного раствора хлорида натрия снижается по мере роста концентрации соли в растворе.
Удельная теплоемкость раствора NaCl при 0°С
В таблице представлены значения массовой удельной теплоемкости водного раствора хлористого натрия NaCl различной концентрации при 0°С. Концентрация соли NaCl в растворе от 0,1 до 26,3 %. По данным таблицы видно, что с повышением концентрации соли в растворе, его теплоемкость снижается.
Теплофизические свойства раствора NaCl
В таблице представлены теплофизические свойства раствора хлористого натрия NaCl в зависимости от температуры и концентрации соли. Концентрация хлорида натрия NaCl в растворе от 7 до 23,1 %. Необходимо отметить, что при охлаждении водного раствора хлорида натрия его удельная теплоемкость меняется слабо, теплопроводность снижается, а значение вязкости раствора увеличивается.
Даны следующие теплофизические свойства раствора NaCl:
- плотность раствора, кг/м3;
- температура замерзания °С;
- удельная (массовая) теплоемкость, кДж/(кг·град);
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость раствора, Па·с;
- кинематическая вязкость раствора, м2/с;
- коэффициент температуропроводности, м2/с;
- число Прандтля.
Плотность растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации при 15°С
В таблице представлены значения плотности растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации. Концентрация соли NaCl в растворе от 0,1 до 26,3 % при температуре раствора 15°С. Концентрация хлорида кальция CaCl2 в растворе находится в диапазоне от 0,1 до 37,3 % при его температуре 15°С. Плотность растворов хлорида натрия и кальция растет при увеличении содержания в нем соли.
Коэффициент объемного расширения растворов хлористого натрия NaCl и кальция CaCl2
В таблице даны значения среднего коэффициента объемного расширения водных растворов хлористого натрия NaCl и кальция CaCl2 в зависимости от концентрации и температуры.
Коэффициент объемного расширения раствора соли NaCl указан при температуре от -20 до 20°С.
Коэффициент объемного расширения раствора хлорида CaCl2 представлен при температуре от -30 до 20°С.
- Чубик И. А., Маслов А. М. Справочник по теплофизическим характеристикам пищевых продуктов и полуфабрикатов.
- Данилова Г. Н. и др. Сборник задач по процессам теплообмена в пищевой и холодильной промышленности. М.: Пищевая промышленность, 1976.- 240 с.
Океаны и моря занимают две трети поверхности планеты, а морская вода составляет 96% всех водных ресурсов Земли.
По своим свойствам она очень сильно отличается от привычной для нас пресной воды: к примеру, из-за повышенной солёности у неё другая температура замерзания. Поэтому море начинает покрываться льдом не при нулевой температуре, а лишь после того, как столбик термометра опустится немного ниже нуля.
Солёность морской воды
Средний показатель солёности Мирового океана составляет 3,47%, т.е. каждый литр морской воды содержит 34,7 граммов соли. Однако солёность воды не везде одинакова: в Красном море она достигает 4,1%, а в Балтийском море – всего 0,7%, причём в отдельных районах опускается даже до 0,2%. Этот показатель зависит от гидрологического режима морей и океанов: чем выше приток в море пресной речной воды, тем менее солёным оно будет. Красное море практически не пополняется пресной водой, поэтому содержание соли в его воде столь высоко.
Воды океанов тоже отличаются по солёности: меньше всего соли обнаружено в воде Северного Ледовитого океана, поскольку она пополняется не только речными стоками, но и таянием ледников. При этом колебания солёности носят сезонный характер: зимой концентрация соли возрастает, а летом снижается. Наиболее солёным океаном является Атлантический, причём самая высокая концентрация соли в его воде располагается в полосе, протянувшейся от Средиземного до Карибского моря.
Химический состав морской воды
Учёные считают, что в глубокой древности вода морей и океанов была не настолько солёной, как сейчас, и что уровень солей в ней понемногу растёт. Вода, выпадающая в виде осадков на сушу, просачивается через почву и горные породы, по пути растворяя и вбирая в себя соли, содержащиеся в минералах. Затем реки приносят эту воду назад в океан, где она испаряется – а соли остаются в море. Накопление солей происходит очень медленно, поэтому изменения невозможно отследить современными наблюдениями.
По своему химическому составу морская вода чрезвычайно богата: в ней можно обнаружить едва ли не все элементы таблицы Менделеева. Основу солевого раствора составляет хлористый натрий, или обычная поваренная соль – примерно 77,8% от всех растворённых в морской воде соединений. Около 11% веществ приходится на долю хлористого магния, который придаёт воде характерный горьковатый привкус. Примерно по 3-3,5% приходится на сульфаты магния, кальция и калия, по десятым долям процента – на карбонаты магния. Остальные соединения составляют ничтожно малые доли процентов.
Замерзание морской воды
Из-за большого количества растворённых солей морская вода замерзает при более низкой температуре, чем пресная. Чем выше солёность, тем ниже должна опуститься температура, чтобы начался процесс образования льда. В среднем, этот показатель составляет -1,9°С.
Процесс замерзания морской воды чрезвычайно интересен.
- В воде образуются отдельные кристаллики льда, превращая воду в кашеобразную массу – снежуру.
- Мелкие кристаллики снежуры становятся более крупными, переходя в фазу шуги. Если из-за шторма шуга попадает на палубу корабля, то мгновенно примерзает к ней, покрывая судно ледяной коркой.
- При дальнейшем падении температуры в морской воде образуются тонкие ледяные иглы, окружённые солью.
- Постепенно иглы располагаются в воде строго вертикально. На поверхности воды их основания напоминают пятна жира, плавающие в бульоне, из-за чего эта стадия замерзания получила название сала.
- Иглы, из которых состоит сало, начинают смерзаться, образуя хрупкую и прозрачную корку, которую называют ниласом или склянкой. На вкус этот лёд оказывается солёным, так как между пресными ледяными иглами остаются капельки солёной воды.
Морская вода быстрее остывает у берега, чем в открытом море, образуя ледяную корку – так называемый припай.
Во время штормов припай разламывается волнами, а затем ветер и течения могут уносить их довольно далеко от берега. Иногда среди обломков встречаются огромные льдины, или ледяные поля, встреча с которыми создаёт проблемы для морских судов.
и не забудьте поделиться с друзьями
Многие уверены в том, что вода начинает леденеть при температуре ниже нуля градусов. Однако это происходит не всегда. Есть условия, при которых она сохраняет свое изначальное жидкое состояние даже при больших отрицательных температурах. Не верите? Вот вам голые факты.
Перед прочтением, хотим вставить короткую ремарку. Мы продаем и устанавливаем фильтры для воды более 10 лет, и твердо уверены в их эффективности, пользе для здоровья и экономической выгоде. Абсолютно все наши клиенты довольны результатом. Так что если у Вас еще нет фильтра для получения питьевой воды – задумайтесь, а мы предоставим лучшие условия.
Дистиллированная вода замерзает при -42℃

Современным ученым удалось настолько очистить воду, что она начинала мерзнуть только при температуре -70 градусов Цельсия. Благодаря этому невероятному свойству ее назвали переохлажденной.
Кстати, если добавить в дистиллированную жидкость немного снега, песочка или льда, то она мгновенно замерзнет под действием низкой температуры (образуя красивые длинные кристаллы).
Соленая вода замерзает при очень низких температурах
Если очищенная вода мерзнет при очень низких температурах, то когда же леденеет соленая вода? Это происходит при температуре -1,9 градусов Цельсия. Значить все моря нашей планеты замерзают при одинаковой отрицательной температуре? Нет, это не так. Существует различные факторы, которые делают показатель замерзания воды непостоянным. Речь идет о концентрации солей и о территориальном расположении:
- Каспий леденеет уже при -0,5 градусах Цельсия;
- Азовское море мерзнет при температуре -0,7 градусов;
- Японское море вообще не леденеет, это связано с тем, что в нем содержится чрезвычайно много соли (34 промилле);
- Балтийской море мерзнет уже при 0 отметке (это же происходит и с пресными водоемами, реками).
Учитывая данное непостоянство, ученые решили определить средний показатель замерзания воды всех морей мира – он составил -4 градуса Цельсия.
Интересные факты

- при низких температурах холодная вода мерзнет дольше горячей;
- пить можно только 3% воды от всего мирового запаса (остальная часть находится в ледниках);
- при добавлении в воду метана, она будет гореть;
- вода остается жидкой при низких температурах, если на нее воздействует электрическое поле.
Лед, который образуется на водоемах, в реках и в морях, не позволят замерзнуть воде, которая находится под ним. При этом он сам не тонет, потому что в его структуре содержаться мельчайшие воздушные пузырьки.
Вывод
Температура промерзания воды зависит от концентрации примесей и солей в ее химическом составе. Если она совершенно чистая (или же чересчур соленая), то процесс замерзания может начаться при очень низких температурах.
Популярные вопросы про Температуру замерзания воды:
✔️ Самая низкая температура замерзания воды?
Дистиллированная вода замерзает при -70℃.
✔️ При какой температуре замерзают моря?
Средний показатель замерзания воды всех морей мира -4 градуса Цельсия.
✔️ При какой температуре замерзает вода в трубах?
Если на протяжении нескольких дней температура воздуха держится стабильно ниже – 5 градусов Цельсия.
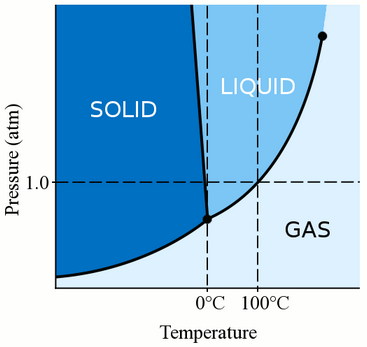
✔️ Как зависит температура замерзания воды от давления?
Согласно диаграмме состояния, доступной по ссылке.
Источник