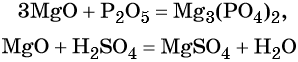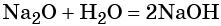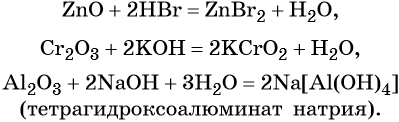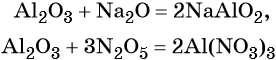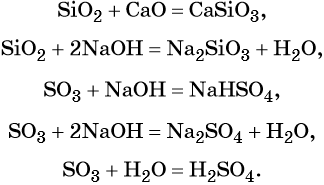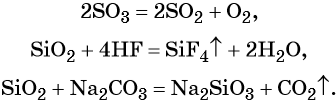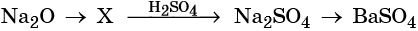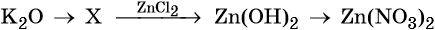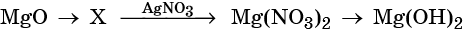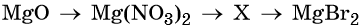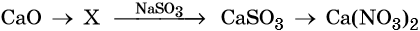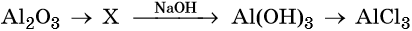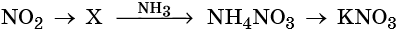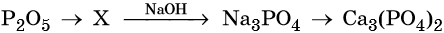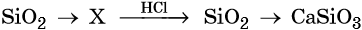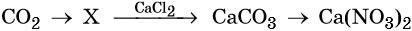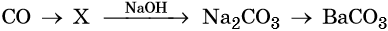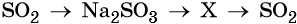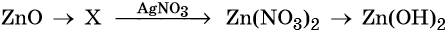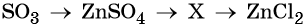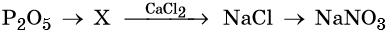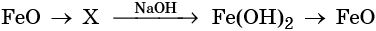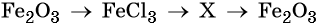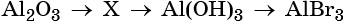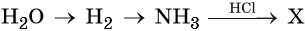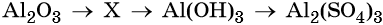Классификация неорганических веществ
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Амфотерные (греч. ἀμφότεροι — двойственный)
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)
Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь 🙂
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Блиц-опрос по теме Классификация неорганических веществ
Источник
Химические свойства оксидов: основных, амфотерных, кислотных
Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯ H2O →
В) ZnO + Na2O ⎯⎯ сплавление →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
28. Установите соответствие между реагирующими веществами и продуктами реакций.
29. Установите соответствие между реагирующими веществами и продуктами реакций.
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Источник