- Соли жесткости
- Что такое жесткость воды и как ее определить
- Жесткость в питьевой воде
- Какие соли обуславливают жесткость природной воды, откуда они берутся
- От чего зависит присутствие соли жесткости в воде
- Классификация воды с солями жесткости
- Нормы жесткости для воды
- Предельно допустимое содержание солей жесткости в воде
- Нормы жесткости для питьевой воды
- Шкала жесткости
- Нормы жесткости для технической воды
- Как определить жесткость воды
- Измерение жесткости воды
- Как определить жесткость воды по формуле
- Как понизить жесткость в питьевой воде
Соли жесткости
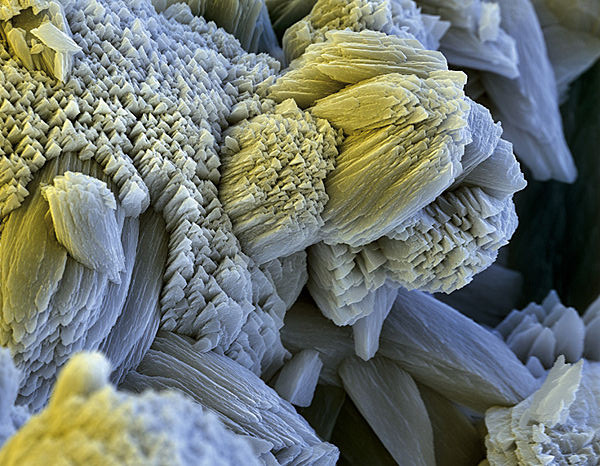
Постоянная (некарбонатная жесткость) – сульфаты, хлориды и нитраты магния и кальция растворенные в воде. Они выпадают в осадок исключительно при полном испарении воды, поэтому образуют постоянную жесткость.
Карбонатная жесткость – это соли магния и кальция, растворенные в воде. Такую жесткость называют также временной, так как в процессе нагревания вода выпадает в осадок в виде накипи.
Как образуются соли жесткости в воде?
Источниками солей жесткости является сама природы. Проходя через известковые породы, грунтовые воды вымывают и растворяют минеральные вещества, соли магния и кальция в том числе. Таким образом, уже в момент забора вода имеет повышенную жесткость. Зачастую показатель жесткости полученной из скважин воды превышает уровень жесткости воды городских водопроводных систем.
Чем опасны соли жесткости в воде?
Соли жесткости отвечают за образование накипи в чайнике, известковых отложений на сантехнике, нагревательных элементах стиральных машин. Отлагаясь в системах горячего водоснабжения и отопления соли жесткости раньше положенного срока выводят из строя бойлеры, приводят к перерасходу энергоносителей. Слой накипи толщиной 1.5 мм способен уменьшить теплопередачу до 15%,3 ммна 25%, 10 мм – до 50% потерь тепла. Более того, накипь – химически активное вещество, разъедающее прокладки и уплотнения. При этом отслоившиеся частицы начинают «путешествовать» по системе водоснабжения, попадают в приборы автоматики, в краны, зачастую выводят их из строя. В большей степени от зарастания этими частицами страдают устройства с маленькими отверстиями – гидромассажные насадки в джакузи, разбрызгивающие головки посудомоечных и стиральных машин, душевые сетки.

Учитывая тот факт, что кожа дышит через поры,и через них же выводятсяи шлаки, содержащийся в жесткой воде кальций в избытке, соединяясь с этими выделениями, закупоривает поры. Чем большим будет уровень жесткости, тем более опасной будет закупорка. Под кожей могут образоваться кристаллы кальция — именно та накипь, которую мы наблюдаем в чайниках.
При постоянном употреблении внутрь воды с повышенной жесткостью снижается моторика желудка, происходит накопление солей, и как следствие, развиваются заболевания суставов – артриты, полиартриты.
Следует отметить, что очень мягкая вода также опасна, как и излишне жесткая. Наиболее активна мягкая вода. Она способна вымывать кальций из костей, провоцировать развитие рахита. Если употреблять такую воду с детства, то во взрослом возрасте станут ломкими кости. Проходя через пищеварительный тракт, вода вымывает не только минеральные, но и полезные органические вещества, полезные бактерии в том числе. Поэтому жесткость воды должна быть не меньше 1.5-2 мг-экв/л.
Предельно допустимые концентрации солей жесткости в воде

- Очень мягкая вода – до 1.5 мг-экв/л
- Мягкая вода – 1.5-4 мг-экв/л
- Вода средней жесткости – 4-8 мг-экв/л
- Жесткая вода – 8-12 мг-экв/л
- Очень жесткая вода -более 12 мг-экв/л.
Согласно нормам СанПиН 2.1.4.1074-01 жесткость воды для хозяйственно-питьевых целей не должна превышать 7-10 мг-экв/л (или 350 мг/л).
Методы очистки воды от солей жесткости
На сегодняшний день большинство бытовых систем очистки воды от солей жесткости основаны на принципе ионного обмена. Фильтром ионного обмена,через который проходит поток воды, служат гранулированные компоненты умягчения воды. В процессе протекания воды через слой гранул ионообменной смолы, которые умягчают воду, осуществляется удаление солей жесткости. Таким образом, вода приобретает мягкость и становится пригодной для использования в бытовых целях.
Многие мировые производители устройств по очистке воды отдают предпочтение методу ионного обмена. Ионообменные смолы – это маленькие полимерные шарики, насыщенные ионами, так называемыми, ионитами. Иониты извлекают из воды разные ионы и отдают взамен свои. Особенностью ионообменных смол является влажность, химически связанная в смоле, объемная и весовая (определяется стандартными методами), а также рабочая ионообменная (зависит от свойств растворов, слоя смолы) емкости.
Вода, насыщенная ионами магния и кальция, проходит через ионообменную смолу, отдает ей собственные ионы и забирает ионы натрия, не образующие отложений.
Электрохимический метод очистки воды
В основе данного метода лежат сложные окислительно-восстановительные реакции, а также, электрохимическая активация воды в электрическом поле, происходящая в процессе воздействия на нее сильного электрического тока.В результате таких процессов образуется «живая» и «мертвая» вода. Электрохимическая активация провоцирует переход воды в метастабильное состояние, для которого характерны аномальные значения активности электронов и прочих физико-химических параметров.
При протекании постоянного электрического тока через воду, поступление в воду у катодаи удаление электронов из воды у анода происходит наряду с электрохимическимиреакциями на поверхности катода и анода. Это провоцирует образование новых веществ, трансформацию системы межмолекулярных воздействий, состава и структуры воды как раствора.
Получить такую воду удается при помощи диафрагменного проточного электрохимического состава, в составе которого специальная мембрана, так называемая диафрагма, разделяющая воду катода и воду анода. Особенность состава электродов (катода и анода) в том, что они способны обмениваться исключительно электронами.
Возможность добиться высокой производительности при малых затратах делает данный метод довольно экономичным. Если в России электрохимическая очистка воды широко распространена, то на Западе применима только в промышленных целях.Дело в том, что данный метод, несмотря на способность очищать воду от примесей, опасен протеканием деструктивных процессов в воде. Более того, если нет точных данных о составе исходной воды, неизвестно как прореагируют между собой находящиеся в ней вещества под воздействием сильного электрического тока. В результате таких реакций возможно образование опасных для организма соединений, радикалов и прочих.
Метод магнитной обработки воды
Магнитные приборы действуют по следующему принципу: происходит магнитное взаимодействие находящихся в воде ионов металлов (магнитный резонанс) и параллельно протекает процесс химической кристаллизации. Под воздействием постоянных магнитов с сильным магнитным полем, растворенные в воде ферромагнитные частицы становятся центрами электрохимической кристаллизации, связывая ионы магния и кальция – основныекомпоненты жесткости воды. Магнитная обработка воды – это абсолютно экологически чистый метод, так как не предполагает применение химических реактивов. Метод наиболее эффективен в борьбе с солями жесткости и образованием накипи. Суть метода состоит в следующем: при продвижении воды через магнитные силовые линии катионы солей жесткости выделяются в массе воды, а не на поверхности нагрева. Такая система актуальна при обработке вод кальциево-карбонатного класса, что составляет порядка 80% всех водоемов России.

Большую популярность среди устройств очистки воды от солей в настоящее время приобрели фильтры, функционирующие по принципу обратного осмоса. Такие фильтры оснащены специальной мембраной, через которую осуществляется движение воды из более концентрированного раствора в сторону менее концентрированного.
В том случае, если с обеих сторон полупроницаемой мембраны будут находиться солесодержащие растворы с различной концентрацией, через мембрану молекулы воды будут перемещаться из слабо концентрированного в более концентрированный раствор, повышая в последнем уровень жидкости. Вследствие осмоса, проникновение воды через мембрану происходит даже при условии одинакового внешнего давления для обоих растворов. Разница в высоте уровней двух растворов различной концентрации определяет силу, под действием которой вода поступает через мембрану. Такая сила представляет собой «осмотическое давление».
Если на раствор с большей концентрацией оказывается внешнее давление, которое превышает осмотическое, молекулы будут двигаться через мембрану в обратном направлении -из более концентрированного в менее концентрированный раствор.
Данный процесс называется обратным осмосом. Такой принцип работы характерен для всех мембран обратного осмоса. При обратном осмосе вода и вещества, растворенные в ней, разделяются на молекулярном уровне. Таким образом, с одной стороны мембраны образуется абсолютно чистая вода, а с другой стороны остаются все загрязнения. Тем самым, обратный осмос обеспечивает более высокий уровень очистки, чем другие традиционные методы фильтрации.
Источник
Что такое жесткость воды и как ее определить
Жесткость воды — это содержание солей, которое зависит от состава, физико-химических свойств, численного количества примесей. Превышение этого показателя одинаково вредно для питьевых, бытовых и технических жидкостей. При доставке горячих, холодных, производственных водных растворов потребителям поставщики обязаны соблюдать нормированные параметры, установленные законодательством. Частные лица, берущие водичку из личных колодцев, должны самостоятельно заботиться о её качестве. Читайте далее, что такое жесткость воды, как ее определить, чем она измеряется, как привести жидкость в нормальное состояние для безопасного использования.
Жесткость в питьевой воде
Под термином жесткость воды понимается количество растворенных и нерастворенных солей, присутствующих в природных водных залежах. Водица может быть слишком мягкой или слишком жесткой. Вредны оба варианта. Недостаток солей нарушает водно-щелочной баланс в организме, избыток вызывает множественные заболевания важных органов: сердца, почек, кожи, печени. При переизбытке солей жидкость имеет горьковато-металлический вкус, может быть мутной, с разными цветовыми оттенками.
Соблюдение нормы жесткости питьевой воды очень важно для потребителей. Солями можно отравиться, они вызывают расстройство желудка, пожелтение кожи, иные неприятности. Высокая концентрация солей жесткости отрицательно сказывается на работе бытовых приборов — примеси образуют трудно-очищающуюся накипь, каменистые известковые отложения. Из-за них образуются шлаки в системе водоснабжения, быстро выходят из строя бытовые/промышленные приборы, сантехника, гидрооборудование.
Какие соли обуславливают жесткость природной воды, откуда они берутся
Основные соли жесткости, присутствующие в воде — это разные соединения:
- нитраты, хлориды, карбонаты магния;
- бикарбонаты, сульфаты, сульфиды кальция.
После естественного испарения или после принудительного выпаривания водного раствора соли становятся видимыми, остаются в сосуде. Именно они образуют отложения на дне и стенках посуды, чайников, санприборов. По жесткости воды легко определить, какая соль в ней явственнее присутствует. Примеси магния труднее растворяются, придают напиткам вкус горечи.
От чего зависит присутствие соли жесткости в воде
Степень жёсткости для питьевой воды определяется типом и количеством водных солей. В разной местности показатели различные. Соли проникают в водоносные пласты, вымываясь из залежей горных пород: известняков, гипсов, доломитов.
Показатели жёсткости воды являются величинами переменными, они зависят от разных факторов:
- процессов, происходящих в земной коре;
- пластов залежей ископаемых, через которые проходят водные потоки;
- интенсивности растворения песчано-каменистых пород;
- смены сезонов.
У вод, лежащих близко к поверхности и залегающих на глубине, параметры разные. Они выше там, где водный поток проходит через слои известняков. Весной, при обилии талых потоков, при их попадании в водоемы и при просачивании в подземные водные пласты, количество солей снижается. Зимой концентрация выше.
Классификация воды с солями жесткости
Какие соли жесткости присутствуют в воде? Различают общую, постоянную и временную жёсткость:
- Карбонатная (временная) Жк — щелочной раствор с рН>8.3 содержит бикарбонаты, которые при нагревании выпадают в осадок, образуя накипь.
- Некарбонатная (постоянная) Жнк — характеризуется присутствием анионов (хлоридов, нитратов, сульфатов), которые сохраняются даже при кипячении жидкости.
- Общая Жо — это суммированная концентрация присутствия магния и кальция в виде ионных соединений. Сумма получается от сложения временной и постоянной величин: Жо=Жк+Жнк.
При очистке принимаются во внимание все типы: Жо, Жк, Жнк. Предельно допустимая концентрация питьевой воды по жесткости (кратко: ПДК) обычно устанавливается для общей Жо.
Нормы жесткости для воды
Нормирование определяется документами стандартизации: ГОСТ, СанПиН, ТУ. Точные данные получают, проводя испытания проб в аккредитованных лабораториях, в санэпидстанциях. Для фиксирования лабораторных показаний приняты международные единицы измерения жесткости воды:
- моль/м 3 — количество молей на кубический метр жидкости;
- мг-экв/л — миллиграмм-эквиваленты на кубический дециметр (на 1 литр);
- °Ж — градус жесткости.
Измеряемая единица жесткости воды 1°Ж равна 1 мг-экв/л и равна 1/2 миллимоля на литр. Допустимые значения для ионов кальция и магния разные: для Ca2+1°Ж=20,04, для Mg2+1°Ж=12,16 мг/л (примечание: эти показатели вставляются в расчетную формулу, см. далее по тексту*).
По структуре вода может быть мягкой, средней, жесткой. Мягкой считается дистиллированная, кипяченая, дождевая, талая водичка. Жидкость средней жёсткости поступает из централизованных водопроводов. Артезианская и родниковая водица тоже отличаются средними показателями. К сильножесткой относится вододобыча из соленых водоемов, нуждающаяся в опреснении. В таблице показаны концентрации солей в разных размерных единицах.
Предельно допустимое содержание солей жесткости в воде
| Степень жесткости воды | Показатель в мг-экв/л | Показатель в °Ж | Показатель в ppm |
| Слишком мягкая | до 1,5 | до 1-1,5 | 0-70 |
| Мягкая | 1,5-4 | 1,6-4 | 71-140 |
| Среднежёсткая | 5-8 | 5-12 | 141-210 |
| Сильножёсткая | 9-12 | 13-22 | 211-320 |
| Сверхжёсткая | свыше 12 | 23-34 | 321-530 |
Нормы жесткости для питьевой воды
В СанПиН указаны вариативные величины, в зависимости от применения водных растворов. Жесткость воды по ГОСТУ также регламентируется в зависимости от типа и назначения жидкостей:
- Для обычной сетевой водицы определяется концентрация магния (до 50 мг/л).
- В бутилированной учитываются показатели Ca = 25-130 и Mg = 5-65 мг/л.
- Для воды, использующейся в хозяйственно-питьевых целях ПДК питьевой воды по жесткости не должно превышать 350 мг/л (7-10 мг-экв/л или 1-1,5 грамма на литр).
- Для напитков высшей категории нормой является Жо=1,5-7, для первой не более 7 мг-экв/л.
- По ВОЗ-нормативам в питьевой водице допустимо 10-30 мг магния и 20-80 мг кальция на 1 литр.
- Общая жесткость для питьевой воды по EC не выше 1,2 мг-экв/л.
Нормативно установлены нижние пределы показателей жесткости питьевой воды. В нормальной водичке обязательно должно присутствовать небольшое количество солей. Кальций полезен для организма, из напитков его микроэлементы усваивается лучше, чем из продуктов. Массовая концентрация кальция в питьевой воде не должна быть ниже 0,12, магния меньше 0,04, сульфатов и хлоридов менее 2 мг/дм 3 . Мягкая водичка вымывает из тела кальций, вызывая неприятные последствия — разрушаются кости и зубы. Слишком жесткая вызывает образование камней в организме, нарушает работу системы выделения. Соленая вода разрушительно действует на оборудование гидросистем, засоряет отложениями стенки трубопроводов, увеличивает расходы на нагрев.
Если в воде солей жесткости больше, чем предписано стандартами, нужно её очистить до допустимых показателей. В табличке указаны степени солевой концентрации по шкале жёсткости с показателями в промилле.
Шкала жесткости
| Концентрация солей | Величина в ppm (в промилле или мг/л) |
| Представляющая опасность для жизни | свыше 500 |
| Предельно допустимая | 500 |
| Средний показатель вод, добываемых из природныхводоемов | 400 |
| Допустимое значение воды, подающейся из водопровода | 300 |
| После прохождения угольных фильтров | 170 |
| После очистки системой обратного осмоса | 0-50 |
Нормы жесткости для технической воды
Какой должна быть жесткость котловой воды — норма устанавливается отдельно для котлов с разным давлением:
- до 1,4 МПа (14 кгс/см 2 ) = 15-20;
- 2,4 МПа (24 кгс/см 2 ) = 10-15;
- 3,9 Мпа (40 кгс/см 2 )= 4-10 мкмоль/дм 3 (мкг-экв/дм 3 ).
Первая (меньшая) цифра указывается для котлов, работающих на жидком топливе при тепловом потоке свыше 350 кВт на кв. метр. Вторая (большая) цифра — для котлов, работающих на иных видах топлива при тепловом потоке до 350 кВт/м 2 .
ГОСТ по определению жесткости в воде подскажет, какие параметры допустимы:
Раздельно нормируется питьевая вода по жесткости разных категорий: дистиллированная, сетевая, разливная. Для солей железа показатели рассчитываются отдельно.
Как определить жесткость воды
Очень сложно определить на ощупь, какая вода — жесткая или мягкая. Термин «жёсткость» возник потому, что после стирки ткани теряют мягкость, шерстистость или шелковистость, становятся неприятно жесткими на ощупь. Ткацкие или трикотажные переплетения, независимо от плотности, имеют пористую структуру. К волокнам присоединяются соли, что делает вещи после стирки более грубыми, жесткими, плотными.
Определить жесткость воды в можно как в лаборатории, так и в домашних условиях. Наличие солей жесткости можно определить визуально:
- Напитки имеют неприятный горчащий вкус.
- Чаи завариваются дольше обычного.
- Мясо при варке становится неприятно жестким.
- На стенках посуды заметны солевые отложения.
- На приборах образуется обильная накипь.
- На волосах после мытья и на расческе остается белесый налет.
- Мыло и порошок плохо пенятся, при стирке увеличивается их расход.
Повышенная жесткость питьевой воды может причинить ущерб здоровью и нагревательным приборам. Не зная точных показателей концентрации солей, сложно рассчитать дозу средств от накипи для стирально-сушильных агрегатов или запрограммировать на чистку кофемашину. Трудно обеспечить комфортное обитание рыбкам в аквариуме или правильно выбрать фильтры очистки. Помимо визуальной оценки лучше использовать более точные измерительные методы определения жесткости питьевой и технической воды.
Измерение жесткости воды
Перед употреблением в пищу, перед поливом огорода, перед подачей в трубопроводы или перед техническим применением воды для производственных процессов полезно проверить наличие солей жесткости. Такая проверка снимет претензии потребителей к водоснабжающим компаниям, продлит срок службы дорогого промышленного оборудования.
Для измерения жесткости воды используют бытовые и профессиональные приборы:
- Медицинские полоски, продающиеся в аптеках, выдают хороший результат с точностью до 1-2°Ж.
- Экспресс-тесты для аквариума позволяют следить за подачей воды в емкости с водными обитателями или проверять растворы, предназначенные для полива растений.
- Солемер, спектроанализатор, TDS и EC-метр показывают содержание солей и иные параметры: удельную электропроводность, сопротивление раствора.
Полезно заказать исследование в лаборатории, чтобы получить точные результаты с подтверждающей документацией. Тогда не придется думать, чем определить жесткость воды, не нужно покупать измерительные приборы или рассчитывать показатели по косвенным параметрам, используя формулы.
Как определить жесткость воды по формуле
Определить жесткость воды можно по формуле. Для определения общих показателей нужно выполнить расчет:
Жо = [Ca 2+ ] + [Mg 2+ ] = (m(Ca 2+ ))/(Э(Ca 2+ ) x V(H2O)) + (m(Mg 2+ ))/(Э(Mg 2+ ) x V(H2O)),
[Ca 2+ ]; [Mg 2+ ] — концентрация ионов кальция и магния, в мг-экв/дм3;
m(Ca 2+ ); m(Mg 2+ ) — содержание ионов в мг;
V(H2O) — объем воды, дм 3 ;
Э -эквивалентная масса ионов* (её значения уже приводились в тексте: Ca 2+ =20,04; Mg 2+ =12,16 мг/лили г/моль).
Расчетный результат получается в единицах: мг-экв/дм 3 .
Далее вычисляют временную или постоянную жёсткость. Рассчитанную величину вычитают из Жо и получают значения всех трёх категорий Ж.
Карбонатная Жк вычисляется по формуле:
Как понизить жесткость в питьевой воде
Понизить жесткость питьевой воды можно бытовыми способами и с помощью профессионального оборудования. Для умягчения водных составов в быту применяют простые и доступные методы: кипячение, отстаивание, заморозка с оттаиванием. Используют дистилляты и бытовые фильтры.
Длительным кипячением (20-30 минут) можно устранить карбонатную жёсткость — гидрокарбонаты разлагаются, выделяя углекислый газ и отложения накипи:
Ca 2+ +2HCO3-=CaCO3↓+H2O+CO2↑(стрелками показаны: ↓ — осадок, ↑ — улетучивание);
Для загородных домов и промышленного умягчения используют профессиональные установки солеочистки:
- Фильтры умягчения, их работа основана на натрий-катионировании — замещении ионов присутствующих солей катионами натрия.
- Ионообменные фильтры с многокомпонентными смолами (Экотар, Экомикс) сразу производят обессоливание и обезжелезивание.
- Обратный осмос — лучший вариант очистки с помощью мембран. При его использовании обеспечена допустимая норма жесткости воды без прочих дополнительных систем фильтрации.
На сайте компании Diasel можно купить любые фильтры для удаления из воды солей жесткости. Мы продаем комплектующие к установкам обратного осмоса, соберем для вас комплексные линии очистки, предоставим реагенты для снижения уровня безопасности основного жизненного напитка. Гарантируем консультации по любым вопросам, помощь по монтажным работам, текущему и сервисному обслуживанию. С нашими профессиональными установками жесткость воды всегда будет в норме.
Источник



