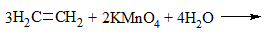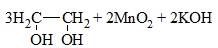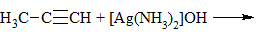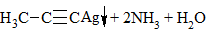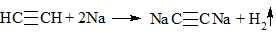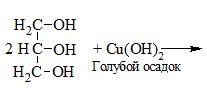Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества .
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 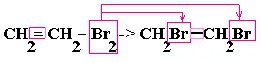 2. Изменение окраски раствора 2. Изменение окраски раствора 3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 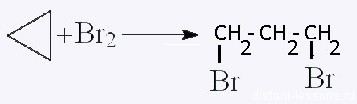 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 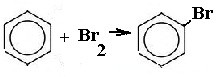
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 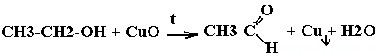 |
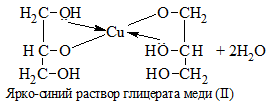
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 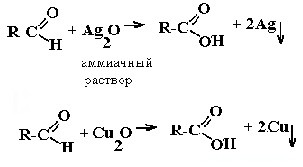 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Источник
4.1.5. Качественные реакции органических соединений.
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции | ||
| Фенол | Бромная вода | |||
| Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | ||||
| Анилин | Бромная вода | |||
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) | |||
| Лакмус | Окрашивание лакмуса в красный цвет | |||
| Карбонаты, например, K2CO3 | Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 |
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: • правильно произведены вычисления, необходимые для установления молекулярной формулы вещества и записана молекулярная формула вещества; • записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; • с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания Источник Некоторые темы органической химии для подготовки к ЕГЭЗадание 25. Качественные реакции (подробно)1. Как распознать алкены и стирол (в случае стирола в реакции вступает только двойная связь боковой цепи, а не бензольное кольцо) 1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях) 2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета: Раствор перманганат калия фиолетового цвета. В результате реакции окраска исчезает, образуется осадок MnO2 бурого цвета. 2. Как распознать алкины 1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях): 2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета: 3) + [Ag(NH3)2]OH → выпадение осадка в случае концевой тройной связи: 4) + Металл → выпадение осадка и выделение водорода в случае концевой тройной связи 3. Как распознать бензол 1) Бензол горит коптящим пламенем из-за большого содержания углерода. Благодаря устойчивой ароматической системе бензол не вступает в реакции с водным раствором Br2 и раствором KMnO4. 4. Как распознать одноатомные спирты 1) + CuO → наблюдаем выделение металлической меди: С основаниями одноатомные спирты не взаимодействуют. 5. Как распознать многоатомные спирты 1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора: С щелочами многоатомные спирты не взаимодействуют. 6. Как распознать фенолы 1) + Br2 → выпадение белого осадка 2,4,6-трибромфенола 2) + FeCl3 → раствор фиолетового цвета 7. Как распознать альдегиды 1) + [Ag(NH3)2]OH → восстановление металлического серебра 2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета 8. Как распознать карбоновые кислоты 1) раствор лакмуса → изменение окраски на красную 2) + Na2CO3/NaHCO3  → выделение газа CO2 9. Как распознать соли высших карбоновых кислот 1) + HCl (любая сильная кислота) → появление хлопьев нерастворимых высших кислот 10. Как отличить муравьиную кислоту от уксусной Муравьиная кислота содержит и альдегидную группу тоже, следовательно, возможны реакции, характерные альдегидам: 1) + [Ag(NH3)2]OH → восстановление металлического серебра и выделение газа (так как кислота окисляется до CO2) 2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета и выделение газа (так как кислота окисляется до CO2). 11. Как распознать низшие амины 1) раствор лакмуса → изменение окраски на синюю (так как среда раствора щелочная) 1) раствор фенолфталеина → изменение окраски на малиновую 12. Как распознать анилин 1) + Br2 → выпадение белого осадка 2,4,6-триброманилина 13. Как распознать белок 1) + HNO3 → желтое окрашивание (ксантопротеиновая реакция) 2) + Cu(OH)2 → фиолетовое окрашивание (биуретовая реакция) 14. Как распознать глюкозу C6H12O6 1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора (реакция на несколько гидроксильных групп) 2) + Cu(OH)2 → при нагревании образуется осадок Cu2O красного цвета (реакция на альдегидную группу) 3) + [Ag(NH3)2]OH → восстановление металлического серебра 15. Как распознать крахмал 1) + I2 → появление синей окраски. Источник |