- Какую температуру имеет вода плавления
- При какой температуре плавится вода?
- Температура плавления и кипения воды
- Лекция. Химические и физические свойства природных вод
- Оглавление
- 1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
- 2. 2. ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ВОД
- 3. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
Какую температуру имеет вода плавления
Большая теплоемкость воды. Удельной теплоемкостью воды называют количество теплоты, которое необходимо, чтобы поднять температуру 1 кг воды на ГС. Вода обладает большой теплоемкостью. Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры. Объясняется такое явление тем, что значительная часть энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды, т. е. на преодоление упомянутой выше «склеенности» ее молекул.
Большая теплоемкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью, и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, обеспечивающей им довольно значительное постоянство условий.
Большая теплота испарения воды. Скрытая теплота испарения есть мера количества тепловой энергии, которую необходимо сообщить жидкости для ее перехода в пар, т. е. для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии. Это объясняется существованием водородных связей между ее молекулами. Именно в силу этого температура кипения воды — вещества со столь малыми молекулами — необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, а также при тепловой одышке у млекопитающих или у некоторых рептилий (например крокодилов), которые на солнцепеке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев. Большая теплота испарения означает, что отдача организмом даже больших количеств тепла сопровождается минимальными потерями воды, т. е. не обязательно ведет к его обезвоживанию.
Некоторые важные биологические функции воды
Большая теплота плавления воды. Скрытая теплота плавления — это мера тепловой энергии, необходимой для расплавления твердого вещества (в нашем случае — льда). Для плавления (таяния) льда необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
Плотность и и поведение воды вблизи точки замерзания. Плотность воды от +4 до О °С понижается, поэтому лед легче воды и в воде не тонет. Вода — единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твердом.
Поскольку лед плавает в воде, он образуется сначала на ее поверхности и лишь затем в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоемах вообще не могла бы существовать. Лед покрывает толщу воды, как одеялом, что повышает шансы на выживание у организмов, обитающих в воде. Это важно в условиях холодного климата и в холодное время года, но, несомненно, особенно важную роль это играло в ледниковый период. Кроме того, находясь на поверхности, лед быстрее и тает. То обстоятельство, что слои воды, температура которых упала ниже 4°С, поднимаются вверх, обусловливает перемешивание воды в больших водоемах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоемы заселяются живыми организмами на большую глубину.
Большое поверхностное натяжение и когезия воды. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности была минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды. Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях (гл. 13). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
Вода как реагент. Биологическое значение воды определяется тем, что она представляет собой один из необходимых метаболитов, т. е. участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода при фотосинтезе, а также участвует в реакциях гидролиза.
Некоторые важные с биологической точки зрения функции воды перечислены в таблице.
Источник
При какой температуре плавится вода?
вопрос в терминологии))) вот имеет вода название в твердом состоянии лед. поэтому вопрос звучит непривычно, а скажем ртуть не имеет. Поэтоому вопрос о температуре плавления ртути не вызвалбы нареканий )
Всиму виной стереотипность мышления
Вада ни как не сможет плавица и только испарятся!
If I gave you correct answer, please, protect my answer best!
вопрос в терминологии))) вот имеет вода название в твердом состоянии лед. поэтому вопрос звучит непривычно, а скажем ртуть не имеет. Поэтоому вопрос о температуре плавления ртути не вызвалбы нареканий )
Всиму виной стереотипность мышления
вопрос в терминологии))) вот имеет вода название в твердом состоянии лед. поэтому вопрос звучит непривычно, а скажем ртуть не имеет. Поэтоому вопрос о температуре плавления ртути не вызвалбы нареканий )
Всиму виной стереотипность мышления
вопрос в терминологии))) вот имеет вода название в твердом состоянии лед. поэтому вопрос звучит непривычно, а скажем ртуть не имеет. Поэтоому вопрос о температуре плавления ртути не вызвалбы нареканий )
Всиму виной стереотипность мышления
вопрос в терминологии))) вот имеет вода название в твердом состоянии лед. поэтому вопрос звучит непривычно, а скажем ртуть не имеет. Поэтоому вопрос о температуре плавления ртути не вызвалбы нареканий )
Всиму виной стереотипность мышления
вопрос в терминологии))) вот имеет вода название в твердом состоянии лед. поэтому вопрос звучит непривычно, а скажем ртуть не имеет. Поэтоому вопрос о температуре плавления ртути не вызвалбы нареканий )
Всиму виной стереотипность мышления
вообщем то для воды тройная точка — 0 градусов.. . Которые Цельсия.. . 101.3 кПа.. . или одна атмосфера.. .
Если давление меняется точка смещается.. . (для того чтоб сместить значительно нужны ну прямо таки гигантские давления — все таки сжимаемость воды слабая. )
Источник
Температура плавления и кипения воды
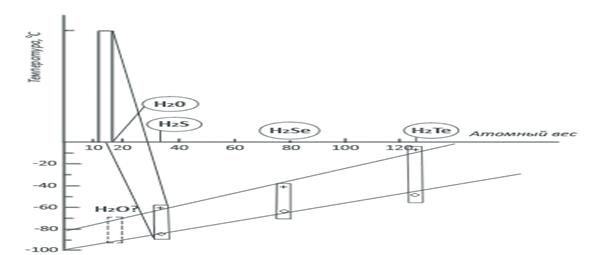
Самое удивительное и благостное для живой природы свойство воды — это ее способность при «нормальных» условиях быть жидкостью. Молекулы очень похожих на воду соединений (например, молекулы H2S или H2Se) намного тяжелее, а образуют при тех же условиях газ. Тем самым вода как будто противоречит закономерностям таблицы Менделеева, которая, как известно, предсказывает, когда, где и какие свойства веществ будут близки. В нашем случае из таблицы следует, что свойства водородных соединений элементов (называемых гидридами), расположенных в одних и тех же вертикальных столбцах, с ростом массы атомов должны изменяться монотонно. Кислород — элемент шестой группы этой таблицы. В этой же группе находятся сера S (с атомным весом 32), селен Se (с атомным весом 79), теллур Te (с атомным весом 128) и поллоний Po (с атомным весом 209). Следовательно, свойства гидридов этих элементов должны меняться монотонно при переходе от тяжелых элементов к более легким, т.е. в последовательности H2Po → H2Te → H2Se → H2S → H2O. Что и происходит, но только с первыми четырьмя гидридами. Например, температуры кипения и плавления растут при увеличении атомного веса элементов. На рисунке крестиками отмечены температуры кипения этих гидридов, а кружочками — температуры плавления.
Как видно, при уменьшении атомного веса температуры снижаются совершенно линейно. Область существования жидкой фазы гидридов становится все более «холодной», и если бы гидрид кислорода Н2О был нормальным соединением, похожим на своих соседей по шестой группе, то жидкая вода существовала бы в диапазоне от -80° С до -95° С. При более высоких температурах Н2О всегда была бы газом. К счастью для нас и всего живого на Земле, вода аномальна, она не признает периодической закономерности а следует своим законам.
Объясняется это довольно просто — большая часть молекул воды соединена водородными связями. Именно этими связями отличается вода от жидких гидридов H2S, H2Se и H2Te. Если бы их не было, то вода кипела бы уже при минус 95 °C. Энергия водородных связей достаточно велика, и разорвать их можно лишь при значительно более высокой температуре. Даже в газообразном состоянии большое число молекул H2O сохраняет свои водородные связи, объединяясь в димеры (H2O)2. Полностью водородные связи исчезают только при температуре водяного пара 600 °C.
Напомним, что кипение заключается в том, что пузыри пара образуются внутри кипящей жидкости. При нормальном давлении чистая вода кипит при 100 ‘С. В случае подведения тепла через свободную поверхность будет ускоряться процесс поверхностного испарения, но объёмного парообразования, характерного для кипения, не возникает. Кипение может быть осуществлено и понижением внешнего давления, так как в этом случае давление пара, равное внешнему давлению, достигается при более низкой температуре. На вершине очень высокой горы давление и соответственно точка кипения настолько понижаются, что вода становится непригодной для варки пищи — не достигается требуемая температуры воды. При достаточно высоком давлении воду можно нагреть настолько, что в ней может расплавиться свинец (327 °С), и все же она не будет кипеть.
Помимо сверхбольших температур кипения плавления (причем последний процесс требует слишком большой для такой простой жидкости теплоты плавления), аномален сам диапазон существования воды — сто градусов, на которые разнятся эти температуры, — довольно большой диапазон для такой низкомолекулярной жидкости, как вода. Необычайно велики пределы допустимых значении переохлаждения и перегрева воды — при аккуратном нагревании или охлаждении вода остается жидкой от -40 °C до +200 °C. Тем самым температурный диапазон, в котором вода может оставаться жидкой, расширяется до 240 °C.
При нагревании льда сначала температура его повышается, но с момента образования смеси воды со льдом температура будет оставаться неизменной до того момента, пока не расплавится весь лёд. Это объясняется тем, что тепло, подводимое к тающему льду, прежде всего расходуется только на разрушение кристаллов. Температура тающего льда остаётся неизменной до тех пор, пока не произойдёт разрушение всех кристаллов (см. скрытую теплоту плавления).
Расплавы
Расплавы — жидкое расплавленное состояние веществ при температурах, в определённых границах удалённых от критической точки плавления и расположенных ближе к температуре плавления. Природа расплавов по своей сути определяется видом химических связей элементов в расплавленном веществе.
Расплавы находят широкое применение в металлургии, стекловарении и других областях техники. Обычно расплавы имеют сложный состав и содержат различные взаимодействующие компоненты (см. фазовая диаграмма).
Расплавы бывают
1.Металлические (Мета́ллы (название происходит от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск);
2.Ионные (Ио́н (др.-греч. ἰόν — идущее) — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов атомом или молекулой. Ионизация (процесс образования ионов) может происходить при высоких температурах, под воздействием электрического поля);
3.Полупроводниковые с ковалентными связями между атомами (Полупроводники́ — материалы, которые по своей удельной проводимости занимают промежуточное место между проводниками и диэлектриками и отличаются от проводников сильной зависимостью удельной проводимости от концентрации примесей, температуры и различных видов излучения. Основным свойством этих материалов является увеличение электрической проводимости с ростом температуры);
4.Органические расплавы с ван-дер-ваальсовыми связями;
5.Высокополимерные (Полимеры (греч. πολύ- — много; μέρος — часть) — неорганические и органические, аморфные и кристаллические вещества, получаемые путём многократного повторения различных групп атомов, называемых «мономерными звеньями», соединённых в длинные макромолекулы химическими или координационными связями)
Расплавы по типу химических соединений бывают:
3.Оксидно-силикатные (шлаковые) и др.
Расплавы с особыми свойствами:
Источник
Лекция. Химические и физические свойства природных вод
| Сайт: | Дистанционное образование Казанского федерального университета |
| Курс: | Гидрология |
| Книга: | Лекция. Химические и физические свойства природных вод |
| Напечатано:: | Гость |
| Дата: | Пятница, 22 октября 2021, 08:49 |
Оглавление
1. 1. ВОДА КАК ВЕЩЕСТВО, ЕЕ МОЛЕКУЛЯРНАЯ СТРУКТУРА И ИЗОТОПНЫЙ СОСТАВ
Вода — это простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом. По своей химической природе—это оксид (окись) водорода Н2О. В чистом виде вода — вещество бесцветное, не имеющее ни вкуса, ни запаха.
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине.
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд.
Оба атома водорода , лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды— величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т. е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде.
При повышении температуры наряду с упомянутым уплотнением «упаковки» молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения воды, при температуре выше 4°С — тепловое расширение , поэтому вода обладает «аномальным» свойством — наибольшей плотностью не при температуре плавления, а при 4°С.
Водород и кислород имеют несколько природных изотопов:
1 Н — «обычный» водород),
2 Н — «тяжелый» водород, или дейтерий),
3 Н — радиоактивный «сверхтяжелый» водород, или тритий).
16 О, 17 О, 18 О. Поэтому и сама вода имеет переменный изотопный состав.
Природная вода — это смесь вод разного изотопногосостава.
Наиболее распространена вода, состоящая из изотопов 1 Н и 16 О – «обычная» вода, доля других изотопных видов воды ничтожна — менее 0,27 %. Приведенные в дальнейшем сведения относятся только к «обычной» воде.
Одна из главных причин, приводящих к различию изотопного состава природных вод,— процесс испарения.
В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, а в результате конденсации — более легкими.
Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат «тяжелого» водорода ( 3 Н) и «тяжелого» кислорода ( 18 О) меньше, чем океанические воды.
Воду с изотопным составом ‘Н2 16 О называют «обычной» водой и обозначают просто Н2О, остальные виды воды (кроме 3 Н2О) называют «тяжелой» водой. Иногда «тяжелой» водой считают лишь дейтериевую воду 2 Н2О (или О2О). Вода с изотопным составом 3 Н2О (или Т2О) — так называемая «сверхтяжелая» вода. Ее на Земле находится всего 13—20 кг.
2. 2. ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ВОД
Вода — слабый электролит, диссоциирующий по уравнению:
Уравнение характеризует так называемое ионное равновесие воды. Состояние ионного равновесия природных вод отражает водородный показатель рН.
Благодаря особенностям молекулярного строения вода обладает свойством хорошо растворять различные химические вещества. Природная вода представляет собой слабый раствор.
В воде хорошо растворяются: соли, газы, биогенные вещества, микроэлементы.
Суммарное содержание в воде растворенных неорганических веществ (концентрация солей) выражают в виде минерализации М(мг\л, г\л), либо в относительных единицах (%, ‰).
Содержание растворенных в воде веществ в г/кг или в промилле (%о) называется соленостью воды
По содержанию солей (минерализации или солености) природные воды подразделяют на четыре группы:
Минерализация природных вод разного типа может изменяться в довольно широких пределах: от 0,01 г/л в атмосферных осадках до 600 г/л в рассолах.
К числу главных ионов солей, находящихся в природных водах, относятся: 1. Отрицательно заряженные ионы (анионы):
2. Положительно заряженные ионы (катионы) :
кальция Са 2+ , магния Ме 2+ , натрия Ка + и калия К + .
Все природные воды делятся по преобладающему аниону на три класса: гидрокарбонатный, сульфатный и хлоридный;
по преобладающему катиону на три группы: кальциевую, магниевую, натриевую.
Природные воды различного происхождения обычно имеют и различный солевой состав и относятся соответственно к разным классам и группам.
Речные воды , как правило, относятся к гидрокарбонатному классу и кальциевой группе.
Подземные воды нередко относятся к сульфатному классу и магниевой группе.
Воды океанов и морей принадлежат к хлоридному классу и натриевой группе.
Сумма концентрации наиболее распространенных двухвалентных катионов Са 2+ и Мg 2+ называется общей жесткостью воды.
Повышенная жесткость обусловлена растворением в воде горных пород, содержащих карбонаты и сульфаты кальция и магния.
Наиболее распространенные газы, растворенные в природных водах,— это кислород О2, азот N3, диоксид углерода С02, сероводород Н2S.
Газы хорошо растворяются в воде, если способны вступать с ней в химические связи. К таким газам относятся: аммиак NН3, сероводород Н2S, сернистый газ SО2, диоксид (двуокись) углерода, или углекислый газ СО2, и др.).
Прочие газы мало растворимы в воде.
При понижении давления, повышении температуры и увеличении солености растворимость газов в воде уменьшается.
Источниками поступления газов в воду служат:
— жизнедеятельность растений (О2),
— разложение органического вещества (СО2, СН4э Н25).
На практике нередко пользуются относительной характеристикой содержания в воде растворенных газов — процентом насыщения (А) — отношение фактического содержания газа (Ф) к равновесной концентрации (Р) в воде при данной температуре.
где Ф — фактическое содержание газа,
Р — его равновесная концентрация в воде при данной температуре.
Если фактическое содержание газа в поверхностном слое воды больше равновесной концентрации и величина А >100 %, то происходит выделение газа в атмосферу.
Если вода не насыщена газом и А радиоактивные вещества естественного (калий 40 К, рубидий 87 Rb, уран 258 U), радий 226 Rа и др.) и антропогенного (стронций 90 Sr, цезий 137 Сsи др.) или смешанного происхождения.
Таким образом, содержащиеся в растворенном состоянии в воде ионы солей, газы, биогенные и органические вещества, микроэлементы различаются как по концентрации, так и по роли в физических, химических и биологических процессах в водной среде.
Особую категорию содержащихся в воде соединений составляют так называемые загрязняющие вещества (3В), оказывающие вредное воздействие на живую природу и жизнедеятельность человека.
Это прежде всего нефтепродукты, ядохимикаты (пестициды, гербициды), удобрения, моющие средства (детергенты), некоторые микроэлементы (очень токсичны тяжелые металлы — ртуть, свинеци кадмий), радиоактивные вещества.
Большая часть загрязняющих веществ имеет антропогенное происхождение, хотя существуют и естественные источники загрязнения природных вод.
Особенности химического (и биологического) состава природных вод вместе с некоторыми их физическими свойствами, о которых речь пойдет ниже, часто объединяются в понятие «качество воды», при этом обычно имеют в виду пригодность вод для какого-либо использования.
Поэтому качество воды — характеристика состава и свойств воды, определяющая пригодность ее для конкретного водопользования.
3. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
Агрегатные состояния воды и фазовые переходы
Вода может находиться в трех агрегатных состояниях, или фазах,—
жидком (собственно вода),
газообразном (водяной пар).
Очень важно, что при реально существующих на Земле диапазонах атмосферного давления и температуры вода может находиться одновременно в разных агрегатных состояниях. В этом отношении вода существенно отличается от других физических веществ, находящихся в естественных условиях преимущественно либо в твердом (минералы, металлы), либо в газообразном (О2, Н2, СО2 и т. д.) состоянии.
Изменения агрегатного состояния вещества называют фазовыми переходами. В этих случаях свойства вещества (например, плотность) скачкообразно изменяются. Фазовые переходы сопровождаются выделением или поглощением энергии, называемой теплотой фазового перехода («скрытой теплотой»).
При давлении 610 Па и температуре 0,01 °С вода одновременно находится во всех трех агрегатных состояниях.
При нормальном атмосферном давлении (1,013 10 5 Па= 1,013 бар = 1 атм = 760 мм рт. ст.)
t замерзания воды (плавления льда) = 0 0 С
tкипения (конденсации) = 100 °С.
Температура замерзания и температура кипения воды зависят от давления.
1 амт=670 мм – от 0 до 0,01 0 С
2200 атм — -22 0 С
Последнее означает, что лед в нижней части толщи ледника, находящийся под давлением, может таять даже при небольшой отрицательной температуре.
При дальнейшем увеличении давления — быстро возрастает.
На максимальных глубинах в океане (около11 км) давление превышает 10 8 Па (увеличение глубины на каждые 10 м увеличивает давление приблизительно на 10 Па). При таком давлении температура замерзания пресной воды была бы около -12 °С.
На снижение температуры замерзания воды оказывает влияние ее соленость Увеличение солености на каждые 10 ‰при атмосферном давлении снижаетприблизительно на 0,54°С.
Температура кипения с уменьшением давления снижается, поэтому на больших высотах в горах вода кипит при температуре ниже, чем 100 °С.
При росте давления tкип. возрастает до так называемой «критической точки»
при Р = 2.2 10 -7 Па tкип. = 374 0 С
вода одновременно имеет свойства и жидкости и газа
Плотность — главнейшая физическая характеристика любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу его объема:
Плотность воды, как и других веществ, зависит, прежде всего, от температуры и давления (а для природных вод — еще и от содержания растворенных и тонкодисперсных взвешенных веществ) и скачкообразно изменяется при фазовых переходах.
При повышении температуры плотность воды, как и любого другого вещества, в большей части диапазона изменения температуры уменьшается (т.к. увеличивается расстояния между молекулами при росте температуры). Эта закономерность нарушается лишь при плавлении льда и при нагревании воды в диапазоне от 0 до 4°С (точнее 3,98 °С). Здесь отмечаются еще две очень важные «аномалии» воды:
1) плотность воды в твердом состоянии (лед) меньше, чем в жидком (вода), чего нет у подавляющего большинства других веществ,
2) в диапазоне температуры воды от 0 до 4 °С плотность воды с повышением температуры не уменьшается, а увеличивается .
Эти две «аномалии» воды имеют огромное гидрологическое значение: лед легче воды и поэтому «плавает» на ее поверхности; водоемы обычно не промерзают до дна, так как охлажденная до температуры ниже 4 °С пресная вода становится менее плотной и поэтому остается в поверхностном слое.
Плотность воды изменяется также в зависимости от содержания в ней растворенных веществ (солености) и увеличивается с ростом солености.
Увеличение солености на каждые 10 ‰ снижает температуру наибольшей плотности приблизительно на 2 °С.
Соотношения между температурами наибольшей плотности и замерзания влияют на характер процесса охлаждения воды и вертикальной конвекции — перемешивания, обусловленного различиями в плотности. Охлаждение воды в результате теплообмена с воздухом приводит к увеличению плотности воды и, соответственно, к опусканию более плотной воды вниз. На ее место поднимаются более теплые и менее плотные воды. Происходит процесс вертикальной плотностной конвекции.
Таким образом, в пресных или солоноватых водах зимой в придонных горизонтах температура воды оказывается выше, чем на поверхности и всегда выше температуры замерзания.
Это обстоятельство имеет огромное значение для сохранения жизни в водоемах на глубинах. Если бы у воды температуры наибольшей плотности и замерзания совпадали бы, как у всех других жидкостей, то водоемы могли промерзать до дна, что привело бы к неизбежной гибели большинства организмов.
Аномальное изменение плотности воды при изменении температуры влечет за собой такое же «аномальное» изменение объема воды :
— с возрастанием температуры от 0 до 4 °С объем химически чистой воды уменьшается, и лишь при дальнейшем повышении температуры — увеличивается;
— объем льда всегда заметно больше объема той же массы воды (вспомним, как лопаются трубы при замерзании воды).
Некоторое влияние на плотность воды оказывает также давление. Сжимаемость воды очень мала, но она на больших глубинах в океане все же сказывается на плотности воды. На каждые 1000 м глубины плотность вследствие влияния давления столба воды возрастает на 4,5—4,9 кг/м 3 .
Если бы вода была совершенно несжимаемой, уровень Мирового океана стоял бы на 30 м выше, чем в действительности.
Тепловые свойства воды
К важным особенностям изменения агрегатного состояния воды или так называемых фазовых переходов относятся большая затрата теплоты на плавление, испарение, кипение, возгонкуи большое выделение теплоты при обратных переходах.
В сравнении с другими веществами удельная теплота плавления льда и удельная теплота парообразования аномально высоки. Они представляют две очередные «аномалии» воды.
Удельная теплота плавления пресного льда Lпл– количество теплоты, затрачиваемое при превращении единицы массы льда при температуре плавления и нормальном атмосферном давлении в воду = 333 000 Дж/кг.
Столько же теплоты выделяется при замерзании (кристаллизации)
химически чистой воды.
Удельная теплота парообразования (испарения) LИСП — количество теплоты, необходимое для превращения единицы массы воды в пар (в Дж/кг)) зависит от температуры:
При 0 и 100 °С 1ИСП равны соответственно 2,510 6 и 2,26х х 10 6 Дж/кг.
Столько же теплоты выделяется при конденсации водяного пара.
Удельная теплота испарения льда (возгонки) складывается из удельной теплоты плавления и удельной теплоты испарения:
Для нагревания воды вне точек фазовых переходов необходимо затратить большое количество теплоты.
Удельная теплоемкость воды — количество теплоты, необходимое для нагревания единицы массы воды на один градус.
Удельная теплоемкость также аномально высока по сравнению с теплоемкостью других жидкостей и твердых веществ.
Удельная теплоемкость воды при постоянном давлении, при 15 °С
С увеличением содержания в воде солей удельная теплоемкость воды слабо уменьшается. Поэтому теплоемкость морской воды немного меньше, чем пресной.
Отмечается также небольшое уменьшение удельной теплоемкости воды с увеличением давления, что также имеет некоторое значение для тепловых процессов в толще океана.
Таким образом, отмеченные аномальные особенности тепловых свойств воды способствуют теплорегуляции процессов на Земле. При меньших значениях tпл, tисп поверхность Земли нагревалась бы и охлаждалась гораздо быстрее, возрос бы и диапазон изменения температуры. В таких условиях вся вода на Земле то замерзала бы, то испарялась, гидросфера имела бы совсем иные свойства, а жизнь в таких условиях вряд ли была бы возможна.
Из других тепловых свойств воды важное значение имеет теплопроводность.
Молекулярная теплопроводность воды очень мала, меньшую молекулярную теплопроводность имеет лишь воздух.
Малая теплопроводность воды способствует ее медленному нагреванию и охлаждению.
Снег предохраняет почву, а лед — водоемы от промерзания.
Передача теплоты в воде рек, озер и морей происходит в основном благодаря турбулентной (при динамическом перемешивании), а не молекулярной теплопроводности.
Некоторые другие физические свойства воды
Молекулярная вязкость воды (внутреннее трение).
Источник