Кислородсодержащие соединения галогенов
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее — оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
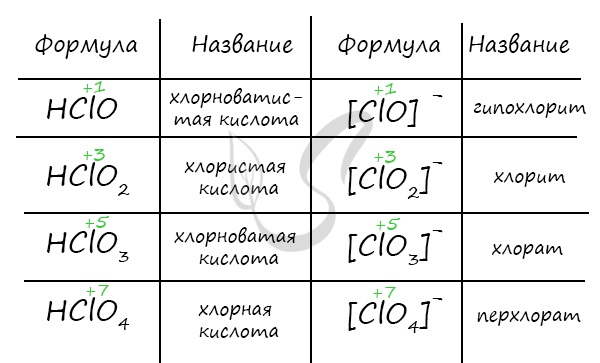
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO — бромноватистая кислота (соли гипобромиты), HIO — иодноватистая кислота (соли гипоиодиты).
HIO3 — иодноватая кислота (соли иодаты), HBrO3 — бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Хлористая кислота может быть получена из собственных солей — хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе — хлорная кислота — может быть получена реакцией перхлората калия или натрия с концентрированной серной кислотой.
Химические свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная — к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.
KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кислородсодержащие соединения галогенов
HBrO2 — бромистая кислота, слабая
HClO4 — хлорная кислота, сильная
Бертолетова соль — KClO3
HClO3 — хлорноватая кислота, сильная
Источник
Калий бром хлорная вода
Цель: повторить и обобщить сведения о свойствах, способах получения и применении галогенов, о свойствах галогеноводородов и кислородсодержащих соединений галогенов.
Оборудование: Периодическая система химических элементов Д.И. Менделеева (приведена в электронном учебном пособии).
Реактивы: кристаллический перманганат калия, концентрированная соляная кислота, раствор тиосульфата натрия, кристаллический йод, алюминиевая пыль, металлическая сурьма, газообразный хлор, хлорная вода, раствор бромида калия, раствор йодида калия, раствор нитрата серебра, раствор хлорида натрия, раствор бромида натрия, раствор йодида калия.
Посуда и приборы: колба Вюрца, капельная воронка, пробка, газоотводная трубка, цилиндр или колба с пробкой, штатив с лапкой, спиртовка, вата, керамическая плитка, фарфоровая ступка с пестиком, шпатель, фарфоровая чашка, пипетка, стеклянные палочки, стеклянный колокол, стаканы на 100 мл (6 шт).
Содержание урока соответствует части III.3 электронного учебного пособия.
Знакомство с химией галогенов необходимо начать с истории открытия этих элементов, познакомить учащихся с историей открытия хлора, брома и йода, подробнее рассмотреть открытие фтора, это очень опасный элемент и его первооткрыватели рисковали жизнью, но они об этом только догадывались. Английские химики Томас и Георг Нокс пытались получить фтор из фторидов серебра и свинца, Георг стал инвалидом, а Томас погиб. Та же участь постигла еще многих ученых. Такие знаменитые ученые как Деви, Гей-Люссак, Тенар потеряли здоровье, но не получили положительных результатов. 23 июня 1886 г . французский химик Анри Муассан подверг электролизу безводный фтороводород при температуре -23 °С и получил на аноде новое, чрезвычайно реакционноспособное газообразное вещество. Это и был фтор. За свое открытие Муассан был удостоен Нобелевской премии. Рассказать о происхождении названий элементов.
Охарактеризовать положение галогенов в Периодической системе химических элементов Д.И. Менделеева, показать, что на внешнем энергетическом уровне атомы галогенов имеют 7 электронов, их электронная конфигурация ns 2 np 5 . Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с металлами и водородом. Атомы галогенов, кроме фтора, могут проявлять положительные степени окисления: +1; +3; +5; +7 (объяснить проявление нечетных степеней окисления). Фтор, как самый электроотрицательный элемент, в своих соединениях проявляет степень окисления только -1. В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к кислороду. С увеличением порядкового номера галогена увеличивается число энергетических уровней в атоме, увеличивается радиус атома, уменьшается относительная электроотрицательность, окислительные свойства в группе ослабевают, и, следовательно, ослабевают неметаллические свойства.
Затем перейти к распространенности галогенов в земной коре. Обратить внимание на различное содержание элементов: довольно большое количество фтора и хлора (0,06; 0,02 (масс.) %) и низкое – брома и йода (2·10 -4 и 4·10 -5 (масс.) %). Отметить, что галогены – реакционноспособные вещества, встречаются исключительно в виде соединений.
Подробно познакомить учащихся с физическими свойствами галогенов и объяснить закономерности их изменения.
При изучении химических свойств галогенов обратить внимание на условия проведения реакций, рассмотреть взаимодействие с ксеноном (окислительные свойства фтора); взаимодействие с металлами, с водородом и другими неметаллами, с водой, со щелочами, сероводородом. Сделать вывод, что химическая активность при переходе от фтора к йоду уменьшается. Обратить внимание на способность галогенов вытеснять друг друга из растворов солей. Каждый вышестоящий в Периодической системе галоген является более сильным окислителем, чем последующий. Поэтому хлор может вытеснить бром и йод, но не фтор, йод не вытесняет ни одного галогена. Для иллюстрации химических свойств галогенов выполнить демонстрационных эксперимент: взаимодействие йода с алюминием; горение сурьмы в хлоре; взаимодействие хлора с бромидами и йодидами.
Взаимодействие йода с алюминием. Кристаллический йод и алюминиевую пыль смешать в абсолютно сухой фарфоровой чашке. Полученную смесь высыпать на керамическую плитку и стеклянной палочкой сделать небольшое углубление, внести в углубление длинной пипеткой несколько капель воды и быстро закрыть смесь стеклянным колоколом. Через несколько секунд начинается реакция взаимодействия алюминия и йода с образованием йодида алюминия:
Взаимодействие сопровождается воспламенением смеси с выделением паров йода.
Горение сурьмы в хлоре. Предварительно получить хлор и собрать его в колбу или цилиндр с пробкой, на дно которой помещен слой песка. Непосредственно перед опытом растереть сурьму в ступке (если сурьму приготовить заранее, опыт не получится). Открыть осторожно колбу (в вытяжном шкафу!) и небольшими порциями высыпать сурьму. Наблюдать горение сурьмы в хлоре с образованием хлоридов сурьмы:
Реакция очень эффектная: сурьма в хлоре вспыхивает, и колба наполняется белым дымом.
Взаимодействие хлора с бромидами и йодидами. Для проведения опыта необходима свежеприготовленная хлорная вода. В стаканы налить растворы бромида натрия и йодида калия, затем по каплям в стаканы прибавить хлорную воду. В стакане с раствором бромида натрия раствор окрашивается в оранжевый цвет, за счет выделившегося брома:
В стакане с раствором йодида калия раствор окрашивается в бурый цвет, за счет выделившегося йода:
Опыт демонстрирует способность галогенов вытеснять друг друга из растворов солей.
Рассмотреть получение галогенов в лаборатории и промышленности. Продемонстрировать получение хлора в лаборатории на примере взаимодействия перманганата калия с концентрированной соляной кислотой.
Опыт провести следующим образом. В колбу Вюрца, снабженную пробкой, капельной воронкой и стеклянной газоотводной пробкой насыпать немного перманганата калия, а в капельную воронку налить концентрированную соляную кислоту. Вводить кислоту по каплям в колбу, при этом наблюдается образование хлора:
Хлор собрать в цилиндр с пробкой.
Затем перейти к знакомству с галогеноводородами и галогеноводородными кислотами. Рассмотреть строение молекулы галогеноводородов, отметить их токсичность и высокую растворимость в воде. Показать, что при растворении в воде образуются галогеноводородные кислоты. Сила кислот различна. Фтороводородная кислота относится к числу слабых, остальные галогеноводородные кислоты – сильные. Сила кислот в ряду HF – HCl – HBr – HI возрастает, что объясняется уменьшением в этом же направлении энергии связи и увеличением межъядерного расстояния. HI – самая сильная кислота. Водным растворам галогеноводородов присущи все свойства сильных кислот, они реагируют с металлами, оксидами металлов, основаниями. Проявляют только восстановительные свойства, причем восстановительная активность в ряду Cl — – Br — – I — повышается. Обратить внимание на специфическую способность фтороводородной кислоты разрушать стекло и силикаты. Продемонстрировать качественную реакцию на ионы галогенов: взаимодействие растворимых галогенидов с раствором нитрата серебра. В результате реакции AgCl выпадает в виде осадка белого цвета, AgBr – желтовато-белого, AgI – желтого цвета. Осадки не растворимы в воде и азотной кислоте.
Опыт провести следующим образом. В стаканы налить растворы хлорида натрия, бромида натрия и йодида калия. При перемешивании в каждый стакан добавить раствор нитрата серебра до выпадения творожистых осадков. Наблюдается образование белого хлорида серебра:
желтовато-белого бромида серебра:
желтого йодида серебра:
Обратить внимания на цвет и структуру осадка.
Рассмотреть способы получения галогеноводородов.
Познакомить учащихся с кислородсодержащими соединениями галогенов: оксидами и кислотами. Вспомнить, что галогены не реагируют с кислородом, поэтому все их кислородсодержащие соединения получены косвенным путем. Привести формулы оксидов, рассмотреть их физические свойства и способы получения. Рассмотреть кислородсодержащие кислоты галогенов. Отметить, что хлорноватистая кислота и её бромный и йодный аналоги – очень слабые кислоты, известны только в разбавленных растворах, причем их сила уменьшается при переходе от HClO к HIO. Это объясняется тем, что хлор обладает большей электроотрицательностью и сильнее своих аналогов притягивает электронную пару, связывающую его с кислородом. Это, в свою очередь, приводит к смещению электронной пары, связывающей водород с кислородом, к кислороду и увеличению способности водорода к отщеплению. Сила кислородсодержащих кислот возрастает с ростом степени окисления центрального атома, например, в ряду HClO – HClO2 – HClO3– HClO4 сила кислот увеличивается.
В заключение рассмотреть применение галогенов и их важнейших соединений, обусловленное их свойствами.
После изучения материала предложить учащимся самостоятельно познакомиться с примерами решения задач и выполнить задания для самостоятельного решения (приведены в электронном учебном пособии).
Источник
Галогены
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 5 :
- F — 2s 2 2p 5
- Cl — 3s 2 3p 5
- Br — 4s 2 4p 5
- I — 5s 2 5p 5
- At — 6s 2 6p 5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит
Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
- Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Реакции с неметаллами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F — )
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br — )
Реакции с водой
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Реакции с щелочами
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник