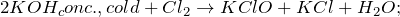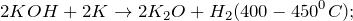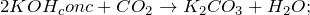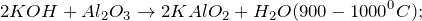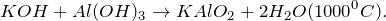- KH + H2O = ? уравнение реакции
- Гидрид калия: способы получения и химические свойства
- Способ получения
- Химические свойства
- Гидроксид калия: способы получения и химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
- Свойства калия и его взаимодействие с водой
- Химические свойства калия
- Взаимодействие калия со сложными веществами
- Строение калия
- Гидроксид калия, характеристика, свойства и получение, химические реакции
- Гидроксид калия, характеристика, свойства и получение, химические реакции.
- Краткая характеристика гидроксида калия:
- Физические свойства гидроксида калия:
- Получение гидроксида калия:
- Химические свойства гидроксида калия. Химические реакции гидроксида калия:
- Применение и использование гидроксида калия:
KH + H2O = ? уравнение реакции
Закончите уравнение реакции KH + H2O = ? Относится ли данная реакция к ОВР? Укажите основные физические и химические свойства продукта реакции. Приведите другие способы получения этого вещества.
В результате гидролиза гидрида калия, т.е. реакции его взаимодействия с водой (KH + H2O = ?) происходит образование гидроксида калия и выделение газа водорода. Молекулярное уравнение реакции имеет вид:
Записать ионные уравнения в данном случае не предоставляется возможным, поскольку практически все участвующие в химическом взаимодействии соединения являются малодиссоциирующими.
Гидроксид калия (едкое кали) представляет собой твердое вещество белого цвета. Весьма гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде с сильным экзо-эффектом, создает сильнощелочную среду.
Гидроксид калия реагирует с кислотами с образованием солей и воды. Его раствор изменяет цвет индикаторов, так, например, при добавлении лакмуса, фенолфталеина или метилового оранжевого в раствор этой щелочи их окраска станет синей, малиновой и желтой соответственно.
Гидроксид калия реагирует с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание), оксидами неметаллов, амфотерными оксидами и гидроксидами. Энергично поглощает из воздуха влагу и углекислый газ. Вступает в реакции взаимодействия с неметаллами, металлами.
Основным способом получения гидроксида калия является электролиз водного раствора хлорида калия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи катода накапливаются ионы калия и гидроксид-ионы, т.е. получается гидроксид калия; на аноде выделяется хлор.
Источник
Гидрид калия: способы получения и химические свойства
Гидрид калия KH — неорганическое бинарное соединение щелочного металла калия и водорода. Белое кристаллическое вещество. При нагревании разлагается, под избыточным давлением плавится без разложения.
Относительная молекулярная масса Mr = 40,11; относительная плотность для тв. и ж. состояния d = 1,43; tпл ≈ 400º C при избыточном давлении
Способ получения
Гидрид калия получают реакцией взаимодействия калия и водорода при 200–350º C:
2K + H2 = 2KH
Химические свойства
1. Гидрид калия — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. При взаимодействии с кислородом при температуре выше 200º C гидрид калия образует гидроксид калия:
2KH + O2 = 2KOH
1.2. При температуре 400–450º C г идрид калия взаимодействует с хлором, образуя хлорид калия и хлороводород:
KH + Cl2 = KCl + HCl
2. Гидрид калия взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид калия образует гидроксид калия и газ водород:
KH + H2O = KOH + H2↑
2.2. С разбавленной хлороводородной кислотой гидрид калия реагирует с образованием хлорида калия и газа водорода:
KH + HCl = KCl + H2↑
2.3. Гидрид калия реагирует с газом аммиаком при t = 300º C с образованием нитрида калия и водорода:
3. Гидрид калия разлагается при температуре 400º C и вакууме, с образованием калия и водорода:
Источник
Гидроксид калия: способы получения и химические свойства
Гидроксид калия KOH — неорганическое соединение. Белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 56,11; относительная плотность для тв. и ж. состояния d = 2, 044; tпл = 404º C; tкип = 1324º C
Способы получения
1. Гидроксид калия получают электролизом раствора хлорида калия :
2KCl + 2H2O → 2KOH + H2 + Cl2
2. При взаимодействии калия, оксида калия, гидрида калия и пероксида калия с водой также образуется гидроксид калия:
2K + 2H2O → 2KOH + H2
2KH + 2H2O → 2KOH + H2
3. Карбонат калия при взаимодействии с гидроксидом кальция образует гидроксид калия:
Качественная реакция
Качественная реакция на гидроксид калия — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид калия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид калия реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид калия реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид калия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид калия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и выделяется водород:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида калия:
Сера взаимодействует с гидроксидом калия только при нагревании:
6. Гидроксид калия взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2KOH + 2Al + 6Н2О = 2K[Al(OH)4] + 3Н2
7. Гидроксид калия вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом калия с образованием хлорида калия и осадка гидроксида меди (II):
2KOH + CuCl2 = Cu(OH)2↓+ 2KCl
Также с гидроксидом калия взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида калия образуются хлорид калия, аммиак и вода:
NH4Cl + KOH = NH3 + H2O + KCl
8. Гидроксид калия проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
KOH ↔ K + + OH —
9. Гидроксид калия в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4KOH → 4K + O2 + 2H2O
Источник
Свойства калия и его взаимодействие с водой
Почему его нельзя хранить на открытом воздухе
Калий — девятнадцатый элемент периодической таблицы Менделеева, относится к щелочным металлам. Это простое вещество, которое при нормальных условиях пребывает в твердом агрегатном состоянии. Закипает калий при температуре 761 °С. Температура плавления элемента — 63 °С. Калий имеет серебристо-белую окраску с металлическим блеском.
Химические свойства калия
Калий — элемент, обладающий высокой химической активностью, поэтому его нельзя хранить на открытом воздухе: щелочной металл моментально вступает в реакцию с окружающими веществами. Этот химический элемент относится к I группе и IV периоду таблицы Менделеева. Калий обладает всеми характерными для металлов свойствами.
Он взаимодействует с простыми веществами, к которым относятся галогены (бром, хлор, фтор, иод) и фосфор, сера, азот и кислород. Взаимодействие калия с кислородом называется окислением. В течение этой химической реакции кислород и калий расходуются в молярном соотношении 4:1, в результате чего образуется оксид калия в количестве двух частей. Такое взаимодействие можно выразить уравнением реакции:
Во время горения калия наблюдается пламя ярко-фиолетового цвета.
Такое взаимодействие считается качественной реакцией на определение калия. Реакции калия с галогенами называются в соответствии с названиями химических элементов: это фторирование, иодирование, бромирование, хлорирование. Такие взаимодействия являются реакциями присоединения. Пример — реакция между калием и хлором, в результате которой образуется хлорид калия. Для проведения такого взаимодействия берут два моля калия и один моль хлора. В результате образуется два моля калия:
При горении на открытом воздухе калий и азот расходуются в молярном соотношении 6:1. В результате такого взаимодействия образуется нитрид калия в количестве двух частей:
Соединение представляет собой кристаллы зелено-черного цвета. С фосфором калий реагирует по такому же принципу. Если взять 3 моля калия и 1 моль фосфора, получится 1 моль фосфида:
Калий реагирует с водородом, образуя гидрид:
Все реакции присоединения происходят при высоких температурах
Взаимодействие калия со сложными веществами
К сложным веществам, с которыми вступает в реакцию калий, относятся вода, соли, кислоты и оксиды. Так как калий — активный металл, он вытесняет атомы водорода из их соединений. Пример — реакция, происходящая между калием и соляной кислотой. Для ее проведения берется по 2 моля калия и кислоты. В результате реакции образуется 2 моля хлорида калия и 1 моль водорода:
2К + 2НСІ = 2КСІ + Н₂
Более детально стоит рассмотреть процесс взаимодействия калия с водой. Калий бурно взаимодействует с водой. Он движется по поверхности воды, его подталкивает выделяющийся водород:
2K + 2H₂O = 2KOH + H₂↑
В ходе реакции в единицу времени выделяется много тепла, что приводит к воспламенению калия и выделяющегося водорода. Это очень интересный процесс: при контакте с водой калий мгновенно воспламеняется, фиолетовое пламя потрескивает и быстро передвигается по поверхности воды. В конце реакции происходит вспышка с разбрызгиванием капель горящего калия и продуктов реакции.
Основной конечный продукт реакции калия с водой — гидроксид калия (щелочь). Уравнение реакции калия с водой:
4K + 2H₂O + O₂ = 4KOH
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
При неправильном проведении эксперимента можно получить ожог щелочью. Для реакции обычно используют кристаллизатор с водой, в который помещают кусочек калия. Как только водород прекращает горение, многие хотят заглянуть в кристаллизатор. В этот момент происходит завершающая стадия реакции калия с водой, сопровождающаяся слабым взрывом и разбрызгиванием образовавшейся горячей щелочи. Поэтому в целях безопасности стоит держаться на некотором расстоянии от лабораторного стола, пока реакция не завершится полностью. Здесь вы найдете самые зрелищные опыты, которые можно проводить с детьми дома.
Строение калия
Атом калия состоит из ядра, в котором содержатся протоны и нейтроны, и электронов, вращающихся вокруг него. Количество электронов всегда равно количеству протонов, находящихся внутри ядра. При отсоединении электрона или при присоединении к атому он перестает быть нейтральным и превращается в ион. Ионы делятся на катионы и анионы. Катионы обладают положительным зарядом, анионы — отрицательным. При присоединении к атому электрона он превращается в анион; если же один из электронов покидает свою орбиту, нейтральный атом превращается в катион.
Порядковый номер калия в периодической таблице Менделеева — 19. Значит, протонов в ядре химического элемента находится тоже 19. Вывод: электронов вокруг ядра расположено 19. Количество протонов в структуре атома определяется так: от атомной массы отнять порядковый номер химического элемента. Вывод: в ядре калия находится 20 протонов. Калий принадлежит к IV периоду, имеет 4 «орбиты», на которых равномерно располагаются электроны, пребывающие в постоянном движении. На первой «орбите» расположены 2 электрона, на второй — 8; на третьей и на последней, четвертой «орбите», вращается 1 электрон. Этим объясняется высокий уровень химической активности калия: его последняя «орбита» не заполнена полностью, поэтому элемент стремится соединиться с другими атомами. В результате электроны последних орбит двух элементов станут общими.
Источник
Гидроксид калия, характеристика, свойства и получение, химические реакции
Гидроксид калия, характеристика, свойства и получение, химические реакции.
Гидроксид калия – неорганическое вещество, имеет химическую формулу KOH.
Краткая характеристика гидроксида калия:
Гидроксид калия – неорганическое вещество белого цвета.
Химическая формула гидроксида калия KOН.
Обладает высокой гигроскопичностью, но меньшей чем у гидроксида натрия . Активно поглощает пары воды из воздуха .
Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии.
Гидроксид калия – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Физические свойства гидроксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | KOН |
| Синонимы и названия иностранном языке | potassium hydroxide (англ.) |
калия гидроокись (рус.)
Получение гидроксида калия:
Гидроксид калия в промышленном масштабе получается в результате электролиза хлористого калия с твердым асбестовым катодом (диафрагменный метод производства), с полимерным катодом ( мембранный метод производства), с жидким ртутным катодом (ртутный метод производства).
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза.
Химические свойства гидроксида калия. Химические реакции гидроксида калия:
Гидроксид калия – химически активное вещество, сильное химическое основание.
Водные растворы KOH имеют сильную щелочную реакцию.
Химические свойства гидроксида калия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида калия с натрием:
KOH + Na → NaOH + K (t = 380-450 °C).
В результате реакции образуются гидроксид натрия и калий.
2. реакция гидроксида калия с хлором:
В результате реакции образуются хлорид калия, гипохлорит калия и вода. При этом гидроксид калия в качестве исходного вещества используется в виде холодного концентрированного раствора.
3. реакция гидроксида калия с йодом:
В результате реакции образуются йодид калия, иодат калия и вода. При этом гидроксид калия в качестве исходного вещества используется в виде горячего концентрированного раствора.
4. реакция гидроксида калия с алюминием и водой:
В результате реакции образуются тетрагидроксоалюминат калия и водород . При этом гидроксид калия в качестве исходного вещества используется в виде горячего концентрированного раствора.
5. реакция гидроксида калия с цинком и водой:
В результате реакции образуются тетрагидроксоцинкат натрия и водород .
6. реакция гидроксида калия с ортофосфорной кислотой:
В результате реакции образуются дигидроортофосфат калия и вода . При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид калия в виде разбавленного раствора.
Аналогично проходят реакции гидроксида калия и с другими кислотами.
7. реакция гидроксида калия с сероводородом:
В результате реакции образуются гидросульфид калия и вода. При этом гидроксид калия в качестве исходного вещества используется в виде разбавленного раствора.
8. реакция гидроксида калия с фтороводородом:
HF + KOH → KF + H2O,
В результате реакции образуются в первом случае – фторид калия и вода, во втором – гидрофторид калия и вода. При этом гидроксид калия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае гидроксид калия и фтороводород используются в виде в виде концентрированного раствора.
9. реакция гидроксида калия с бромоводородом:
HBr + KOH → KBr + H2O.
В результате реакции образуются бромид калия и вода.
10. реакция гидроксида калия с йодоводородом:
HI + KOH → KI + H2O.
В результате реакции образуются йодид калия и вода.
11. реакция гидроксида калия с оксидом алюминия:
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат калия и вода. Реакция протекает при спекании исходных веществ.
12. реакция гидроксида калия с оксидом алюминия и водой:
Оксид алюминия является амфотерным оксидом. В результате реакции образуется тетрагидроксоалюминат калия. При этом гидроксид калия в качестве исходного вещества используется в виде горячего концентрированного раствора.
13. реакция гидроксида калия с оксидом углерода ( углекислым газом ):
Оксид углерода является кислотным оксидом. В результате реакции образуются в первом случае – гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция в первом случае происходит в этаноле.
14. реакция гидроксида калия с оксидом серы:
Оксид серы является кислотным оксидом. В результате реакции образуются в первом случае – гидросульфит калия, во втором случае – сульфит калия и вода. Реакция в первом случае происходит в этаноле.
15. реакция гидроксида калия с оксидом кремния:
В результате реакции образуются в первом случае – метасиликат калия, метатетрасиликат калия и вода, вот втором случае – ортосиликат калия, тетрасиликат калия и вода. При этом гидроксид калия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
16. реакция гидроксида калия с гидроксидом алюминия:
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат калия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид калия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
17. реакция гидроксида калия с гидроксидом цинка:
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат калия.
18. реакция гидроксида калия с сульфатом железа:
В результате реакции образуются гидроксид железа и сульфат калия.
19. реакция гидроксида калия с хлоридом меди:
В результате реакции образуются гидроксид меди и хлорид калия.
20. реакция гидроксида калия с хлоридом алюминия:
В результате реакции образуются гидроксид алюминия и хлорид калия.
Аналогично проходят реакции гидроксида калия и с другими солями.
Применение и использование гидроксида калия:
Гидроксид калия используется во множестве отраслей промышленности и для бытовых нужд:
– в целлюлозно-бумажной промышленности – в производстве бумаги , картона, искусственных волокон , древесно-волоконных плит;
– для омыления жиров при производстве мыла, шампуня и других моющих средств;
– в химической и нефтехимической отраслях промышленности – как универсальное химическое соединение;
– для изготовления биодизельного топлива – получаемого из растительных масел и используемого для замены обычного дизельного топлива ;
– в пищевой промышленности: для мытья и очистки фруктов и овощей от кожицы, в качестве регулятора кислотности. Зарегистрирован в качестве пищевой добавки E-525;
– в щелочных (алкалиновых) батарейках – в качестве электролита;
Примечание: © Фото //www.pexels.com, //pixabay.com

гидроксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида калия
реакции с оксидом натрия
Источник