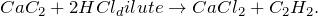- Карбид кальция соляная кислота вода
- Карбид кальция соляная кислота вода
- CaC2 + HCl = ? уравнение реакции
- Подготовка к ЕГЭ по химии. Примеры решения задач.
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Современные образовательные технологии в преподавании химии с учетом ФГОС
- Оставьте свой комментарий
- Подарочные сертификаты
Карбид кальция соляная кислота вода
К 100 мл 5%-ного раствора соляной кислоты (плотностью 1,02 г/мл) добавили 6,4 г карбида кальция. Сколько миллилитров 15%-ной азотной кислоты (плотностью 1,08 г/мл) следует добавить к полученной смеси для её полной нейтрализации?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Запишем уравнения реакций:
Рассчитаем количество веществ реагентов и сделаем вывод об избытке карбида кальция:
— в избытке
Рассчитаем количество веществ гидроксида кальция и азотной кислоты, вступивших в реакцию друг с другом:
Источник
Карбид кальция соляная кислота вода
К 100 мл 5%-ного раствора соляной кислоты (плотностью 1,02 г/мл) добавили 6,4 г карбида кальция. Сколько миллилитров 15%-ной азотной кислоты (плотностью 1,08 г/мл) следует добавить к полученной смеси для её полной нейтрализации?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Запишем уравнения реакций:
Рассчитаем количество веществ реагентов и сделаем вывод об избытке карбида кальция:
— в избытке
Рассчитаем количество веществ гидроксида кальция и азотной кислоты, вступивших в реакцию друг с другом:
Вычислим объём раствора азотной кислоты:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущены ошибки в двух из названных выше элементов | 2 |
| В ответе допущены ошибки в трёх из названных выше элементов | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
CaC2 не может быть в избытке. 0.1 моль меньше, чем 0.14.
Евгений, избыток определяется не просто бОльшим количеством вещества,
а количеством вещества бОльшим ЧЕМ НУЖНО.
На 0,14 моль HCl нужно 0,07 моль карбида, а его дано БОЛЬШЕ чем нужно, значит карбид кальция в ИЗБЫТКЕ
Зачем вы к карбиду кальция добавляете воду?
Это не мы. Честное слово. Это по условию задачи дан РАСТВОР соляной кислоты.
Задача решается без участия уравнения с водой. 0,03 моль карбида осталось, которые нейтрализуются 23 мл. азотной кислоты. Зачем нужна реакция карбида с водой, если она никак не влияет на расчеты?
По условию азотная кислота реагировала со щелочью, а не с карбидом.
Рассчитав количество моль HCl и CaC2, получается 0,14 моль и 0.1 моль соответственно. Следовательно HCl в избытке по молям, так как 0.14 больше, чем 0.1. Если я не права, то, пожалуйста, объясните почему. Спасибо.
Источник
CaC2 + HCl = ? уравнение реакции
Составьте химическое уравнение по схеме CaC2 + HCl = ? Охарактеризуйте полученное органическое соединение: укажите основные физические и химические свойства, а также способы получения.
В результате взаимодействия карбида кальция с разбавленным раствором соляной кислоты (CaC2 + HCl = ?) происходит образование средней соли – хлорида кальция и выделение газа — ацетилена. Молекулярное уравнение реакции имеет вид:
Записать уравнение реакции в ионном виде в данном случае не предоставляется возможным, поскольку взаимодействие протекает не в растворе, а на границе раздела фаз твердое-жидкое.
Алкинами называются ненасыщенные углеводороды, имеющие в своем составе одну тройную связь. Общая формула алкинов 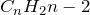
Ацетилен (этин) представляет собой газ без цвета и запаха, обладает слабым наркотическим свойством. В промышленности ацетилен получают из метана путем высокотемпературного крекинга. Сырьем служит природный газ, который в основном состоит из метана. Другим промышленным способом является получение ацетилена из каменного угля.
Источник
Подготовка к ЕГЭ по химии. Примеры решения задач.
В 120 миллилитрах раствора азотной кислоты с массовой долей 7 % и плотностью 1, 03 г/мл внесли 12,8 г карбида кальция. Сколько миллилитров 20 %-ной соляной кислоты с плотностью 1,1 г/мл следует добавить к полученной смеси для её полной нейтрализации?
Найдём массу раствора азотной кислоты, для того, чтобы в дальнейшем найти массу растворенного вещества азотной кислоты:
m р-ра ( HNO 3 ) = 120 мл ∙ 1, 03 г/мл = 123,6 г
Найдём массу растворённого вещества азотной кислоты:

Находим количество вещества карбида кальция и азотной кислоты:
Карбид кальция реагирует не только с азотной кислотой, но и с водой, которая содержится в растворе азотной кислоты. Необходимо определить какое количество вещества карбида кальция идёт на реакцию с азотной кислотой и какое количество вещества карбида кальция идёт на реакцию с водой. Записываем уравнение реакции взаимодействия азотной кислоты с карбидом кальция:
0,14 моль 0,2 моль
Находим избыток и недостаток:

Определим какое количество вещества карбида кальция идёт на реакцию с азотной кислотой:
Найдём массу карбида кальция:
m ( CaC 2 )=0,07моль ∙ 64 г/моль = 4,48 г
Определим массу карбида кальция, которая идёт на реакцию с водой:
m (СаС 2 )=12,8г – 4,48г = 8,32 г
Определим количество вещества карбида кальция:
Записываем уравнение реакции взаимодействия карбида кальция с водой:
0,13 моль х моль
Записывает уравнение реакции взаимодействия гидроксида кальция с соляной кислотой и находим количество вещества соляной кислоты:
0,13 моль х моль
Находим массу соляной кислоты:
m ( HCl )= 0,26 моль∙36,5 г/моль = 9,49 г
Находим массу и объём раствора соляной кислоты:
Ответ: для полной нейтрализации полученной смеси необходимо добавить 43,1 мл 20%-ной соляной кислоты.
При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе продукта выделился бром. Какой объём (н.у.) пропена может провзаимодействовать с полученным количеством брома?
Находим количество вещества диоксида марганца и бромида калия:
Записываем уравнение реакции взаимодействия диоксида марганца с бромидом калия в сернокислой среде:
Находим избыток и недостаток:
0,2 моль 0,48 моль х моль
1 моль 2 моль 1 моль

Находим количество брома по недостатку:
Находим массу брома:
Находим 77%-ный выход брома:
Записываем уравнение реакции взаимодействия брома с пропеном:
Находим объём пропена (н.у.):
Ответ: 3,45 л пропена (н.у.)может провзаимодействовать с полученным количеством брома.
В раствор, содержащий 51 г нитрата серебра, прилили 18,25 г 20%-ного раствора соляной кислоты. какая масса 26%-ного раствора хлорида натрия потребуется для полного осаждения серебра из получившегося раствора?
Находим массу растворенного вещества соляной кислоты:
Находим количество вещества нитрата серебра и соляной кислоты:
Записываем уравнение реакции взаимодействия нитрата серебра с соляной кислотой:
Находим избыток и недостаток:

0,1 моль нитрата серебра взаимодействует с 0,1 моль соляной кислоты.
Теперь находим количество вещества нитрата серебра которое реагирует с хлоридом натрия:
Записываем уравнение реакции взаимодействия нитрата серебра с хлоридом натрия:
Находим количество вещества хлорида натрия:
Находим массу хлорида натрия:
Находим массу 26%-ного расвора хлорида натрия:
Ответ: для полного осаждения серебра из получившегося раствора потребуется 45 г 26%-ного хлорида натрия.
Сероводород объёмом 5,6 л (н.у.) прореагировал без остатка с 59,02 мл раствора гидроксида калия с массовой долей 20 % (плотность 1,186г/мл). Определите массу соли, полученной в результате этой химической реакции.
Находим массу раствора гидроксида калия:
Находим массу раствореннного вещества гидроксида калия:
Находим количество вещества сероводорода и гидроксида калия:
Записываем уравнение реакции взаимодействия сероводорода с гидроксидом калия:
Находим избыток и недостаток:
х = 0,5 моль, т.е. КОН взято в недостатке, а в условии задачи сказано, что сероводород прореагировал с гидроксидом калия без остатка. Это значит, что реакция идёт 1:1, т.е. образуется не сульфид калия, а – гидросульфид калия.
Записываем уравнение реакции взаимодействия сероводорода с гидроксидом калия, в результате которой образуется кислая соль:
Находим количество вещества гидросульфида калия:
1 моль 1 моль 1 моль
Находим массу кислой соли:
Ответ: В результате химиеской реакции образовалось 18 г гидросульфида калия.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Онлайн-конференция для учителей, репетиторов и родителей
Формирование математических способностей у детей с разными образовательными потребностями с помощью ментальной арифметики и других современных методик
Номер материала: ДВ-499522
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Стартовала запись российских школьников на бесплатные курсы по программированию
Время чтения: 2 минуты
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
Каникулы для школьников в Орловской области продлят до 15 ноября
Время чтения: 1 минута
В Чувашии школьные каникулы продлятся две недели
Время чтения: 1 минута
В России объявлены нерабочие дни с 30 октября по 7 ноября
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник