- Карбонат кальция вода уравнение реакции
- CaCO3 -> CaC2 уравнение реакции
- Карбонат кальция — Calcium carbonate
- СОДЕРЖАНИЕ
- Химия
- Подготовка
- Состав
- Вхождение
- Геологические источники
- Биологические источники
- Инопланетянин
- Геология
- Глубина карбонатной компенсации
- Роль в тафономии
- Использует
- Строительство
- Здоровье и диета
- Сельское хозяйство и аквакультура
- Бытовая уборка
- Снижение загрязнения
- Равновесие прокаливания
- Растворимость
- С изменяющимся давлением CO 2
- При изменении pH, температуры и солености: образование накипи CaCO 3 в плавательных бассейнах
- Растворимость в сильном или слабом кислотном растворе
Карбонат кальция вода уравнение реакции
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Карбонат кальция в природе встречается в виде минералов — кальцита, арагонита и витерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц. Получить карбонат кальция можно при пропускании углекислого газа
через избыток раствора гидроксида кальция
. Эту реакцию используют для обнаружения углекислого газа и определении его количественного содержания в воздухе. Нерастворимый в воде карбонат кальция может растворяться в кислотах, например в соляной кислоте
. Карбонат кальция используется как белый пищевой краситель Е170. Являясь основой мела, он используется для письма на школьных досках, используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве. Кроме того, карбонат кальция является важнейшим компонентом продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Источник
CaCO3 -> CaC2 уравнение реакции
Составьте химическое уравнение по схеме CaCO3 -> CaC2. Укажите основные физические и химические свойства карбоната кальция. Приведите способы получения этого вещества.
Карбонат кальция в обычных условиях представляет собой вещество белого цвета, которое при прокаливании разлагается, однако плавится без разложения (условие – избыточное давление 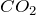
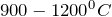
Карбонат кальция практически не растворяется в воде. В водном растворе карбонат кальция подвергается сильному гидролизу по аниону. Наличие гидроксид-анионов свидетельствует о щелочном характере среды:
При взаимодействии карбоната кальция с коксом образуется карбид кальция и выделяется диоксид углерода (CaCO3 -> CaC2). Реакцию проводят при нагревании. Молекулярное уравнение реакции имеет вид:
Карбонат кальция взаимодействует с концентрированными растворами сильных минеральных кислот (1), а также с щелочами в водных растворах (2).
Взаимодействие карбоната кальция с другими солями возможно только если продукт взаимодействия выводится из реакционной среды. При нагревании данная соль разлагается.
Основной способ получения карбоната кальция заключается в смешивании твердого оксида кальция с водой — образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода.
Источник
Карбонат кальция — Calcium carbonate
Карбонат кальция — это химическое соединение с формулой Ca CO 3 . Это обычное вещество, обнаруженное в горных породах в виде минералов кальцит и арагонит (в первую очередь, как известняк , который является типом осадочной породы, состоящей в основном из кальцита), и является основным компонентом яичной скорлупы , раковин улиток , морских ракушек и жемчуга . Карбонат кальция является активным ингредиентом сельскохозяйственной извести и образуется, когда ионы кальция в жесткой воде реагируют с ионами карбоната с образованием известкового налета . Он используется в медицине как добавка кальция или как антацид , но чрезмерное употребление может быть опасным и вызвать гиперкальциемию и проблемы с пищеварением. СОДЕРЖАНИЕХимияКарбонат кальция обладает типичными свойствами других карбонатов . Примечательно это Карбонат кальция реагирует с водой, насыщенной диоксидом углерода, с образованием растворимого бикарбоната кальция . Эта реакция играет важную роль в эрозии из карбонатных пород , образующих каверны , и приводит к жесткой воде во многих регионах. Необычной формой карбоната кальция является гексагидрат, икаит , CaCO 3 · 6H 2 O. Икаит стабилен только при температуре ниже 8 ° C. ПодготовкаПодавляющее большинство карбоната кальция, используемого в промышленности, добывается при добыче полезных ископаемых или в карьерах. Чистый карбонат кальция (например, для пищевых или фармацевтических целей) может быть получен из чистого добытого в карьере источника (обычно мрамора ). В качестве альтернативы карбонат кальция получают из оксида кальция . Для получения гидроксида кальция добавляют воду, затем через этот раствор пропускают диоксид углерода для осаждения желаемого карбоната кальция, называемого в промышленности осажденным карбонатом кальция (ОКК): СоставТермодинамически стабильной формой CaCO 3 при нормальных условиях является гексагональный β-CaCO 3 (минеральный кальцит ). Могут быть получены другие формы, более плотный (2,83 г / см 3 ) ромбический λ-CaCO 3 (минерал арагонит ) и гексагональный μ-CaCO 3 , встречающийся в виде минерала ватерита . Форма арагонита может быть получена осаждением при температуре выше 85 ° C, форма ватерита может быть получена осаждением при 60 ° C. Кальцит содержит атомы кальция, координированные шестью атомами кислорода, в арагоните они координированы девятью атомами кислорода. Структура ватерита до конца не изучена. Карбонат магния (MgCO 3 ) имеет структуру кальцита, тогда как карбонат стронция и карбонат бария (SrCO 3 и BaCO 3 ) принять арагонит структуры, что отражает их большие ионные радиусы . ВхождениеГеологические источникиКальцит , арагонит и фатерит — это чистые минералы карбоната кальция. Промышленно важные нефтематеринские породы, состоящие преимущественно из карбоната кальция, включают известняк , мел , мрамор и травертин . Биологические источникиЯичная скорлупа , раковина улиток и большинство морских раковин преимущественно состоят из карбоната кальция и могут использоваться в качестве промышленных источников этого химического вещества. Раковины устриц были недавно признаны источником диетического кальция, но также являются практическим промышленным источником. Темно- зеленые овощи, такие как брокколи и капуста, содержат значительное количество карбоната кальция с пищей, но их нельзя использовать в качестве промышленного источника. ИнопланетянинЗа пределами Земли убедительные доказательства указывают на присутствие карбоната кальция на Марсе . Признаки карбоната кальция были обнаружены более чем в одном месте (особенно в кратерах Гусева и Гюйгенса ). Это является некоторым свидетельством присутствия жидкой воды в прошлом. ГеологияКарбонат часто встречается в геологических условиях и представляет собой огромный резервуар углерода . Карбонат кальция встречается в виде арагонита , кальцита и доломита как важных составляющих кальциевого цикла . В карбонатных минералов образуют типы пород: известняк , мел , мрамор , травертин , туф и другие. В теплых, прозрачных тропических водах кораллов больше, чем у полюсов, где вода холодная. Вкладчики карбоната кальция, включая планктон (например, кокколиты и планктонные фораминиферы ), коралловые водоросли , губки , брахиоподы , иглокожие , мшанки и моллюски , обычно встречаются на мелководье, где больше солнечного света и фильтруемой пищи. Карбонаты холодной воды существуют в более высоких широтах, но имеют очень медленную скорость роста. В кальцификации процессы изменяются подкисления океана . Там , где океаническая кора является субдуцированным под собой континентальные пластинчатые отложениями будет осуществляться до более теплых зон в астеносферах и литосфере . В этих условиях карбонат кальция разлагается с образованием диоксида углерода, который вместе с другими газами вызывает взрывные извержения вулканов . Глубина карбонатной компенсацииГлубина компенсации карбоната (ПЗС) является точкой в океане , где скорость осаждения карбоната кальция уравновешивается скорость растворения за счет присутствующих условий. Глубоко в океане температура падает, а давление увеличивается. Карбонат кальция необычен тем, что его растворимость увеличивается с понижением температуры. Повышение давления также увеличивает растворимость карбоната кальция. Глубина карбонатной компенсации может составлять от 4000 до 6000 метров ниже уровня моря. Роль в тафономииКарбонат кальция может сохранить окаменелости за счет перминерализации . Большая часть окаменелостей позвоночных формации Ту- Медицина — геологического образования, известного своими яйцами утконосых динозавров — сохраняется благодаря перминерализации CaCO 3 . Этот тип сохранения позволяет сохранить высокий уровень детализации, вплоть до микроскопического уровня. Однако он также оставляет образцы уязвимыми к атмосферным воздействиям при воздействии на поверхность. Когда-то считалось, что популяции трилобитов составляли большую часть водной флоры и фауны во время кембрия из-за того, что их богатые карбонатом кальция раковины сохранялись легче, чем у других видов, которые имели чисто хитиновые раковины. ИспользуетСтроительствоВ основном карбонат кальция используется в строительной промышленности в качестве строительного материала или известнякового заполнителя для дорожного строительства, в качестве ингредиента цемента или в качестве исходного материала для приготовления строительной извести путем обжига в печи . Однако из-за выветривания, вызванного, главным образом, кислотными дождями , карбонат кальция (в форме известняка) больше не используется для строительных целей сам по себе, а только в качестве основного сырья для строительных материалов. Карбонат кальция также используется для очистки железа от железной руды в доменной печи . Карбонат кальцинируется на месте с образованием оксида кальция , который образует шлак с различными примесями и отделяется от очищенного железа. В нефтяной промышленности карбонат кальция добавляется к буровым растворам как средство, перекрывающее пласт и герметизирующее корку; это также утяжелитель, который увеличивает плотность бурового раствора для контроля забойного давления. Карбонат кальция добавляется в плавательные бассейны в качестве корректора pH для поддержания щелочности и компенсации кислотных свойств дезинфицирующего средства. Он также используется в качестве сырья при рафинировании сахара из сахарной свеклы ; его кальцинируют в печи с антрацитом для получения оксида кальция и диоксида углерода. Эту негашеную известь затем гасят пресной водой для получения суспензии гидроксида кальция для осаждения примесей в сыром соке во время карбонизации . Карбонат кальция в форме мела традиционно был основным компонентом мела для школьной доски . Однако современный производимый мел — это в основном гипс , гидратированный сульфат кальция CaSO 4 · 2H 2 O. Карбонат кальция является основным источником для выращивания биорока . Осажденный карбонат кальция (ОКК), предварительно диспергированный в виде суспензии , является обычным наполнителем для латексных перчаток с целью достижения максимальной экономии материалов и производственных затрат. Тонкоизмельченный карбонат кальция (GCC) является важным ингредиентом микропористой пленки, используемой в подгузниках и некоторых строительных пленках, поскольку поры образуются вокруг частиц карбоната кальция во время производства пленки путем двухосного растяжения. GCC и PCC используются в качестве наполнителя в бумаге, потому что они дешевле древесного волокна . С точки зрения объема рынка GCC являются наиболее важными типами наполнителей, используемых в настоящее время. Бумага для печати и письма может содержать 10–20% карбоната кальция. В Северной Америке карбонат кальция начал заменять каолин при производстве глянцевой бумаги . Европа практикует это как щелочная изготовления бумаги или бескислотным изготовление бумаги в течение нескольких десятилетий. PCC, используемый для наполнения бумаги и бумажных покрытий, осаждается и готовится в различных формах и размерах, имеющих характерное узкое распределение размеров частиц и эквивалентные сферические диаметры от 0,4 до 3 микрометров. Карбонат кальция широко используется в качестве наполнителя в красках , в частности в матовой эмульсионной краске, где обычно 30% по весу краски составляет мел или мрамор. Это также популярный наполнитель в пластмассах. Некоторые типичные примеры включают в себя примерно от 15 до 20% загрузки мела в непластифицированного поливинилхлорида (АПВК) водостоков , от 5% до 15% загрузки стеарат покрытого мела или мрамора в АПВК оконного профиля. В кабелях из ПВХ можно использовать карбонат кальция при нагрузках до 70 частей на сто частей смолы для улучшения механических свойств (прочность на разрыв и удлинение) и электрических свойств (объемное удельное сопротивление). Полипропиленовые компаунды часто заполняются карбонатом кальция для увеличения жесткости, что становится важным при высоких температурах использования. Здесь процент часто составляет 20–40%. Он также обычно используется в качестве наполнителя в термореактивных смолах (листовые и объемные формовочные смеси), а также смешивается с ABS и другими ингредиентами для образования некоторых типов прессованных «глиняных» чипов для покера . Осажденный карбонат кальция, полученный путем капания оксида кальция в воду, используется сам по себе или с добавками в качестве белой краски, известной как побелка . Карбонат кальция добавляют в широкий ассортимент торговых и самодельных клеев, герметиков и декоративных наполнителей. Клеи для керамической плитки обычно содержат от 70% до 80% известняка. Заполнители для отделки трещин содержат аналогичный уровень мрамора или доломита. Он также смешивается со шпатлевкой при установке витражей и в качестве резиста, предотвращающего прилипание стекла к полкам печи при обжиге глазури и красок при высокой температуре. В керамической глазури карбонат кальция известен как белил и является обычным ингредиентом многих глазурей в виде белого порошка. Когда глазурь, содержащая этот материал, обжигается в печи, отбеливание действует как флюс в глазури. Молотый карбонат кальция является абразивом (как чистящим порошком, так и ингредиентом бытовых чистящих кремов), в частности, в его форме кальцита, который имеет относительно низкий уровень твердости 3 по шкале Мооса и поэтому не поцарапает стекло и большинство другая керамика , эмаль , бронза , железо и сталь , и оказывают умеренное влияние на более мягкие металлы, такие как алюминий и медь . Пасты , сделанные из карбоната кальция и деионизированная вода может быть использована для очистки потускнения на серебре . Здоровье и диетаКарбонат кальция широко используется в медицине как недорогая пищевая добавка кальция к желудочным антацидам (например, Tums ). Его можно использовать в качестве связывающего фосфата для лечения гиперфосфатемии (в первую очередь у пациентов с хронической почечной недостаточностью ). Он используется в фармацевтической промышленности в качестве инертного наполнителя для таблеток и других фармацевтических препаратов . Карбонат кальция используется в производстве оксида кальция, а также в зубной пасте и получил возрождение в качестве пищевого консерванта и фиксатора цвета при использовании в таких продуктах, как органические яблоки, или с ними. Карбонат кальция используется в терапевтических целях в качестве связывающего фосфата у пациентов, находящихся на поддерживающем гемодиализе . Это наиболее распространенная форма назначаемого фосфатного связывающего вещества, особенно при недиализной хронической болезни почек. Карбонат кальция является наиболее часто используемым связывающим фосфатом, но клиницисты все чаще назначают более дорогие фосфатсвязывающие средства не на основе кальция, особенно севеламер . Избыток кальция из добавок, обогащенной пищи и диеты с высоким содержанием кальция может вызвать молочно-щелочной синдром , который имеет серьезную токсичность и может быть фатальным. В 1915 году Бертрам Сиппи ввел «режим сиппи» — ежечасное употребление молока и сливок и постепенное добавление яиц и вареных злаков в течение 10 дней в сочетании с щелочными порошками, что обеспечивало облегчение симптомов при язвенной болезни. В течение следующих нескольких десятилетий режим Сиппи привел к почечной недостаточности , алкалозу и гиперкальциемии , в основном у мужчин с язвенной болезнью. Эти побочные эффекты были обращены вспять, когда режим был прекращен, но у некоторых пациентов с затяжной рвотой это было фатальным. После появления эффективных методов лечения язвенной болезни молочно-щелочной синдром снизился у мужчин . С 1990-х годов чаще всего сообщалось о женщинах, принимающих добавки кальция сверх рекомендуемого диапазона от 1,2 до 1,5 граммов в день для профилактики и лечения остеопороза, и усугубляется обезвоживанием . Кальций был добавлен в безрецептурные продукты, что способствует непреднамеренному чрезмерному потреблению. Чрезмерное потребление кальция может привести к гиперкальциемии , осложнениями которой являются рвота, боли в животе и изменение психического статуса. В качестве пищевой добавки он обозначается E170 и имеет номер INS 170. Используемый в качестве регулятора кислотности , антислеживающего агента , стабилизатора или красителя, он одобрен для использования в ЕС, США, Австралии и Новой Зеландии . Он «по закону добавляется ко всей измельченной хлебной муке в Великобритании, кроме муки грубого помола». Он используется в некоторых соевом молоке и миндальных молочных продуктах как источник диетического кальция; По крайней мере, одно исследование предполагает, что карбонат кальция может быть столь же биодоступным, как и кальций в коровьем молоке . Карбонат кальция также используется в качестве укрепляющего агента во многих овощных консервах и бутылках. Было документально подтверждено, что несколько составов кальциевых добавок содержат химический элемент свинец , что представляет опасность для здоровья населения . Свинец обычно содержится в природных источниках кальция. Сельское хозяйство и аквакультураСельскохозяйственная известь , измельченный мел или известняк, используется как дешевый метод нейтрализации кислой почвы , что делает ее пригодной для посадки, также используется в аквакультуре для регулирования pH почвы пруда перед началом культивирования. Бытовая уборкаКарбонат кальция является ключевым ингредиентом многих бытовых чистящих порошков, таких как Comet, и используется в качестве чистящего средства. Снижение загрязненияВ 1989 году исследователь Кен Симмонс ввел CaCO 3 в Уэтстон-Брук в Массачусетсе . Он надеялся, что карбонат кальция противодействует кислоте в ручье от кислотного дождя и спасет форель, которая перестала нереститься. Хотя его эксперимент был успешным, он увеличил количество ионов алюминия в области ручья, не обработанной известняком. Это показывает, что CaCO 3 может быть добавлен для нейтрализации воздействия кислотных дождей в речных экосистемах. В настоящее время карбонат кальция используется для нейтрализации кислых условий как в почве, так и в воде. С 1970-х годов такое известкование широко практикуется в Швеции для уменьшения подкисления, и несколько тысяч озер и ручьев подвергаются неоднократному известкованию. Карбонат кальция также используется для десульфуризации дымовых газов, что исключает вредные выбросы SO 2 и NO 2 из угля и других ископаемых видов топлива, сжигаемых на крупных электростанциях, работающих на ископаемом топливе. Равновесие прокаливанияОбжиг из известняка с использованием древесного угля пожаров для получения негашеной практикуется с древности культур во всем мире. Температура, при которой известняк дает оксид кальция, обычно составляет 825 ° C, но указание абсолютного порогового значения вводит в заблуждение. Карбонат кальция находится в равновесии с оксидом кальция и диоксидом углерода при любой температуре. При каждой температуре существует парциальное давление углекислого газа, которое находится в равновесии с карбонатом кальция. При комнатной температуре равновесие в подавляющем большинстве случаев благоприятствует карбонату кальция, потому что равновесное давление CO 2 составляет лишь небольшую часть парциального давления CO 2 в воздухе, которое составляет около 0,035 кПа. При температурах выше 550 ° C равновесное давление CO 2 начинает превышать давление CO 2 в воздухе. Таким образом, при температуре выше 550 ° C карбонат кальция начинает выделять CO 2 в воздух. Однако в печи, работающей на древесном угле, концентрация CO 2 будет намного выше, чем в воздухе. Действительно, если весь кислород в печи расходуется на огонь, то парциальное давление CO 2 в печи может достигать 20 кПа. Таблица показывает, что это парциальное давление не достигается, пока температура не достигнет почти 800 ° C. Чтобы дегазация CO 2 из карбоната кальция происходила с экономически целесообразной скоростью, равновесное давление должно значительно превышать давление CO 2 окружающей среды . А для того, чтобы это произошло быстро, равновесное давление должно превышать общее атмосферное давление в 101 кПа, что происходит при 898 ° C.
РастворимостьС изменяющимся давлением CO 2Карбонат кальция плохо растворяется в чистой воде (47 мг / л при нормальном атмосферном парциальном давлении CO 2, как показано ниже). Равновесие его раствора определяется уравнением (с растворенным карбонатом кальция справа):
где произведение растворимости для [Са 2+ ] [ CO 2-
HCO — Некоторые из HCO —
Часть H 2 CO 3 распадается на воду и растворенный диоксид углерода в соответствии с
А растворенный углекислый газ находится в равновесии с атмосферным углекислым газом согласно
Для окружающего воздуха P CO 2 составляет около 3,5 × 10 -4 атмосферы (или эквивалентно 35 Па ). Последнее уравнение выше фиксирует концентрацию растворенного CO 2 как функцию P CO 2 , независимо от концентрации растворенного CaCO 3 . При атмосферном парциального давления СО 2 , растворенного СО 2 концентрация 1,2 × 10 -5 моль на литр. Уравнение перед этим фиксирует концентрацию H 2 CO 3 как функцию концентрации CO 2 . Для [CO 2 ] = 1,2 × 10 −5 , это дает [H 2 CO 3 ] = 2,0 × 10 -8 моль на литр. Когда [H 2 CO 3 ] известен, оставшиеся три уравнения вместе с
(что верно для всех водных растворов) и тот факт, что раствор должен быть электрически нейтральным, [Ca 2+ ] + 2 [H + ] = [ HCO — позволяют одновременно решать оставшиеся пять неизвестных концентраций (обратите внимание, что приведенная выше форма уравнения нейтральности действительна только в том случае, если карбонат кальция контактировал с чистой водой или с раствором с нейтральным pH; в случае, когда исходная вода pH растворителя не является нейтральным, уравнение модифицировано). В соседней таблице показаны результаты для [Ca 2+ ] и [H + ] (в форме pH) как функции парциального давления CO 2 в окружающей среде ( K sp = Для расчета было взято 4,47 × 10 −9 ).
Эффект последнего особенно заметен в повседневной жизни людей с жесткой водой. Вода в подземных водоносных горизонтах может подвергаться воздействию CO 2, намного превышающему атмосферный. Поскольку такая вода просачивается через породу карбоната кальция, CaCO 3 растворяется в соответствии со второй тенденцией. Когда та же самая вода затем выходит из-под крана, со временем она приходит в равновесие с уровнями CO 2 в воздухе, выделяя излишки CO 2 . В результате карбонат кальция становится менее растворимым, а его избыток осаждается в виде известкового налета. Этот же процесс ответственен за образование сталактитов и сталагмитов в известняковых пещерах. Две гидратированные фазы карбоната кальция, моногидрокальцита CaCO 3 · H 2 O и икаита CaCO 3 · 6H 2 O, могут выпадать в осадок из воды в условиях окружающей среды и сохраняться в виде метастабильных фаз. При изменении pH, температуры и солености: образование накипи CaCO 3 в плавательных бассейнахВ отличие от описанного выше сценария открытого равновесия, многие бассейны управляются путем добавления бикарбоната натрия (NaHCO 3 ) примерно до 2 мМ в качестве буфера, а затем контроля pH с помощью HCl, NaHSO 4 , Na 2 CO 3 , NaOH или составы хлора, которые являются кислыми или основными. В этой ситуации растворенный неорганический углерод ( общий неорганический углерод ) далек от равновесия с атмосферным CO 2 . Движение к равновесию за счет дегазации CO 2 замедляется из-за В этой ситуации константы диссоциации для гораздо более быстрых реакций позволяют прогнозировать концентрации каждого растворенного неорганического углерода в растворе на основе добавленной концентрации HCO — [ Ca 2 + ] Максимум знак равно K s п K а 2 × [ ЧАС + ] [ HCO 3 — ] <\ displaystyle [<\ ce Произведение растворимости CaCO 3 ( K sp ) и константы диссоциации для растворенных неорганических форм углерода (включая K a2 ) в значительной степени зависят от температуры и солености , с общим эффектом, который [Ca 2+ ] max увеличивается от пресной воды к соленой. , и уменьшается с повышением температуры, pH или уровня добавленного бикарбоната, как показано на прилагаемых графиках. Тенденции иллюстративны для управления пулом, но происходит ли масштабирование, также зависит от других факторов, включая взаимодействие с Mg 2+ , B (OH). — Растворимость в сильном или слабом кислотном раствореВ продаже имеются растворы сильной ( HCl ), умеренно сильной ( сульфаминовой ) или слабой ( уксусной , лимонной , сорбиновой , молочной , фосфорной ) кислот. Они обычно используются в качестве средств для удаления накипи для удаления известковых отложений. Максимальное количество CaCO 3, которое может быть «растворено» одним литром кислотного раствора, можно рассчитать, используя приведенные выше уравнения равновесия. Источник | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

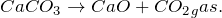
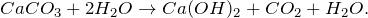
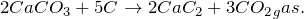
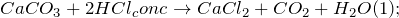
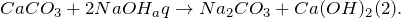


 Y
Y N
N
 N проверить ( что есть ?)
N проверить ( что есть ?) 











