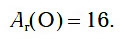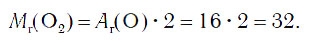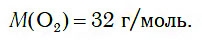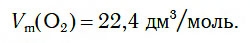Кислород. Озон.
материал по химии (9 класс) по теме
Разработка открытого урока по теме: «Кислород. Озон.» для 9 класса.
Скачать:
| Вложение | Размер |
|---|---|
| kislorod.ozon_.doc | 134.5 КБ |
Предварительный просмотр:
Название работы: Кислород. Озон
Автор : Щедрина Ольга Сергеевна (olga.schedrina1963@ya.ru)
Место работы: Муниципальное общеобразовательное учреждение средняя общеобразовательная школа № 11 Раменского муниципального района (МОУ СОШ № 11)
Предмет: Химия, урок —ознакомление с новым материалом
Тема: Кислород. Озон.
Продолжительность: (1 урока по 45 минут).
Технологии: ИКТ, здоровье сберегающие технологии и групповые.
«Кислород является центром, вокруг которого вращается вся химия.».(Берцелиус)
Изучить и систематизировать знания по теме «Кислород. Озон».
— обучающие: закрепить знания по теме «Строение атома». Скорость химических реакций и их классификация;
показать метапредметные связи
-развивающие: развить познавательный интерес, информационную культуру учащихся, развитие коммуникативных навыков;
-воспитательные: воспитать стремление к саморазвитию, навыков самоорганизации, формировать ответственное отношения к учению, навыки здорового и безопасного образа жизни.
показать взаимосвязь человека с окружающей средой, охрана природы
Тип урока: урок — ознакомление с новым материалом.
Формы работы учащихся: индивидуальная, индивидуально — групповая (в парах).
Необходимое оборудование: мультимедийный проектор, компьютеры, раздаточный материал, прибор для получения и собирания газа, лучинка, спички, KMnO4, Н2О2, MnO2.
Метод обучения: лекция с элементами беседы.
Требования к знаниям, умениям и навыкам: Учащиеся должны знать состав, свойства кислорода и озона, составлять уравнения реакций. Анализировать, делать выводы. Применять полученные знания в повседневной жизни.
- Организационный момент.
- Изучение нового материала.
- Вступительное слово учителя:
Сегодня с вами мы говорим
О том, чем дышим мы,
Но разве можно б было, дети,
Жизнь без него тяжёлой бы была
Вернее, не было её бы никогда.
Да и вода состоит из него,
А без воды на Земле- ничего.
Итак, урок о …(кислороде)
- Путешествие в историю открытия (выступление ученика)
- Положение кислорода в Периодической системе Д.И. Менделеева. Строение атома (самостоятельно). Нуклиды кислорода. Электроотрицательность. Степень окисления.
Кислород в природе представлен 3-мя нуклидами (изотопами ): 16 О, 17 О, 18 О, атомы отличаются по числу содержащихся в них нейтронов: соответственно 8, 9 и 10.
В воде рек, морей и океанов 89% кислорода
Кислород в природе В земной коре кислорода 48%
Это – соли и оксиды
Воздух на 21% (по объёму) состоит из кислорода
Вывод: кислород – самый распространённый элемент на Земле.
Как можно получить кислород. Основываясь на методах Шееле, Пристли и Лавуазье.
Вывод: в лаборатории кислород получаем разложением кислородсодержащих веществ:
а) термическое разложение перманганата калия (марганцовки).
2KMnO 4 t = K 2 MnO 4 + MnO 2 + O 2
б) разложение пероксида водорода (перекиси водорода) в присутствии MnO 2 .
2Н 2 О 2 MnO2 = 2Н 2 О + О 2
Демонстрационный опыт- соблюдение ТБ. Собирание кислорода методом вытеснения воздуха и воды. Доказательство наличия кислорода – по вспыхиванию тлеющей лучины.
Характеристика реакций и условия протекания.
В промышленности – ректификация воздуха.
Почему, несмотря на расходование огромных количеств кислорода, его общее содержание в воздухе заметно не меняется. (дети отвечают – фотосинтез).
6СО 2 + 6Н 2 О = С 6 Н 12 О 6 (глюкоза) + 6О 2
Аллотропия кислорода: кислород и озон.
Аллотропия-явление, когда один и тот же химический элемент образует несколько простых веществ.
Кислород и озон-аллотропные модификации химического элемента кислорода.
6)Получение озона (см. учебник стр.97 рис.27.Озонатор)
7)Физические свойства модификаций кислорода (работа с учебником с.95,99)
- Химические свойства кислорода: в молекуле О 2 химическая связь прочная, при образовании 1 моль О 2 из атомов выделяется 493,57 кДж. Поэтому кислород при обычных условиях сравнительно малоактивен.
Без нагревания с щелочными металлами и щелочно- земельными металлами
4Li + O 2 =2Li 2 O + Q (но Na 2 O 2 , KO 2 (K 2 O 4 ))
При нагревании способность резко возрастает.
При нагревании реагирует с большинством простых веществ, кроме инертных газов и благородных металлов.
S + O 2 = SO 2 + Q
C + O 2 = CO 2 + Q
4Fe + 3O 2 = 2Fe 2 O 3 + Q (реагирует с кислородом воздуха)
2Fe + O 2 = 2FeO + Q (кислород пропускают через расплавленное железо )
Рассмотренные выше реакции – реакции горения, являются экзотермическими, в результате них выделяется свет и тепло.
Каковы условия протекания данной реакции, если кислород, находящийся в атмосфере весь не расходуется?
N 2 + O 2 = 2NO – Q (реакция эндотермическая – с поглощением тепла, протекает в электрическом разряде или при очень высоких температурах).
Вывод: В химических реакциях в большинстве случаев кислород – окислитель.
Следовательно, скорость реакции с участием кислорода зависит:
- От природы реагирующих с кислородом веществ;
- От доступа и концентрации кислорода;
- От температуры.
Озона: озон неустойчив, его молекула легко разлагается
О 3 более сильный окислитель, чем кислород из – за образования атомарного кислорода.
PbS + 4О 3 = PbSO 4 + 4О 2
2КI + O 3 + H 2 O = 2KOH + I 2 + O 2 – качественная реакция на озон (бумажка смоченная раствором КI и крахмала – синеет).
Воздействие озона на организм человека: несколько мкг озона в литре воздуха – раздражение дыхательных путей, головокружение, усталость; несколько млг – смертельно опасно.
- Роль кислорода и озона в природе. Применение. (см.учебник стр.96,99).
- Рефлексия. Лабиринт.
Оценить результаты. 8 шагов-«5»; 6,7-«4»; 4,5-«3»
4.Домашнее задание: п. 22-23 , задание 1,3-5
- И.И. Новошинский, Н.С. Новошинская «Химия 9 класс». Учебник для общеобразовательных учреждений. Москва «ОНИКС 21 век» «Мир и Образование», 2004 год, с.256
- С.С. Бердоносов, Е.А. Менделеева «Особенности содержания и методики преподавания некоторых избранных тем курса химии 8 – 9 классов» Лекции 1-4. Москва Педагогический университет «Первое сентября» 2006 год, с.76
- М.Н. Давыдова, Е.В. Савинкина «Кислород». Сценарии уроков 8 класс. Москва «Чистые пруды» 2006 год, с.32
По теме: методические разработки, презентации и конспекты
Ответить Данная работа содержит план-конспект урока-структуру и ход урока, разработку современного урока химии в 9 классе «Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон.
Урок изучения нового материала, позволяющий конкретизировать знания о кислороде как атоме и молекуле, о физических и химических его свойства , способах собирания газа, способах.
Урок химии в 8 классе. это первый урок по теме «Кислород». Цель: конкретизировать знания учащихся о химическом элементе и простом веществе. Познакомить с историей открытия, физическими сво.
Цель: сформировать представление учащихся об озоне как о аллотропной модификации химического элемента кислорода, его свойствах и роли в природе, повторить тему о кислороде как химическом э.
Конкурсная работа » Открытый урок «Характеристика подгруппы кислорода. Кислород и озон. ".
Методическая разработка предназначена для изучения материала по теме «Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон".
Предлагается методическая разработка урока в рамках ФГОС при изучении подгруппы кислорода.
Источник
Урок 16. Кислород и озон
В уроке 16 «Кислород и озон» из курса «Химия для чайников» мы рассмотрим кислород как химический элемент и как простое вещество; узнаем об истории его открытия; выясним, что такое озон и какими свойствами он обладает.
Исторически так сложилось, что химический элемент и одно из простых веществ, образованных атомами этого элемента, имеют общее название — кислород. Поскольку между этими понятиями существует принципиальная разница, следует четко различать, о чем идет речь — о кислороде как о химическом элементе или о простом веществе.
Кислород как химический элемент
Самым первым химическим элементом, к изучению которого мы приступаем, является кислород. Как вы уже знаете, химический знак кислорода — О. Относительная атомная масса кислорода равна 16:
Позднее вы узнаете, какое строение имеет атом кислорода и чем он отличается от атомов других химических элементов.
Когда говорят о кислороде как о химическом элементе, то подразумевают атомы кислорода. Например: «В состав многих сложных веществ входит кислород», «Массовая доля кислорода в глюкозе равна 53,3 %». В этих примерах речь идет об атомах кислорода (О), которые наряду с атомами других химических элементов входят в состав сложных веществ, следовательно, в данном случае речь идет о кислороде как о химическом элементе.
Кислород как простое вещество
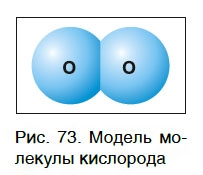
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.
Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
Следовательно, молярная масса кислорода равна:
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
Когда говорят о кислороде как о простом веществе, то подразумевают вещество, имеющее формулу О2. Например: «Железные изделия быстро ржавеют в атмосфере влажного кислорода», «Для горения древесины необходим кислород». В этих примерах речь идет о веществе, имеющем формулу О2.
История открытия кислорода
История открытия самого важного для человека газа была долгой и запутанной. Впервые об открытии кислорода было сообщено в 1774 г. английским химиком Дж. Пристли. Он получил его при нагревании вещества HgO. Однако Дж. Пристли в то время не понял, что он получил новое газообразное вещество, и считал его разновидностью воздуха. Еще раньше в 1772 г. кислород был получен К. Шееле, но сообщение об этом он опубликовал только в 1777 г.
В 1774 г. Дж. Пристли сообщил о своих результатах великому французскому химику А. Лавуазье. Он тут же начал свои опыты и уже в 1775 г. сделал в Академии наук доклад «Мемуар о природе вещества, соединяющегося с металлами при прокаливании и увеличивающего их вес».
Происхождение названия «кислород» связано с образованием кислот в результате растворения в воде некоторых сложных веществ, содержащих атомы этого элемента. А. Лавуазье считал, что кислород — это обязательная составная часть всех кислот, что он «рождает» кислоты. Чтобы подчеркнуть это, А. Лавуазье в 1779 г. назвал этот газ «рождающим кислоты», или сокращенно — кислородом.
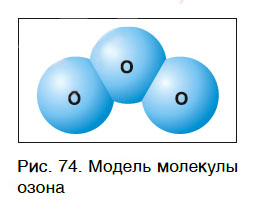
Кроме кислорода, существует еще одно простое вещество, молекулы которого состоят только из атомов кислорода. Это озон, молекула которого содержит три атома кислорода (рис. 74), его формула — О3.
При нормальных условиях озон представляет собой газ с резким раздражающим запахом. Он очень токсичен для всех живых организмов и поэтому используется вместо хлора для обеззараживания воды.
Небольшие количества озона образуются в воздухе во время грозы, а также в результате взаимодействия смолы хвойных деревьев с кислородом. Озон оказывает губительное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает целебным действием.
В небольших количествах озон образуется также при работе копировальных аппаратов и лазерных принтеров. Использовать такие приборы следует только в хорошо проветриваемых помещениях.
В верхних слоях атмосферы Земли (на высоте примерно 30—40 км) существует озоновый слой. Содержащийся в нем озон образуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения губительны для живых организмов и растений на нашей планете, а озоновый слой поглощает их. Если бы не было озонового слоя, то жизнь на Земле постепенно бы прекратилась.
Многие ученые считают, что вещества, образующиеся в процессе производственной деятельности человека, разрушают озоновый слой. Это прежде всего фреоны — соединения, использующиеся в холодильных установках и дезодорантах, выбросы реактивных самолетов и ракет. Попадая в озоновый слой, эти вещества приводят к уменьшению его толщины или даже разрыву этого слоя — образованию так называемых озоновых дыр. В результате образования и увеличения размеров озоновых дыр могут наступить серьезные экологические катастрофы.
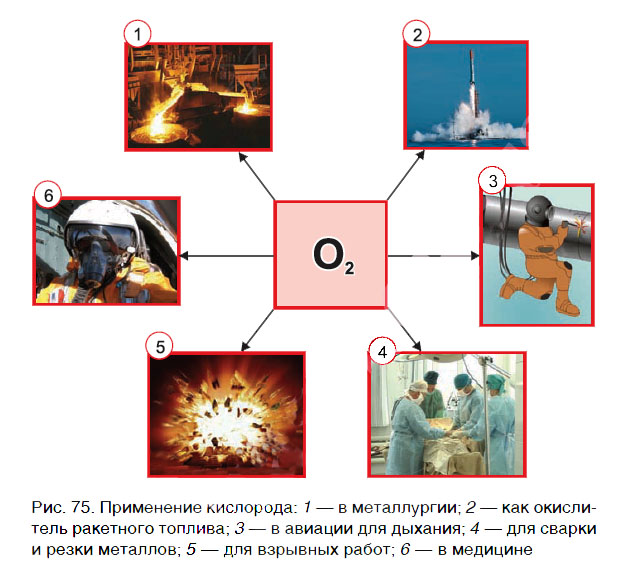
Применение кислорода
Кислород очень широко применяется в народном хозяйстве. На рисунке 75 приведены основные области применения кислорода. Главными потребителями кислорода являются металлургическая промышленность (выплавка стали), космическая техника (окислитель ракетного топлива), процессы обработки металлов (сварка и резка металлов).
Краткие выводы урока:
- Химический элемент кислород образует два простых вещества — кислород О2 и озон О3.
- Когда говорят о кислороде как о химическом элементе, подразумевают атомы кислорода О.
- Когда говорят о кислороде как о простом веществе, подразумевают вещество, состоящее из молекул и имеющее формулу О2.
Надеюсь урок 16 «Кислород и озон» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник