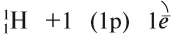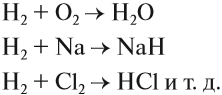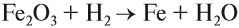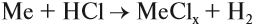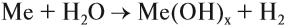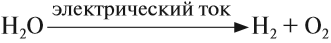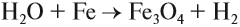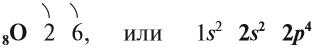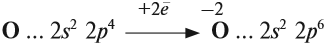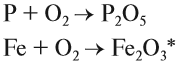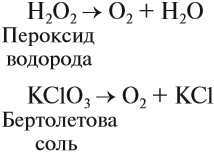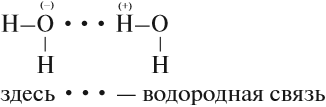Кислород плюс вода что получится
Архив статей > Химия > Совершенно секретно: вода плюс атом кислорода
СОВЕРШЕННО СЕКРЕТНО: ВОДА ПЛЮС АТОМ КИСЛОРОДА
Инженер-капитан II ранга Л. С. ШАПИРО
Химия и Жизнь №1, 1972 г., с. 45-49
Немецкая подводная лодка с парогазотурбинными установками, поднятая англичанами после войны
В 1934 году в Германии появились термины «арийская наука» и «неарийская наука». В том же году из немецкой научно-технической периодики начисто исчезли публикации, так или иначе связанные с очень обыкновенным, давно известным веществом — перекисью водорода. Причины «пропажи» раскрылись лишь после поражения гитлеровского рейха.
ВАЛЬТЕРА ОСЕНЯЕТ ИДЕЯ
В начале тридцатых годов в приморском городе Киле была небольшая фирма, специализировавшаяся на производстве исследовательской аппаратуры и точных инструментов. Руководил ею инженер Гельмут Вальтер — человек способный и предприимчивый. Собственноручно проверяя работу одного из изготовленных фирмой аппаратов, Вальтер обратил внимание на своеобразные свойства высоко-концентрированных растворов перекиси водорода. Он наблюдал, как под действием этих растворов мгновенно воспламенялись многие материалы органического происхождения — бумага, ткани, дерево.
Это в общем-то неудивительно: химики и раньше знали, что перекись водорода — сильный окислитель, именно окислительные свойства этого вещества лежат в основе его традиционных применений — для отбелки тканей и окраски волос. Вполне вероятно, что именно «избытком кислорода» объясняется и бактерицидное действие перекиси. Что же удивляться, если крепкие растворы Н2О2 воспламеняли горючие вещества? Так и должно быть.
Вещества, подожженные перекисью, не удавалось погасить песком. Против таких вспышек были бессильны и обычные огнетушители, содержимое которых, как и песок, лишь прекращает доступ кислорода к поверхности горения и тем самым душит пламя. Вещества, подожженные концентрированными растворами Н2О2, подобно пороху, продолжали гореть и под изолирующим слоем песка или пены. И горели до тех пор, пока не расходовалась вся перекись. Значит, кислород выделяется в процессе горения, рассуждал Вальтер, а раз так, концентрированные растворы перекиси водорода можно использовать там, где ощущается дефицит кислорода, например на подводных лодках.
Для тех, кто в то время конструировал новые подводные суда, главной проблемой была проблема скорости. Даже у лучших лодок скорость движения под водой не превышала 8 узлов, то есть 15 километров в час (1 узел = 1,852 км/час). Да и эту скорость судно могло поддерживать не больше часа — потом нужно было всплывать для подзарядки аккумуляторов. Это ограничивало боевые действия подводников, а сами корабли во время подзарядки батарей могли стать легкой добычей противника. Руководителей германского военно-морского флота, планировавших неограниченную подводную войну, такие подлодки уже не устраивали.
Увеличить подводную скорость и радиус действия подводных лодок можно было, только повысив их энерговооруженность. Но на лодках старой конструкции — с аккумуляторными батареями — примерно четвертая часть общего водоизмещения судна приходилась на долю энергоустановки. Нужны были принципиально новые идеи, чтобы создать новые лодки — быстрые и достаточно «дальнобойные».
Узнать все это Вальтеру не составило большого труда. Киль был форпостом германского подводного кораблестроения. Идея подводного двигателя на перекиси водорода захватила Вальтера. Она привлекала своей новизной, и к тому же инженер Вальтер был далеко не бессребренником. Он отлично понимал, что в условиях фашистской диктатуры кратчайший путь к благоденствию — работа на военные ведомства.
Уже в 1933 году Вальтер самостоятельно предпринял исследование энергетических возможностей растворов Н2O2. Он составил график зависимости основных теплофизических характеристик от концентрации раствора. И вот что выяснил.
Растворы, содержащие 40-65% Н2О2, разлагаясь, заметно нагреваются. Часть воды при этом испаряется. При разложении еще более концентрированных растворов тепла выделяется намного больше: вся вода испаряется без остатка, а продукты разложения — смесь водяных паров и кислорода (ее называют парогазом), перегреваются. И что еще очень важно; каждой концентрации соответствовало строго определенное количество выделяющегося тепла. И строго определенное количество кислорода. Вальтер сумел увидеть абсолютно новую область применения вещества, известного больше ста лет. И изучил это вещество с точки зрения намеченного применения.
Когда свои соображения он довел до высших военных кругов, поступило немедленное распоряжение: засекретить все, что так или иначе связано с перекисью водорода. Отныне в технической документации и переписке фигурировали «аурол», «оксилин», «топливо Т», но не общеизвестная перекись водорода.
КОНСТРУКЦИЯ И НАДЕЖДЫ
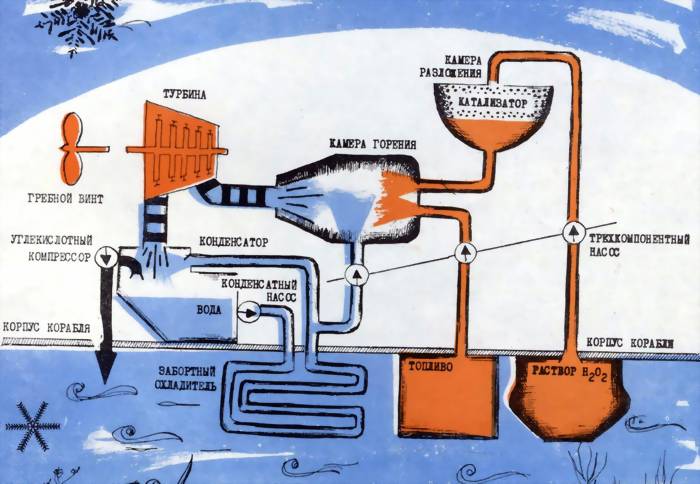
Перекись водорода — продукт нестойкий. Именно это в обычных условиях вредное свойство использовал Вальтер в своих установках. Он не только не стремился как-то стабилизировать растворы, а напротив, искал катализаторы, которые способствовали бы мгновенному разложению Н2О2. Такие катализаторы были подобраны, ими оказались перманганаты натрия и кальция KMnO4 и Са(MnО4)2. Под действием этих веществ реакция Н2О2 = Н2О + O2 шла мгновенно и до конца.
Продукты реакции подавались в турбину, вращали ее, а затем выбрасывались за борт. Так, по «холодному» процессу, работала первая вальтеровская установка. У нее были два очевидных недостатка. Во-первых, кислород слабо растворяется в воде, и лодка с таким двигателем оставляла бы на поверхности пузырьковый след. Во-вторых, выбрасывать за борт неиспользованный кислород, особенно в условиях подводного плавания, было бы непозволительным расточительством. Поэтому логическим продолжением «холодного» процесса стал «горячий».
В продукты разложения подавалось органическое топливо. Сгорая в неиспользовавшемся прежде кислороде, оно поднимало температуру продуктов реакции до 2000°С и выше. В камеру сгорания дополнительно подавали воду, чтобы снизить температуру парогаза до приемлемой для турбин величины (около 500°С). Естественно, мощность двигателя, по сравнению с работавшими по «холодному» процессу, значительно возрастала.
Для подводного флота «горячий» процесс был выгоден еще и потому, что углекислый газ (он теперь занимал место кислорода) значительно лучше растворяется в воде, и лодка теряла «следность».
В 1937 году после успешных стендовых испытаний парогазотурбинных установок (ПГТУ) Вальтеру было позволено выступить с докладом перед высшим командованием немецкого военно-морского флота. На следующий год на одной из судоверфей (все в том же Киле) начали делать опытную подлодку, получившую шифр Ф-80. В 1942 году строительство закончилось. На испытаниях лодка Ф-80 развила скорость 28,1 узла — в 3,5 раза большую, чем у прежних лодок.
Сразу же после испытаний гросс-адмирал Редер сделал доклад в штаб-квартире Гитлера и предложил немедленно начать строительство 24 подводных лодок с ПГТУ. Боевые подводные лодки должны были иметь по две установки общей мощностью в 5000 лошадиных сил. Установки должны были работать по «горячему» процессу на 80%-ном растворе Н2О2. Применить еще более концентрированные растворы не позволяла их температура замерзания: если 80%-ный раствор затвердевает при минус 22° С, то 90%-ный — при минус 9,4° С.)
Строительство подводных лодок с ПГТУ велось в обстановке абсолютной секретности. На корабли допускали строго ограниченный круг лиц по спискам, согласованным в высших инстанциях вермахта. На контрольно-пропускных пунктах стояли жандармы, переодетые в форму пожарных. Параллельно наращивались производственные мощности. Если в 1939 году Германия производила 6800 тонн перекиси водорода (в пересчете на 80%-ный раствор), то в 1944 — уже 24 000 тонн, и строились дополнительные мощности на 90000 тонн в год.
Еще не имея полноценных боевых подводных лодок с ПГТУ, не имея опыта их боевого использования, гросс-адмирал Дениц вещал: «Придет день, когда я объявлю Черчиллю новую подводную войну. Подводный флот не был сломлен ударами 1943 года. Он стал сильнее, чем прежде. 1944 год будет тяжелым годом, но годом, который принесет большие успехи». Деницу вторил государственный радиокомментатор Фриче. Он был еще откровеннее, обещая нации «тотальную подводную войну с участием совершенно новых подводных лодок, против которых противник будет беспомощен».
Однако успехи Советской Армии диктовали совсем иной ход событий.
Исследования Вальтера не прошли мимо ведомства Геринга. Энергетические установки на перекиси водорода в различных модификациях стали применять на самолетах, а позже и на ракетах Фау-1 и Фау-2. Однако, как и подводные лодки с ПГТУ, они не смогли повлиять на ход войны. Всего немцы успели построить 11 таких подводных лодок. В последние дни рейха все они были взорваны или затоплены.
В конце войны командование ВМС США и Англии развернули настоящую охоту за документацией подводных лодок с ПГТУ и за специалистами, принимавшими участие в их постройке и проектировании. Англичане смогли обнаружить и поднять со дна одну из лодок. Корабль был отведен в Англию немецкой командой, которую предупредили о смертной каре в случае каких-либо диверсий. Туда же доставили Вальтера. С его участием в 1954-1958 годах в Анг лии были построены две экспериментальные подводные лодки с ПГТУ — «Эксплорер» и «Экскалибер». Получив на испытаниях «Эксплорера» 25 узлов, англичане оповестили мир, что ими установлен мировой рекорд скорости под водой.
В дальнейшем ПГТУ не получили распространения в подводном кораблестроении. Успехи атомной энергетики позволили более удачно решить проблему мощных подводных двигателей.
В послевоенные годы перекись водорода продолжала и продолжает приносить пользу людям. Кроме традиционных сфер использования (в качестве дезинфицирующего средства и отбеливателя), для нее нашлись совершенно новые области применения.
Способность этого вещества интенсивно выделять кислород при разложении используется в производстве пористых материалов, в частности резин и легкого бетона. Перекись водорода стали применять как катализатор некоторых технологических процессов. Она повышает скорость образования синтетических каучуков из мономеров, выступая здесь одновременно в качестве инициатора и катализатора полимеризации. В производстве электронной аппаратуры перекись используют для протравки поверхности полупроводниковых германиевых пленок.
В последние годы на перекись вновь обращают внимание как на возможный источник энергии. В ФРГ строят глубоководный исследовательский аппарат «Штинт» («Корюшка»), в котором установят некое подобие ПГТУ. Здесь продукты разложения перекиси будут использоваться для вращения турбогенератора, вырабатывающего энергию, и на нужды исследователей.
Возможно, на перекись водорода еще не раз обратят внимание при решении каких-то новых проблем, недаром же среди ученых бытует выражение, что новое — это хорошо забытое старое.
Схема силовой установки подводных лодок с ПГТУ, работающих по «горячему» процессу
ЧТО ВЫ ЗНАЕТЕ И ЧЕГО НЕ ЗНАЕТЕ О ПЕРЕКИСИ ВОДОРОДА
Из всех известных науке соединений перекись водорода — самое богатое кислородом. На долю кислорода приходится почти 95% ее веса. Для науки и практики очень важно, что при разложении Н2О2 первоначально выделяется атомарный кислород, который обладает значительно большей химической активностью, чем окружающий нас кислород воздуха.
ВПЕРВЫЕ НА ПРАКТИКЕ
Первооткрыватель перекиси водорода Луи-Жак Тенар первым же использовал ее на практике. Он собственноручно реставрировал с помощью этого вещества одну из потемневших от времени картин Рафаэля. Тенар же первым предложил использовать перекись водорода в медицине — как наружный раздражитель.
ПЕРЕКИСЬ В ПРИРОДЕ
Знаменитый русский ученый А. Н. Бах обнаружил перекись водорода во всех частях зеленых растений и доказал, что в малых концентрациях она не только не вредит растениям, но и играет важную роль в процессах их дыхания. Перекись водорода образуется и в животных организмах — как один из полупродуктов биохимического окисления. От избытка перекиси живые клетки предохраняет фермент ката-лаза. При нуле градусов одна молекула каталазы способна разложить до 5 миллионов молекул Н2О2.
Ученые Кубанского сельскохозяйственного института исследовали, как влияют растворы перекиси водорода на прорастающие семена риса. Рис, как известно, возделывается на затопленных водой полях. Доступ кислорода к семенам и росткам затруднен, а это сказывается на урожае. Решено было компенсировать нехватку кислорода предварительным выдерживанием семян в растворах перекиси водорода. Опыты дали обнадеживающие результаты. Наклюнулись все семена, выдержанные в 1%-ном растворе Н2О2, в то время как из контрольной группы семян, выдержанных в дистиллированной воде, дали ростки лишь две трети. Замачивание семян в перекиси сказалось и на урожае: прибавка составила в среднем около 8 центнеров с гектара.
Перекись водорода использовали в двигателях подводных лодок и ракет, но еще раньше это вещество было взято на вооружение представителями мира насекомых. Жукбомбардир, подвергшись нападению, выбрасывает в сторону противника струйку перекиси водорода, которая вырабатывается в его организме.
Источник
Урок 12. Водород и кислород
Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
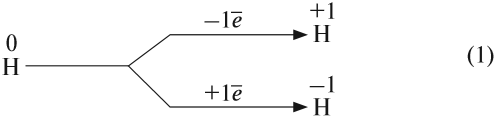
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
Источник