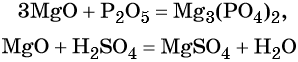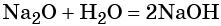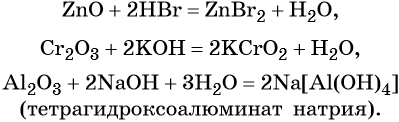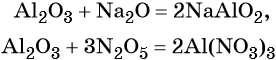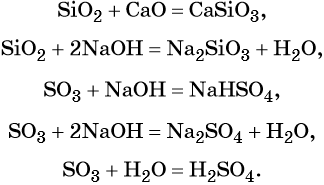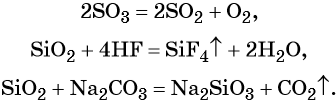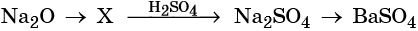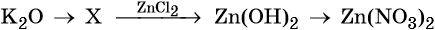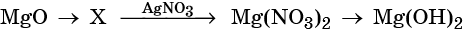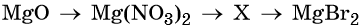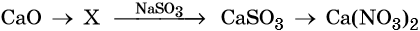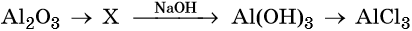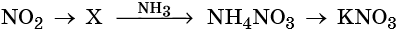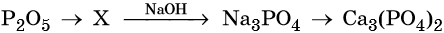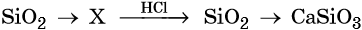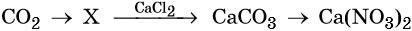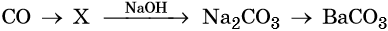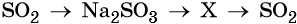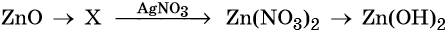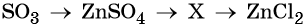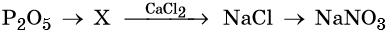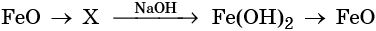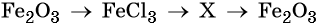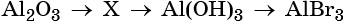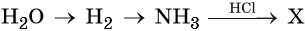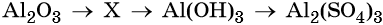Кислотные оксиды — получение и химические свойства
Кислотными называются оксиды, взаимодействующие с основаниями (или основными оксидами) с образованием солей.
Кислотные оксиды представляют собой оксиды неметаллов или переходных металлов в высоких степенях окисления, им соответствуют кислотные гидроксиды, обладающие свойствами кислот.
Например, S +6 O3 → H2S +6 O4; N2 +5 O5 → HN +5 O3, причем степень окисления элемента не изменяется при переходе от оксида к гидроксиду.
Получение кислотных оксидов
1. Окисление кислородом
2. Горение сложных веществ
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот:
2. Наиболее типичными для кислотных оксидов являются их следующие реакции с образованием солей:
| с основными оксидами: | SO3 + Na2O = Na2SO4 |
| с амфотерными оксидами: | P2O5 + Al2O3 = 2AlPO4 |
| со щелочами: | CO2 + 2KOH = K2CO3 + H2O |
3. Кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например,
4. Менее летучие кислотные оксиды вытесняют более летучие кислотные оксиды из их солей (сплавление):
Источник
Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с основными оксидами и основаниями с образованием солей.
При этом действует правило — хотя бы одному из оксидов должен соответствовать сильный гидроксид (кислота или щелочь).
Кислотные оксиды сильных и растворимых кислот взаимодействуют с любыми основными оксидами и основаниями:
Кислотные оксиды нерастворимых в воде и неустойчивых или летучих кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами. При этом возможно образование кислых и основных солей, в зависимости от соотношения и состава реагентов.
Например , оксид натрия взаимодействует с оксидом углерода (IV), а оксид меди (II), которому соответствует нерастворимое основание Cu(OH)2 — практически не взаимодействует с оксидом углерода (IV):
CuO + CO2 ≠
2. Кислотные оксиды взаимодействуют с водой с образованием кислот.
Исключение — оксид кремния, которому соответствует нерастворимая кремниевая кислота. Оксиды, которым соответствуют неустойчивые кислоты, как правило, реагируют с водой обратимо и в очень малой степени.
3. Кислотные оксиды взаимодействуют с амфотерными оксидами и гидроксидами с образованием соли или соли и воды.
Обратите внимание — с амфотерными оксидами и гидроксидами взаимодействуют, как правило, только оксиды сильных или средних кислот!
Например , ангидрид серной кислоты (оксид серы (VI)) взаимодействует с оксидом алюминия и гидроксидом алюминия с образованием соли — сульфата алюминия:
А вот оксид углерода (IV), которому соответствует слабая угольная кислота, с оксидом алюминия и гидроксидом алюминия уже не взаимодействует:
4. Кислотные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например , твердый оксид кремния SiO2 вытеснит более летучий углекислый газ из карбоната кальция при сплавлении:
5. Кислотные оксиды способны проявлять окислительные свойства.
Как правило, оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3 и др.). Сильные окислительные свойства проявляют и некоторые элементы с промежуточной степенью окисления (NO2 и др.).
6. Восстановительные свойства.
Восстановительные свойства, как правило, проявляют оксиды элементов в промежуточной степени окисления (CO, NO, SO2 и др.). При этом они окисляются до высшей или ближайшей устойчивой степени окисления.
Например , оксид серы (IV) окисляется кислородом до оксида серы (VI):
Источник
Химические свойства оксидов: основных, амфотерных, кислотных
Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯ H2O →
В) ZnO + Na2O ⎯⎯ сплавление →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
28. Установите соответствие между реагирующими веществами и продуктами реакций.
29. Установите соответствие между реагирующими веществами и продуктами реакций.
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Источник