Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с основными оксидами и основаниями с образованием солей.
При этом действует правило — хотя бы одному из оксидов должен соответствовать сильный гидроксид (кислота или щелочь).
Кислотные оксиды сильных и растворимых кислот взаимодействуют с любыми основными оксидами и основаниями:
Кислотные оксиды нерастворимых в воде и неустойчивых или летучих кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами. При этом возможно образование кислых и основных солей, в зависимости от соотношения и состава реагентов.
Например , оксид натрия взаимодействует с оксидом углерода (IV), а оксид меди (II), которому соответствует нерастворимое основание Cu(OH)2 — практически не взаимодействует с оксидом углерода (IV):
CuO + CO2 ≠
2. Кислотные оксиды взаимодействуют с водой с образованием кислот.
Исключение — оксид кремния, которому соответствует нерастворимая кремниевая кислота. Оксиды, которым соответствуют неустойчивые кислоты, как правило, реагируют с водой обратимо и в очень малой степени.
3. Кислотные оксиды взаимодействуют с амфотерными оксидами и гидроксидами с образованием соли или соли и воды.
Обратите внимание — с амфотерными оксидами и гидроксидами взаимодействуют, как правило, только оксиды сильных или средних кислот!
Например , ангидрид серной кислоты (оксид серы (VI)) взаимодействует с оксидом алюминия и гидроксидом алюминия с образованием соли — сульфата алюминия:
А вот оксид углерода (IV), которому соответствует слабая угольная кислота, с оксидом алюминия и гидроксидом алюминия уже не взаимодействует:
4. Кислотные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например , твердый оксид кремния SiO2 вытеснит более летучий углекислый газ из карбоната кальция при сплавлении:
5. Кислотные оксиды способны проявлять окислительные свойства.
Как правило, оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3 и др.). Сильные окислительные свойства проявляют и некоторые элементы с промежуточной степенью окисления (NO2 и др.).
6. Восстановительные свойства.
Восстановительные свойства, как правило, проявляют оксиды элементов в промежуточной степени окисления (CO, NO, SO2 и др.). При этом они окисляются до высшей или ближайшей устойчивой степени окисления.
Например , оксид серы (IV) окисляется кислородом до оксида серы (VI):
Источник
ВСЕ КИСЛОТНЫЕ ОКСИДЫ, КРОМЕ SiO2, РЕАГИРУЮТ С ВОДОЙ.
SiO2 + H2O ® реакция не идет, т.к. H2SiO3 нерастворима в воде
б) взаимодействие с основными и амфотерными оксидами (см. пункт 6.в)
г) взаимодействие с основаниями. Правило: кислотные оксиды взаимодействуют со щелочами, при этом образуется соль и вода. Пример:
д) взаимодействие с солями. Правило:
– при нагревании менее летучий оксид вытесняет из соли более летучий оксид.
– в растворе оксид, соответствующий более сильной кислоте, вытесняет из соли оксид, соответствующий более слабой кислоте.
– оксиды могут взаимодействовать с солями, содержащими остаток кислоты, которой этот оксид соответствует:
8). Химические свойства амфотерных оксидов.
а) амфотерные оксиды не реагируют с водой
б) амфотерные оксиды в реакциях с кислотами проявляют основные свойства, т.е. реакции протекают так же, как с основными оксидами
в) взаимодействие со щелочами. В зависимости от условий реакции протекают по-разному:
г) взаимодействие с основными оксидами (см №6г)
д) при взаимодействии с кислотными оксидами амфотерные оксиды проявляют основные свойства.
Пример: Al2O3 + P2O5 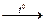
е) При взаимодействии с солями амфотерные оксиды, как нелетучие, вытесняют из солей при нагревании более летучие оксиды.
| оксид | Гидроксид, основная форма | Гидроксид, кислотная форма (при нагревании) | Гидроксид, кислотная форма (в растворе) |
| BeO | Be(OH)2 | H2BeO2 | H2[Be(OH)4] |
| ZnO | Zn(OH)2 | H2ZnO2 | H2[Zn(OH)4] |
| SnO | Sn(OH)2 | H2SnO2 | H2[Sn(OH)4] |
| PbO | Pb(OH)2 | H2PbO2 | H2[Pb(OH)4] |
| Al2O3 | Al(OH)3 | HAlO2 | H[Al(OH)4] |
| Cr2O3 | Cr(OH)3 | HCrO2 | H3[Cr(OH)6] |
| Fe2O3 | Fe(OH)3 | HFeO2 | H3[Fe(OH)6] |
Примечание: кислотная форма амфотерных гидроксидов составлена формально, т.к. в реакциях со щелочами и с основными оксидами могут быть образованы только соли приведенных форм гидроксидов.
9). Зависимость кислотно-основных свойств оксидов от положения элемента в периодической системе и его степени окисления.
Слева направо по периоду по мере ослабления металлических свойств элементов основные свойства оксидов ослабевают, а кислотные возрастают. Сверху вниз по главным подгруппам неметаллические свойства элементов ослабевают, а металлические возрастают, при этом: сверху вниз по главной подгруппе возрастают основные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
Пример: Cr +2 O – основный оксид, Cr2 +3 O3 – амфотерный оксид, Cr +6 O3 – кислотный оксид.
а) кислоты – сложные вещества, состоящие из кислотных остатков и атомов водорода, способных замещаться на атомы металлов
б) кислоты – электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода.
а) по наличию или отсутствию атомов кислорода кислоты делят на бескислородные (H2S, HCl и др.) и кислородосодержащие (H2SO4, HNO3 и др.)
б) по числу атомов водорода, способных замещаться на металлы или по числу ионов H + , образующихся при диссоциации кислоты выделяют кислоты одноосновные (HNO3, HCl), двухосновные (H2S, H2SO4,), трехосновные (H3PO4), четырехосновные (H4P2O7)
в) по способности к диссоциации кислоты разделяют на сильные электролиты (HCl, HNO3, H2SO4 и др.), слабые электролиты (H2S, H2CO3, HF), электролиты средней силы (H3PO4, H2SO3 ).
Нестабильные кислоты разлагаются в момент получения:
III Структурные формулы кислот.
IV Физические свойства кислот. Существуют кислоты твердые (H3PO4, H2SiO3), жидкие кислоты (H2SO4, HNO3)
V Способы получения кислот:
а) бескислородные кислоты получают растворением соответствующего газа в воде
б) кислородосодержащие получают при взаимодействии соответствующего оксида в воде:
в) нерастворимые кислоты получают косвенным путем:
VI Химические свойства кислот.
1). Кислоты реагируют с металлами, стоящими в ряду активности левее водорода; при этом образуется соль и водород. При протекании таких процессов металл растворяется в кислоте (в ходе реакции не должна образовываться нерастворимая соль: H2SO4 + Mg ® MgSO4 + H2
при взаимодействии металлов со слабыми многоосновными кислотами образуются кислые соли:
Кремниевая кислота (H2SiO3) не взаимодействует с металлами (твердое не реагирует с твердым)
Концентрированная серная и азотная кислота любой концентрации реагируют с металлами без выделения водорода (см. ниже)
2). Кислоты реагируют с основными оксидами
Примечание: некоторые реакции требуют нагревания:
MgO + H2SO4 ® MgSO4 + H2O (эта реакция протекает при комнатной температуре)
3). Кислоты реагируют с основаниями.
Примечание: слабые нерастворимые основания не реагируют со слабыми кислотами.
4). Кислоты реагируют с солями при выполнении условий:
а) в ходе реакции выпадает осадок
Примечание:с помощью сероводорода можно осадить из солей в виде сульфидов металлы, стоящие в ряду активности правее железа:
Т.к. сульфиды железа, цинка, магния и т.д. растворимы в разбавленных кислотах, то
FeSO4 + H2S ® реакция не идет
б) в ходе реакции выделяется газ
в) нелетучие кислоты могут вытеснять летучие из их солей:
NaCl(тв.) + H2SO4(конц.)®HCl + NaHSO4 (при слабом нагревании)
5). Растворы кислот изменяют окраску индикаторов:
лакмус и метилоранж – в красный.
Мнемотаблица для запоминания окраски индикаторов в зависимости от реакции среды:
| Кислая | нейтральная | щелочная | |
| Лакмус | 4 Красный | 8 Фиолетовый | 3 Синий |
| Метиловый оранжевый | 6 Красный | 2 Оранжевый | 7 Желтый |
| фенолфталеин | 1 Бесцветный | 9 Бесцветный | 5 Малиновый |
Таблица заполняется только первыми буквами приведенных в них слов (см. ниже). Заполнение происходит следующим образом: а) по горизонтали верхняя строка по алфавиту;
б) по вертикали левая строка также по алфавиту; в) далее из букв по порядку складываем мнемофразу (как «Каждый охотник желает знать…») «Бос и Комкрыжовником играют в футбол» (жирным подчеркнутым шрифтом выделены буквы из таблицы)
Источник
Классификация неорганических веществ
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Амфотерные (греч. ἀμφότεροι — двойственный)
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)
Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь 🙂
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Блиц-опрос по теме Классификация неорганических веществ
Источник















