Ректификация спирта
Ректификация спирта в домашних условиях
Ректификация спирта
Чтобы понять ректификацию спирта рассмотрим основные свойства абсолютного 100%-ного этилового спирта:
— температура кипения = 78,3°C при 760 мм рт.ст.
— плотность жидкости = 790 кг/м3 при 20°С
Известно, что этиловый спирт прекрасно растворяется в воде, образуя бинарную водно-спиртовую смесь с любым количеством спирта. Здесь нужно обозначить разницу между массовой и объёмной концентрацией этанола в водно-спиртовом растворе. Массовая концентрация спирта — это масса спирта в массе раствора (обозначается как г/г или %масс.).
Чаще применяется понятие объёмной концентрации — это объем спирта в объеме смеси (обозначается как мл/мл или %об.). Величины объёмной и массовой концентраций из-за значительной разницы в плотности спирта (0,79 г/мл) и воды (1 г/мл) могут существенно различаться. В дальнейшем здесь будет использоваться только понятием объёмной концентрации.
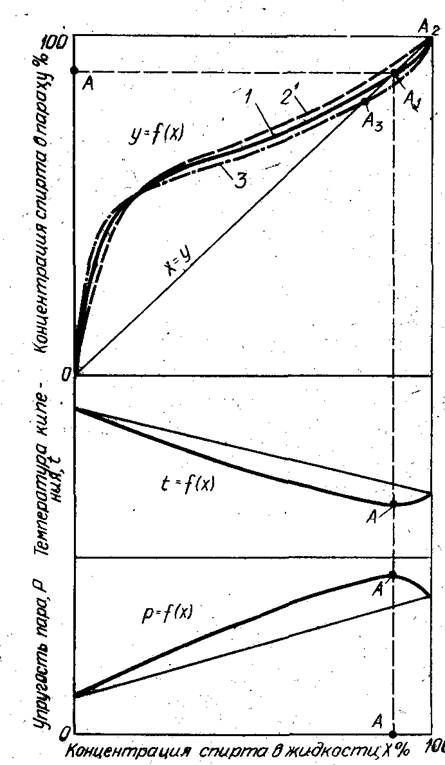
Понятно, что температура кипения раствора двух жидкостей должна находиться между их индивидуальными температурами кипения — 100°C для воды и 78,3°C для этилового спирта (при 760 мм рт. ст.). Зависимость температуры кипения (парообразования) этого раствора, или, что то же самое, температуры насыщенного водно-спиртового пара от концентрации спирта в парах показана на рис. 1.
Особого внимания на этом графике заслуживает точка А с концентрацией 96,4% и с температурой кипения меньше температуры кипения 100%-ного этилового спирта.
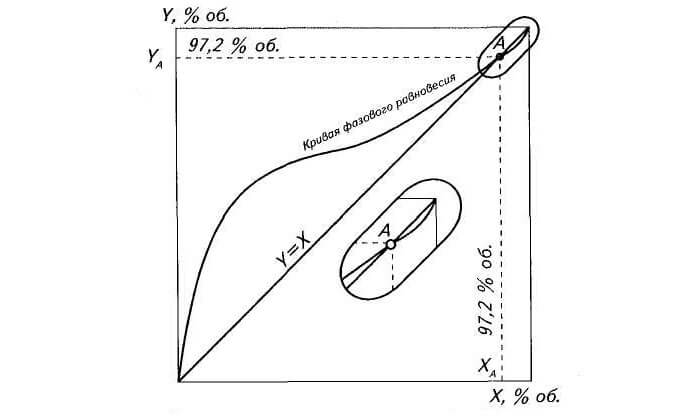
Нагляднее всего процессы дистилляции и ректификации этанола объяснить по кривой равновесия фаз бинарной водно-спиртовой смеси (см. рис. 2).
Из диаграммы видно, что практически вся кривая равновесия находится выше диагонали Y=X, то есть при испарении водно-спиртового раствора концентрация спирта в парах получается большей, чем в исходной жидкости. Именно это и лежит в основе процессов дистилляции и ректификации этанола.
Большое значение имеет точка (А, X=Y=97,2% объёмных) пересечения кривой равновесия фаз с диагональю. Это особая «точка азеотропа» — нераздельно кипящая жидкая смесь двух чистых компонентов, которую путём перегонки или ректификации невозможно разделить на составляющие. Максимально приближенная к точке азеотропа водно-спиртовая смесь и называется спирт-ректификат.
Используя кривую равновесия и диагональ Y=X (см. рис. 2), можно увидеть, что при простой перегонке 10%-ной бражки сначала получается самогон с концентрацией примерно 53%об. Далее, после ступеньки 10-53, можно построить следующие — 53-82, 82-88, 88-92 и т.д. Вертикальная составляющая ступеньки показывает повышение процента этанола в паровой фазе вплоть до наступления равновесия фаз (точка А). Горизонтальная составляющая ступеньки показывает конденсацию этих паров (точка пересечения горизонтали с диагональю Y=X). По диаграмме видно, что для получения спирта-ректификата из бражки с начальной концентрацией 10% теоретически должно пройти более десятка таких последовательных перегонок. На практике их должно быть намного больше, так по мере уменьшения концентрации спирта в перегонном кубе соответственно уменьшается и концентрация дистиллята. Например, на первой ступеньке 53%об. соответствует только начальному моменту перегонки. По прошествии какого-то времени концентрация спирта в бражке уменьшается и мы имеем в ней уже меньше, чем 10% спирта, в результате чего к концу первой перегонки отобранный самогон имеет среднюю крепость не 53%об., а 35-40%об.
Стоит отметить, что температура кипения этанола зависит от атмосферного давления (см. рис. 3). Причём эта зависимость достаточно существенна для процесса ректификации, когда каждая десятая доля градуса имеет значение.
В очень-очень упрощенной постановке, описанные выше «ступеньки» отдельных перегонок, но осуществляемые не по отдельности, а собранные вместе в одном аппарате и составляют процесс ректификации спирта. Такая ректификационная установка имеет еще один дополнительный «плюс» — параллельно с задачей получения спирта-ректификата она решает еще и задачу очистки его от примесей, имеющих отличную от спирта температуру кипения (см. схему на форуме Чертежи и схемы самогонных аппаратов
Выходя за рамки нашей цели — получение спирта с помощью ректификационной колонны, можно выделить в чистом виде любое вещество (это будет не сложно, если вы знаете температуру его кипения). Например, перегоняя настой сосновых иголок, можно попробовать выделить составляющую, заведующую запахом хвои, или из настоя лепестков фиалки выделить вещество, отвечающее за этот цветочный запах. От самогонщика до парфюмера один шаг
Источник
Теория фазового состояния водно-спиртовой смеси: температура, давление, концентрация
А никто не помнит где исходные данные лежат с которых Руди свой калькулятор ваял. Kotische, 14 Нояб. 16, 14:25
Посл. ред. 14 Нояб. 16, 21:32 от Чапаев1945
примерно такие же уравнения для расчета у Стабникова в приложенной книге.. Чапаев1945, 14 Нояб. 16, 19:42
Осталась самая малость: загнать уравнения в эксел. И я обязуюсь получить фактуру цифр, которые мы сгрузим в этот самый эксел, и проверим сходимость теории прошлого с практикой домашнего винокурения нынешнего веков!
Посл. ред. 14 Нояб. 16, 21:41 от игорь223
Таблицу или функцию соответствия четрыех параметров.
Когда три известны, а четвертый вычисляется игорь223, 14 Нояб. 16, 11:44
Осталась самая малость: загнать уравнения в эксел. И я обязуюсь получить фактуру цифр, которые мы сгрузим в этот самый эксел, и проверим сходимость теории прошлого с практикой домашнего винокурения нынешнего веков! игорь223, 14 Нояб. 16, 21:40
Загнать в эксел можно любое уравнение (ну почти) но где брать переменные для этого уравнения? То что ты получишь экспериментально боюсь нам не поможет.
Вот на скрине уравнение. Я даже не уверен, что есть Д у них. Давление при заданных параметрах молярных объемов спирта и воды? Далее что входит в уравнение — лямбды даны вроде по тексту, а J1 и J2 люто считаются по другим уравнениям. Они собирают какие то эксперементальные значения и оценивают их согласно уравнению? А что за значения? Нифига понять не получается))))
Короче, я не против составить что то в экселе, но я должен понимать ЧТО я делаю, а я эти уравнения не понимаю до конца. Они такое ощущение привели только верхушку айсберга своих расчетов, а по этим крохам воспроизвести их расчет не могу даже просто умозрительно. Уравнения в книге Стабникова тоже не сахар. Без примеров ничего не понимаю. Может кто то понимает, тогда поделитесь мыслью. Сплошь и рядом приводят только итоговые выкладки, а промежуточные расчеты не показывают))) А без них.
Можно обратится к Крелю где он показывал как высчитывать нужное нам экспериментально. Крель «Руководство по ректификации. Там где то со станицы 64 очень интересная для нас информация. Нужно почитать внимательно. Читаю.
Появятся мысли как посчитать искомое напишу. Если ответ и есть, то он у Креля. Стабников и Цыганков для меня закручены ядрено)))
Добавлено через 5мин.:
Осилишь? игорь223, 14 Нояб. 16, 21:40
Попробую найти путь.
Добавлено через 13мин.:
Вот интересный способ по эталонному веществу. Можно посчитать и посмотреть какая погрешность будет. Вроде все на первый взгляд решаемо. Скан Уравнение_Крель.
Или еще способ по уравнению Антуана. См. скан.
Добавлено через 1мин.:
Нужно попробовать посчитать заведомо известное значение и сравнить. Но это завтра а сейчас я спать))))
Посл. ред. 14 Нояб. 16, 23:05 от Чапаев1945
Источник
ФАЗОВОЕ РАВНОВЕСИЕ В СИСТЕМЕ ЭТАНОЛ — ВОДА



ПОЛУЧЕНИЕ СПИРТА-СЫРЦА
Летучесть отдельных компонентов смеси характеризуют коэффициентом испарения (К= Y/X) —отношением концентрации данного вещества в паровой фазе Y к концентрации его в жидкой фазе X при равновесном состоянии фаз.
Летучая часть бражки состоит в основном, из воды и этилового спирта, поэтому в процессе выделения спирта бражку рассматривают как бинарную смесь этилового спирта и воды. Зависимость между составом паровой и жидкой фазы летучих веществ определяется законами Д. П. Коновалова и М. С. Вревского.
В верхней части рис. 1 линия 1 изображает зависимость равновесного состава пара У от состава жидкости X при атмосферном давлении и температуре кипения для смеси этиловый спирт — вода. Она представляет собой геометрическое место точек значений коэффициентов испарения этилового спирта Kэ.c = Y/X из водно-спиртовой смеси. При малых концентрациях спирта в смеси значения Kэ.c максимальны (около 13), при больших — минимальны (около 1).
Линия равновесного состава в точке А пересекает диагональ, следовательно, в этой точке состав паровой и жидкой фазы одинаковый. Эта точка получила название азеотропной точки, или точки нераздельного кипения. Для нее Y=X, или Kэ.c = 1. При нормальном давлении нераздельнокипящая смесь системы этиловый спирт — вода содержит 97,2 об.% (95,57 мас.%) этилового спирта при температуре кипения 78,15°С; при том же давлении температура кипения этилового спирта равна 78,3°С, а воды 100°С.
Рис. 1 Зависимость равновесного содержания пара. Температуры кипения и упругости пара от концентрации водно-спиртового раствора при давлении:
1 – атмосферное; 2 – ниже атмосферного; 3 – выше атмосферного.
В соответствии с законом Вревского при повышении давления растворы с низкой концентрацией спирта, примерно до 30— 40 мас.%, образуют пары с большим содержанием спирта, а растворы с высокой концентрацией спирта — пары с меньшим содержанием спирта, что наглядно показано в верхней части рис. 1 пунктирной линией. Из рисунка также видно, что с изменением давления сдвигается и положение азеотропной точки. Так, при давлении 93 кПа (температура кипения 27°С) нераздельнокипящая точка смещается вправо вплоть до Х= 100, т. е. при этом давлении пар всегда будет иметь большую концентрацию спирта, чем исходная жидкость (вплоть до 100%).
Анализируя положение кривой фазового равновесия, легко установить, что при атмосферном давлении пары над жидкостью будут обогащаться этиловым спиртом только до азеотропной тонки. Следовательно, путем ректификации (многократного испарения и конденсации) при атмосферном давлении можно достигнуть максимальной крепости спирта 97,2 об. %. Чтобы получить спирт большей крепости, необходимо уменьшить давление; тогда азеотропная точка сдвинется вправо, т. е. в область требующейся крепости. Этим приемом иногда пользуются на практике при получении абсолютного спирта.
Фазовое равновесие в бинарной смеси, этиловый спирт — вода при атмосферном давлении изучено В. Н. Стабниковым и О. Г. Мудравской. По их данным строят график фазового равновесия, который широко применяют для расчета процесса ректификации и анализа работы ректификационных колонн. В ряде случаев возникает необходимость иметь аналитическую зависимость указанного равновесия, которая по тем же данным установлена П. С. Цыганковым (табл.1).
| Интервалы концентраций, мол. % | Уравнения для Y, мол. % |
| 0—23 | Х/(0,014595 + 0,0773) |
| 23—55 | 0,395 Х + 45,52 |
| 55-66,5 | 0,5087Х + 39,27 |
| 66,5—82 | 0,6548X +29,56 |
| 82—89,4 . | 0,8113Х + 15,08 |
Наличие сухих веществ в водно-спиртовых растворах, как показано работами С. Е. Харина и В. М. Перелыгина, немного увеличивает концентрацию спирта в парах, однако в практических расчетах обычно пользуются кривой фазового равновесия для чистых водно-спиртовых растворов.
Источник
Процентное содержание спирта в парах и жидкости
В основу современной теории ректификации положены закономерности перегонки двойных смесей, которые установлены Д. П. Коноваловым и М. С. Вревским.
Первый закон Коновалова устанавливает зависимость между составом жидкой и паровой фаз в системе этанол — вода, а второй — положение азеотропной точки на кривой, устанавливающей зависимость между упругостью пара Р (МПа) и составом жидкой смеси X (мас %):
Р = f(Х).
На рисунке ниже изображена кривая равновесной бинарной системы этиловый спирт — вода при нормальном давлении и температуре кипения смеси. На горизонтальной оси этого графика приведено содержание этанола х в жидкой фазе (мас. %), а на вертикальной оси — в паровой фазе у (мас. %).
Кривая равновесия системы этиловый спирт — вода при нормальном давлении:
х, у — концентрация спирта в парах и в жидкости соответственно
Кривая равновесия располагается выше диагонали (х = у) от начала координат до точки А, что свидетельствует об обогащении паровой фазы спиртом на указанном участке кривой равновесия. График представляет собой геометрическое место точек коэффициентов испарения этанола, которые наглядно характеризуют его летучесть в зависимости от состава жидкой фазы.
После точки А кривая равновесия проходит несколько ниже диагонали до правой верхней точки Б диаграммы. Следовательно, обогащение пара спиртом при содержании его в смеси более 95.57 мас. % невозможно. Лишь изменение давления в системе ниже нормального позволяет получать более крепкий спирт. В этом случае кривая равновесия располагается выше диагонали, вплоть до точки Б.
Законы Вревского указывают направление, в котором сдвигается равновесие в смеси этанол—вода при изменении давления в системе. Так, при давлении в системе 0,009 МПа и температуре кипения 27,92 С возможно получение безводного (абсолютного) спирта.
Таблица. Равновесие пар-жидкость смеси этиловый спирт-вода. Состав кипящей водно-спиртовой жидкости, образующегося из нее пара и температура кипения этой жидкости при атмосферном давлении.
Источник