- Химия, Биология, подготовка к ГИА и ЕГЭ
- Качественные реакции органической химии
- Качественные реакции органических соединений
- Химические свойства алкадиенов
- Химические свойства сопряженных алкадиенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкадиенов
- 1.3. Гидрогалогенирование алкадиенов
- 1.5. Полимеризация
- 2. Окисление алкадиенов
- 2.1. Мягкое окисление алкадиенов
- 2.2. Жесткое окисление
- 2.3. Горение алкадиенов
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества .
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 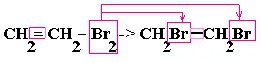 2. Изменение окраски раствора 2. Изменение окраски раствора 3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 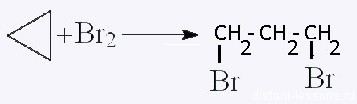 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 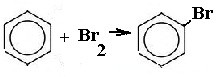
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 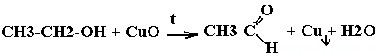 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 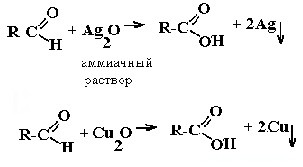 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Источник
Качественные реакции органических соединений
Качественные реакции органических соединений
Таблица. Качественные реакции на органические вещества
| Органическое вещество | Реактив | Наблюдаемая реакция | ||||||||||||||||||
| Алкены, алкины, алкадиены (этилен, ацетилен, дивинил и др.) | Бромная вода, Br2 (р-р) | Обесцвечивание раствора (видеоопыт реакция этилена с бромной водой, ацетилен с бромной) | ||||||||||||||||||
| Алкены, алкины, алкадиены (этилен, ацетилен, дивинил и др.) | Перманганат калия KMnO4 | Обесцвечивание раствора (видеоопыт) | ||||||||||||||||||
| Алкины с тройной связью на конце цепи (ацетилен С2Н2, пропин и др.) | Аммиачный раствор оксида серебра, [Ag(NH3)2]OH | Выпадение осадка соли серебра (видеоопыт) | ||||||||||||||||||
| Многоатомные спирты (этиленгликоль, глицерин и др.) | Свежеосажденный гидроксид меди (II) Сu(OH)2 | Образование ярко-синего раствора комплекса (видеоопыт) | ||||||||||||||||||
| Фенолы (С6Н5ОН — фенол и др.) | Бромная вода, Br2 (р-р) | Выпадение белого осадка | ||||||||||||||||||
| Раствор хлорида железа (III) FeCl3 | Образование фиолетового раствора | |||||||||||||||||||
| Альдегиды (СН2О — муравьиный альдегид и др.) + муравьиная кислота НСООН + глюкоза (и другие углеводы-альдозы) Источник Химические свойства алкадиеновАлкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С. Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3. Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов. Химические свойства сопряженных алкадиеновСопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему. Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
1. Реакции присоединенияДля алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
1.1. ГидрированиеГидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением. При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2): Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При полном гидрировании дивинила образуется бутан: 1.2. Галогенирование алкадиеновПрисоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1: При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
1.3. Гидрогалогенирование алкадиеновАлкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2: 3-Хлорбутен-1 образуется в небольшом количестве. При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
1.5. ПолимеризацияПолимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера). nM → Mn (M – это молекула мономера)
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком: При полимеризации изопрена образуется природный (натуральный) каучук: 2. Окисление алкадиеновРеакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода). В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое. 2.1. Мягкое окисление алкадиеновМягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается. В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
2.2. Жесткое окислениеПри жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода. Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2. Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа: 2.3. Горение алкадиеновАлкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды. В общем виде уравнение сгорания алкадиенов выглядит так: Источник |













