- ВОДА, ЛЕД И ПАР
- Полезное
- Смотреть что такое «ВОДА, ЛЕД И ПАР» в других словарях:
- Испарение и конденсация воды. Несколько практических советов
- ВОДА, ЛЕД И ПАР
- Историческая справка.
- Распространенность.
- Морская вода.
- Минеральная вода.
- Мягкая и жесткая вода.
- Молекулярная структура.
- Физические свойства.
- Давление паров.
- Химические свойства.
- Каталитическое действие.
- Гидраты.
- Гидролиз.
- Сольватация.
- Тяжелая вода.
ВОДА, ЛЕД И ПАР
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое «ВОДА, ЛЕД И ПАР» в других словарях:
ВОДА — ВОДА. I. Физико химические свойства и состав воды. Водные пространства мирового океана и морей составляют 361 млн. кв. км и занимают 71% всей земной поверхности. В свободном состоянии В. занимает самую поверхностную часть земной коры, т. н.… … Большая медицинская энциклопедия
Вода — С древнейших времен стали понимать великое значение воды не только для людей и всяких животных и растительных организмов, но и для всей жизни Земли. Некоторые из первых греческих философов ставили воду даже во главе понимания вещей в природе, и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Лед — (физ.) твердое тело, образующееся из воды при понижении ее температуры до нуля и ниже. Переход воды в Л. есть физическое явление и совершается без изменения химического ее состава, но газы, растворенные в воде, при замерзании выделяются; соли… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Пар (физ.-хим.)* — Обыкновенно под словом П. понимают лишь газообразное состояние тела при температурах ниже критической, называя это состояние при температурах выше критической газом этого тела. Парообразование совершается с поверхности не только жидких, но и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Пар (физ.-хим.) — Обыкновенно под словом П. понимают лишь газообразное состояние тела при температурах ниже критической, называя это состояние при температурах выше критической газом этого тела. Парообразование совершается с поверхности не только жидких, но и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Лед искусственный* — Невыгода хранения, особенно в больших городах, и перевозки, часто издалека, природного Л. и необходимость иметь в некоторых отраслях техники охлаждение гораздо ниже 0° заставили искать как способов получения искусственного Л., так и вообще… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Лед искусственный — Невыгода хранения, особенно в больших городах, и перевозки, часто издалека, природного Л. и необходимость иметь в некоторых отраслях техники охлаждение гораздо ниже 0° заставили искать как способов получения искусственного Л., так и вообще… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ФАЗ ПРАВИЛО — закон, выведенный в 1876 Дж. Гиббсом из термодинамических принципов и описывающий условия равновесия в гетерогенной системе. Прежде чем формулировать его, определим такие понятия, как фаза, число компонентов и вариантность. Фаза это однородная… … Энциклопедия Кольера
ВОДНЫЕ РЕСУРСЫ — воды в жидком, твердом и газообразном состоянии и их распределение на Земле. Они находятся в естественных водоемах на поверхности (в океанах, реках, озерах и болотах); в недрах (подземные воды); во всех растениях и животных; а также в… … Энциклопедия Кольера
КИСЛОРОД — O (oxygenium), химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в… … Энциклопедия Кольера
Источник
Испарение и конденсация воды. Несколько практических советов
Вода – одно из самых распространенных и вместе с тем самое удивительное вещество на Земле. Вода находится повсюду: и вокруг нас, и внутри нас. Мировой океан, состоящий из воды, покрывает ¾ поверхности земного шара. Любой живой организм, будь то растение, животное или человек, содержит воду. Человек более чем на 70% состоит из воды. Именно вода – одна из главнейших причин возникновения жизни на Земле. Как и любое вещество, вода может находиться в различных состояниях или, как говорят физики, ‑ агрегатных состояниях вещества: твердом, жидком и газообразном. При этом постоянно происходят переходы из одного состояния в другое – так называемые фазовые переходы. Одним из таких переходов является испарение, обратный процесс называется конденсацией. Давайте попробуем разобраться, как можно использовать это физическое явление, и что нужно знать об этом.
В процессе испарения вода переходит из жидкого состояния в газообразное, при этом образуется водяной пар. Это происходит при любой температуре, когда вода находится в жидком состоянии (0 0 – 100 0 С). Однако скорость испарения не всегда одинаковая и зависит от ряда факторов: от температуры воды, от площади поверхности воды, от влажности воздуха и от наличия ветра. Чем выше температура воды, тем быстрее двигаются ее молекулы и тем интенсивнее происходит испарение. Чем больше площадь поверхности воды, а испарение происходит исключительно на поверхности, тем больше молекул воды смогут перейти из жидкого состояния в газообразное, что увеличит скорость испарения. Чем больше содержание водяных паров в воздухе, то есть чем выше влажность воздуха, тем менее интенсивно происходит испарение. Кроме того, чем больше скорость удаления молекул водяного пара от поверхности воды, то есть чем больше скорость ветра, тем больше скорость испарения воды. Также следует отметить, что в процессе испарения воду покидают самые быстрые молекулы, поэтому средняя скорость молекул, а, значит, и температура воды уменьшаются.
Учитывая описанные закономерности, важно обратить внимание на следующее. Очень горячий чай пить не безвредно. Однако чтобы его заварить, требуется вода с температурой, близкой к температуре кипения (100 0 С). При этом вода активно испаряется: над чашкой с чаем хорошо видны поднимающиеся струйки водяного пара. Чтобы быстро охладить чай и сделать чаепитие комфортным, нужно увеличить скорость испарения, и охлаждение чая произойдет существенно быстрее. Первый способ известен всем с детства: если подуть на чай и тем самым удалить молекулы водяного пара и нагретый воздух от поверхности, то скорость испарения и теплопередачи увеличится, и чай быстрее остынет. Второй способ часто использовали в старину: переливали чай из чашки в блюдце и тем самым увеличивали площадь поверхности в несколько раз, пропорционально увеличивая скорость испарения и теплопередачи, благодаря чему чай быстро остывал до комфортной температуры.
Охлаждение воды при испарении хорошо ощущается, когда летом выходишь из открытого водоема после купания. С влажной кожей находиться прохладнее. Поэтому чтобы не переохладиться и не заболеть, нужно обтереться полотенцем, тем самым остановить охлаждение, вызванное испарением воды. Однако это свойство воды – охлаждаться при испарении – иногда полезно использовать для того, чтобы немного понизить высокую температуру заболевшему человеку и тем самым облегчить его самочувствие при помощи компрессов или обтираний.
При конденсации вода из газообразного состояния переходит в жидкое с выделением тепловой энергии. Это важно помнить, находясь вблизи кипящего чайника. Струя водяного пара, выходящая из его носика, имеет высокую температуру (около 100 0 С). Кроме того, соприкасаясь с кожей человека, водяной пар конденсируется, тем самым увеличивая неблагоприятное термическое воздействие, что может привести к болезненным ожогам.
Также полезно знать, что в воздухе всегда содержится какое-то количество водяных паров. И чем выше температура воздуха, тем больше водяных паров может быть в атмосфере. Поэтому летом при заметном понижении температуры в ночное время часть водяных паров конденсируется и выпадает в виде росы. Если утром пройти босиком по траве, то она будет влажной и холодной на ощупь, так как уже активно испаряется благодаря утреннему солнцу. Похожая ситуация происходит, если зимой войти с улицы в теплое помещение в очках, ‑ очки будут запотевать, так как водяные пары, находящиеся в воздухе, будут конденсироваться на холодной поверхности стекол. Чтобы это предотвратить, можно воспользоваться обычным мылом и нанести на стеклах сетку с шагом около 1 см, а затем растереть мыло мягкой тканью, не спеша и не сильно нажимая. Стекла очков покроются тонкой невидимой пленкой и не будут запотевать.
Водяной пар, находящийся в воздухе, можно с большой точностью считать идеальным газом и рассчитывать параметры его состояния при помощи уравнения Менделеева-Клапейрона. Предположим, что температура воздуха днем при нормальном атмосферном давлении составляет 30 0 С, а влажность воздуха 50%. Найдем, до какой температуры должен охладиться воздух ночью, чтобы выпала роса. При этом будем считать, что содержание (плотность) водяных паров в воздухе не изменялось.
Плотность насыщенного водяного пара при 30 0 С равна 30,4 г/м 3 (табличное значение). Так как влажность воздуха 50%, то плотность водяных паров составляет 0,5·30,4 г/м 3 = 15,2 г/м 3 . Роса выпадет, если при некоторой температуре эта плотность будет равна плотности насыщенного водяного пара. Согласно табличным данным это наступит при температуре примерно 18 0 С. То есть, если ночью температура воздуха опустится ниже 18 0 С, то выпадет роса.
По предложенному методу мы предлагаем вам решить задачу:
В закрытой банке объемом 2 л находится воздух, влажность которого составляет 80%, а температура 25 0 С. Банку поставили в холодильник, внутри которого температура 6 0 С. Какая масса воды выпадет в виде росы после наступления теплового равновесия.
Автор: Матвеев К.В., методист ГМЦ ДО г. Москвы
Источник
ВОДА, ЛЕД И ПАР
ВОДА, ЛЕД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Историческая справка.
Идея древних философов о том, что все в природе образуют четыре элемента (стихии): земля, воздух, огонь и вода, просуществовала вплоть до Средних веков. В 1781 Г.Кавендиш сообщил о получении им воды при сжигании водорода, но не оценил в полной мере важности своего открытия. Позже (1783) А.Лавуазье доказал, что вода вовсе не элемент, а соединение водорода и кислорода. Й.Берцелиус и П.Дюлонг (1819), а также Ж.Дюма и Ж.Стас (1842) установили весовой состав воды, пропуская водород через оксид меди, взятый в строго определенном количестве, и взвешивая образовавшиеся медь и воду. Исходя из этих данных, они определили отношение Н:О для воды. Кроме того, в 1820-х годах Ж.Гей-Люссак измерил объемы газообразных водорода и кислорода, которые при взаимодействии давали воду: они соотносились между собой как 2:1, что, как мы теперь знаем, отвечает формуле Н2О.
Распространенность.
Вода покрывает 3/4 поверхности Земли. Тело человека состоит из воды примерно на 70%, яйцо – на 74%, а некоторые овощи – это почти одна вода. Так, в арбузе ее 92%, в спелых томатах – 95%.
Вода в природных резервуарах никогда не бывает однородной по составу: она проходит через горные породы, соприкасается с почвой и воздухом, а потому содержит растворенные газы и минеральные вещества. Более чистой является дистиллированная вода.
Морская вода.
Состав морской воды различается в разных регионах и зависит от притока пресных вод, скорости испарения, количества осадков, таяния айсбергов и т.д. См. также ОКЕАН.
Минеральная вода.
Минеральная вода образуется при просачивании обычной воды сквозь породы, содержащие соединения железа, лития, серы и других элементов.
Мягкая и жесткая вода.
Жесткая вода содержит в больших количествах соли кальция и магния. Они растворяются в воде при протекании по породам, сложенным гипсом (СaSO4), известняком (СаСО3) или доломитом (карбонаты Mg и Са). В мягкой воде этих солей мало. Если вода содержит сульфат кальция, то говорят, что она обладает постоянной (некарбонатной) жесткостью. Ее можно умягчить добавлением карбоната натрия; это приведет к осаждению кальция в виде карбоната, а в растворе останется сульфат натрия. Соли натрия не вступают в реакцию с мылом, и расход его будет меньше, чем в присутствии солей кальция и магния.
Вода, обладающая временной (карбонатной) жесткостью, содержит бикарбонаты кальция и магния; ее можно умягчить несколькими способами: 1) нагреванием, приводящим к разложению бикарбонатов на нерастворимые карбонаты; 2) добавлением известковой воды (гидроксида кальция), в результате чего бикарбонаты превращаются в нерастворимые карбонаты; 3) с помощью обменных реакций.
Вода, содержащая в большом количестве растворенный диоксид углерода, просачиваясь через известняковые породы, растворяет их, что приводит к образованию пещер. При повышении температуры начинается обратный процесс: бикарбонат разлагается и вновь образуется известняк. Именно из него состоят сталактиты и сталагмиты.
Молекулярная структура.
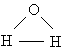
Анализ данных, полученных из спектров поглощения, показал, что три атома в молекуле воды образуют равнобедренный треугольник с двумя атомами водорода в основании и кислородом в вершине:
Валентный угол НОН равен 104,31 ° , длина связи О–Н составляет 0,99 Å (1 Å = 10 –8 см), а расстояние Н–Н равно 1,515 Å. Атомы водорода так глубоко «внедрены» в атом кислорода, что молекула оказывается почти сферической; ее радиус – 1,38 Å.
Физические свойства.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0 ° С) и кипения (100 ° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества, ее удельная электропроводность равна 1,5 Ч 10 –8 Ом –1 Ч см –1 при 0 ° С. Сжимаемость воды очень мала: 43 Ч 10 –6 см 3 на мегабар при 20 ° С. Плотность воды максимальна при 4 ° С; это объясняется свойствами водородных связей ее молекул.
Давление паров.
Если оставить воду в открытой емкости, то она постепенно испарится – все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100 ° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90 ° С.
Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье.
Вязкость воды с ростом температуры быстро уменьшается и при 100 ° С оказывается в 8 раз меньше, чем при 0 ° С.
Химические свойства.
Каталитическое действие.
Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.
Гидраты.
Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4 Ч 5H2O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125 ° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250 ° С. Еще один стабильный гидрат – серная кислота; она существует в двух гидратных формах, SO3 Ч H2O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н + всегда находится в виде иона гидроксония Н3О + или Н5О2 + ; ион лития – в виде Li (H2O)6 + и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2 Ч 10 H2O и Cl2 Ч 6H2О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2 Ч 2H2O, английская соль (сульфат магния) MgSO4 Ч 7H2O, питьевая сода (карбонат натрия) Na2CO3 Ч 10 H2O, глауберова соль (сульфат натрия) Na2SO4 Ч 10 H2O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4 Ч 5H2O, CuSO4 Ч 3H2O и CuSO4 Ч H2O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Гидролиз.
Гидролиз – это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой:
Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.
Сольватация.
Вода – полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И.А.Каблуковым.
Тяжелая вода.
В 1931 Г.Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий – важный участник реакций ядерного синтеза.
Третий изотоп водорода – тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:10 18 , в поверхностных водах – 1:10 19 , в глубинных водах он отсутствует. См. также ВОДОРОД.
Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка.
Лед при нормальном давлении существует только при температуре 0 ° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0 ° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема. См. также АЙСБЕРГИ.
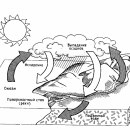
Пар – газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот «пар», который вырывается из кипящего чайника, – это на самом деле множество мельчайших капелек воды. Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню.
Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, – утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях. См. также КОТЕЛ ПАРОВОЙ; ДВИГАТЕЛЬ ТЕПЛОВОЙ; ТЕПЛОТА; ТЕРМОДИНАМИКА.
Эйзенберг Д., Кауцман В. Структура и свойства воды. Л., 1975
Зацепина Г.Н. Физические свойства и структура воды. М., 1987
Источник