Лекарственные вещества содержащие кристаллизационную воду обладают
Управление солюбилизационными характеристиками лекарственных веществ является одним из основных направлений в разработках современных систем доставки лекарств (Drug Delivery Systems) [22]. В этом направлении наиболее востребованы методы повышения растворимости и скорости растворения активных фармацевтических субстанций – лекарственных веществ (ЛВ). Растворимость играет существенную роль в действии лекарств, прежде всего предназначенных для перорального приема, так как максимальная скорость пассивного транспорта препарата через биологические мембраны – основной путь для поглощения ЛВ – зависит от проницаемости мембраны и концентрации раствора/растворимости. Учитывая, что
40 % выпускающихся лекарственных субстанций классифицируются как практически нерастворимые, а
85 % самых продаваемых препаратов в США и Европе принимаются перорально, актуальность исследований в данном направлении становится очевидной.
В настоящее время FDA принята система биофармацевтической классификации лекарств [24, 26] для прогнозирования биодоступности при пероральном приеме. Эта система основана на использовании соотношений параметров растворимости и проницаемости стенок желудочно-кишечного тракта (ЖКТ). Растворимость классифицирована на основании стандартов Фармакопеи США (USP) [23]. Так, лекарственное вещество считается хорошо растворимым, когда максимальная разрешенная его доза растворяется в 90 процентов его дозы проникает в кровоток при пероральном введении. Ниже приводятся основные классы ЛВ по критериям «проницаемость стенок ЖКТ – растворимость».
Класс I – высокая проницаемость, высокая растворимость. Эти соединения хорошо всасываются и скорость абсорбции, как правило, выше, чем выведение.
Класс II – высокая проницаемость, низкая растворимость. Пример: большинство нестероидных противовоспалительных средств. Биодоступность таких продуктов ограничена скоростью их растворения (кинетический барьер) и растворимостью (термодинамический барьер). К этому классу относится
> 30 % выпускающихся и разрабатываемых лекарств.
Класс III – низкая проницаемость, высокая растворимость. Пример: большинство антибиотиков бета-лактамного типа. Низкая скорость абсорбции ограничивает проникновение в кровоток, но препараты растворяются очень быстро.
Класс IV – низкая проницаемость, низкая растворимость. Пример: антигельминтики – альбендазол, карбендацим, фенбендазол; растительные флавоноиды – рутин, кверцетин, дигидрокверцетин. Эти соединения имеют низкую биодоступность. Обычно они плохо поглощаются слизистой оболочкой кишечника. К этому классу относится
10 % выпускающихся и разрабатываемых лекарств.
Таким образом, ЛВ, относящиеся к II и IV классам, нуждаются в технологиях повышения их водорастворимости. К этим классам относятся до 50 % разрабатываемых и выпускающихся фармацевтической промышленностью ЛВ.
Для повышения растворимости лекарств используют различные физико-химические подходы: уменьшение размеров частиц, модификация кристаллической структуры, получение твердых дисперсий ЛВ с наполнителями и т.д. [20, 18]. Так, при измельчении субстанций антигельминтных препаратов «карбендацим» (бензимидазолил-2-метил карбамат) и «альбендазол» (5-тиопропилбензимидазолил-2-метилкарбамат) в планетарно-центробежном активаторе АГО–2 в «жестких» условиях активации (40 – 60g) было показано не только уменьшение размера частиц, но также стабильность химической структуры, а именно, при сравнении ИК-спектров исходных и измельченных субстанций не было обнаружено изменений в расположении полос поглощения основных функциональных групп (NH, C = N, C = O, OCH3). В спектрах измельченных субстанций наблюдалось увеличение интенсивности этих сигналов, что позволило предполагать лишь о разрушении межмолекулярных водородных связей [11]. Изучение растворения исходного и измельченного образцов карбендацима в среде «желудочного сока» показало, что скорость растворения измельченной субстанции выше, нежели неизмельченной субстанции.
Однако, по нашему мнению, наиболее значимые результаты достигаются за счет перевода ЛВ в их водорастворимые соли (если ЛВ имеет выраженные кислотно-основные свойства), а также за счет включения молекул ЛВ в супрамолекулярные водорастворимые образования (межмолекулярные комплексы, мицеллы) со специально подобранными «вспомогательными» веществами.
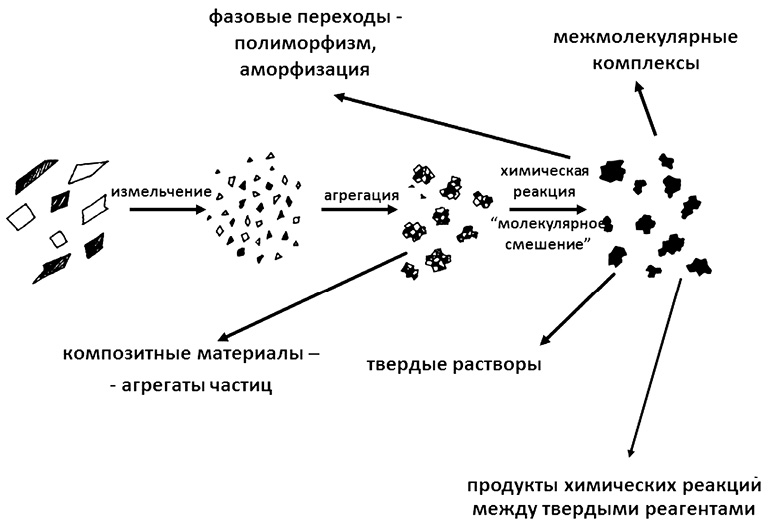
Механохимия является разделом химии твердого тела, в котором изучаются физико-химические превращения твердых веществ и их смесей в условиях интенсивных ударно-истирающих воздействий, обычно реализующихся в специальных мельницах. На рис. 1 показаны возможные пути трансформаций в смесях твердых веществ при их механохимической обработке [3].
Суть нашей технологии заключается в получении твердых дисперсий лекарственных веществ со вспомогательными веществами различной химической природы. Увеличение растворимости ЛВ и повышение эффективности фармакологического действия в зависимости от их физико-химических свойств достигается:
– образованием твердых дисперсий, в которых ЛВ диспергировано в молекулярной форме или находится в аморфном состоянии;
– образованием водорастворимых солей;
– образованием водорастворимых комплексов включения с полисахаридами по типу «гость-хозяин», а также мицелл.
Далее мы рассмотрим вышеуказанные случаи.
Рис. 1. Схема механохимических превращений в смесях твердых веществ (ЛВ + вспомогательные вещества) при их механической обработке ударно-истирающими воздействиями
Получение и свойства твердых дисперсий, в которых ЛВ находится в аморфизованном состоянии или диспергирована в молекулярной форме
Высвобождение в раствор фармакологически активного вещества из твердых лекарственных форм (порошков, таблеток и т.д.) во многом определяется скоростью растворения его кристаллической фазы. Однако многие фармакологические активные вещества крайне медленно растворяются в воде во многом за счет плохой смачиваемости и «прочности» кристаллической решетки. Очевидно, что получение твердых растворов – молекулярных дисперсий – таких веществ в хорошо растворимом наполнителе либо разупорядочение их кристаллических фаз будет способствовать ускорению процесса растворения. Именно этот принцип был применен нами к модификации антигельминтика карбендацима и ряда транквилизаторов бензодиазепинов – диазепама, оксазепама и медазепама, лекарственные субстанции которых практически нерастворимы в воде.
Для модификации солюбилизационных характеристик бензодиазепинов нами механохимическим способом были получены их твердые дисперсии с лактозой и микрокристаллической целлюлозой в весовых соотношениях 1:5, 1:10 и 1:15. В дифрактограммах механически активированных образцов наблюдалось резкое падение интенсивности рефлексов (без их заметного уширения) кристаллических фаз ЛВ вплоть до их полного исчезновения. Рефлексы веществ – наполнителей (лактозы и отчасти целлюлозы) претерпевали уширение, что свидетельствовало о накоплении дефектов и уменьшении кристалличности. К сожалению, методы термического анализа оказались неэффективны из-за относительно низких температур разложения веществ-наполнителей.
Проведенные исследования растворимости образцов продемонстрировали во всех случаях увеличение скорости растворения ЛВ в механохимически полученных образцах по сравнению со смесями, не подвергавшимися механохимической обработке и тем более измельченными исходными субстанциями [5]. Проведенные испытания биологической доступности образцов модифицированных препаратов оксазепама на лабораторных животных – кроликах – показали увеличение действующей концентрации оксазепама в крови и сокращение времени достижения ее максимального значения. Биодоступность оксазепама по сравнению с неактивированной смесью увеличивается в 1,56 ± 0,25 раза. Таким образом повышается эффективность действия лекарственного средства.
Получение и свойства твердых дисперсий, образующих водорастворимые соли ЛВ
Многие малорастворимые ЛВ обладают кислотными или основными свойствами и способны к ионизации в водных растворах и образованию соответствующих солей. Как правило, ионизированная форма является более гидрофильной и имеет более высокую водорастворимость. Многие ЛВ с целью повышения их растворимости выпускаются в виде их солей [9, 12]. Так, лекарственные вещества, имеющие основной характер, – в виде гидрохлоридов, а органические кислоты – в виде солей металлов или органических оснований. Соли получают реакцией жидкофазной нейтрализации с последующим выделением (сушкой). При этом требуются большие объемы растворителей, громоздкое оборудование, значительные производственные площади. Кроме того, в процессе сушки возможно разложение целевого продукта.
Рассмотрим возможности этого подхода на примере ацетилсалициловой кислоты (аспирина). Малая растворимость в воде ( Примечания:
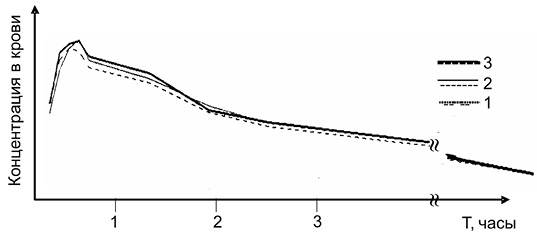
Cmax – максимальная концентрация в крови;
Tmax – время достижения максимальной концентрации в крови;
AUC – площадь под фармакокинетической кривой, в относительных единицах;
* – навески препаратов взяты в эквивалентных по действующему веществу концентрациях.
Рис. 3. Фармакокинетика препаратов «АСК – Na2CO3» и «Аспирин + С» при разных способах приема препаратов. Прием раствора таблеток «Аспирин + С» (1), раствора таблеток нашего препарата (2) и таблеток нашего препарата без предварительного растворения (3) в эквивалентных по АСК дозах
В соответствии с действующими правилами нами были разработаны фармакопейные статьи на таблетки и субстанцию, проведены фармакологические испытания [1, 2] и препарат зарегистрирован для применения в РФ.
Композиция состава АСК/CaCO3 = 78/22 вес. % также представляет значительный интерес. Она обладает высокой химической стабильностью при хранении и меньшей гигроскопичностью, но замедленной скоростью растворения. Методом прямого прессования из нее были получены таблетки с двумя дозировками АСК – 0,1 г (вес таблетки 0,128 г) и 0,5 г (вес таблетки 0,64 г). По своим характеристикам – химическая чистота, время растворения, кислотонейтрализующая емкость (для таблеток по 0,5 г) – эти таблетки соответствуют требованиям USP к так называемым «буферированным» таблеткам ацетилсалициловой кислоты. Разработанный нами препарат, получивший название «Антиагрегин», показал при сравнительных опытах с применяемыми в медицинской практике импортными препаратами практически равнозначную эффективность и безопасность для лечения и профилактики сердечно-сосудистых заболеваний (табл. 2).
Сравнительные характеристики разработанных в ИХТТМ СО РАН растворимых таблеток и их импортных аналогов
Источник
Лекарственные вещества содержащие кристаллизационную воду обладают
В настоящее время на отечественном фармацевтическом рынке существует большое количество лекарственных препаратов, имеющих различное происхождение – синтетическое, полусинтетическое, природное. Наиболее востребованными из них являются препараты, произведенные и/или изготовленные из лекарственного растительного сырья. В современной научной медицине используются свыше 250 видов лекарственных растений, важнейшие из которых внесены в Государственную фармакопею РФ [1]. Они обладают различным терапевтическим действием, которое определяется содержащимися в лекарственном растительном сырье биологически активными веществами. Наиболее значимой группой таких веществ являются алкалоиды.
Алкалоиды – это группа азотсодержащих органических веществ природного происхождения, обладающих выраженной физиологической активностью. В растительном мире они наиболее распространены среди отдела Angiospermae (Magnoliophyta), реже – среди отдела Gymnospermae. Ими богаты семейства Papaveraceae, Solanaceae, Fabaceae, Campanulaceae, Ranunculaceae, Apocynaceae, Rutaceae, Loganiaceae, Ephedraceae, Malvaceae, Taxaceae и другие. Алкалоиды способны накапливаться в различных органах растения, локализуясь в клетках в виде солей органических и неорганических кислот. Содержание их как биологически активных веществ мало – оно составляет сотые и десятые доли процента [2]. Обычно растение имеет в своем химическом составе не один, а несколько видов алкалоидов, расположенных в разных его частях. Например, клубни Stephania glabra (Roxb.) Miers содержат сумму алкалоидов, в состав которых входят гиндарин, ротундин, стефарин и многие другие. Несмотря на это, в листьях и стебле обнаружен лишь один представитель – циклеанин. В траве Thermopsis lanceolata R.Br. имеется большое содержание алкалоидов термопсина, гомотермопсина, пахикарпина, анагирина, но как лекарственное растительное сырье его используют в качестве источника цитизина, накапливаемого в семенах. Помимо локализации алкалоиды отличаются и концентрацией, влияние на которую оказывают многочисленные факторы: климатические условия (температура, влажность), минеральный состав почвы, время суток и стадии вегетации. Известно, что в условиях повышенной влажности, количество алкалоидов постепенно снижается. На синтезирование и накопление данных биологически активных веществ благоприятно влияют богатые азотом почвы, высокая температура и продолжительность светового дня [3].
Несмотря на то, что алкалоиды активно используются для изготовления/производства лекарственных препаратов, обладающих различными фармакологическими эффектами, их биологическая роль в растении окончательно не выяснена. Существует множество теорий, но все они несостоятельны, так как не отражают полноту осуществляемых ими функций. Предполагается, что в процессе дыхания растения алкалоиды окисляются в пероксид, который затем переходит в оксид и высвобождаемый при этом процессе активированный кислород используется для дальнейшего фотосинтеза. Данные биологически активные вещества выступают в роли стимуляторов и регуляторов роста растений, т.е. фитогормонов. Также известно, что алкалоиды способны осуществлять защитную функцию, выражающуюся в предохранении растения от поедания представителями животного мира. Проведенная в Предуралье работа доказывает, что содержание алкалоидов в растении позволяет им сосуществовать с более конкурентоспособными видами за счет изменения ритма сезонного развития [4].
Многочисленные исследования алкалоидосодержащих растений и их свойств дали возможность производить и / или изготавливать лекарственные растительные препараты таким образом, чтобы сохранялось необходимое для терапевтического эффекта содержание биологически активного вещества. Существуют определенные особенности заготовки растительного сырья, методы выделения алкалоидов из растительного сырья, методы качественного и количественного анализа, методы и особенности производства лекарственных препаратов на основе данного действующего вещества.
Цель исследования: изучение фармакологических свойств препаратов алкалоидов. Задачи исследования представлены изучением видов лекарственных растений, содержащих данную группу действующих веществ, методов качественного и количественного анализа и особенностей производства и/или изготовления лекарственных растительных препаратов.
Материалы и методы исследования
Исследуемыми объектами настоящего исследования являются следующие лекарственные алкалоидосодержащие растения: Aconitum monticola Steinb., Stephania glabra (Roxb.) Miers, Thermopsis lanceolata R.Br., Cytisus ruthenicus Fisch. ex Wol., Lobelia inflata L., Strychnos nux-vomica L., Glaucium flavum Crantz., Vinca rosea L., Taxus brevifolia Nutt. Исследование проводилось с использованием информационно-поисковых (Scholar Google) и библиотечных баз данных (eLibrary, CyberLeninka).
Результаты исследования и их обсуждение
Доказательством того, что в растениях есть алкалоиды, служат положительные качественные реакции на исследуемое биологически активное вещество. Для качественного анализа используют общие и частные качественные реакции на алкалоиды [5]. Общие качественные реакции представлены реакциями осаждения с использованием различных химических веществ – йода и его растворов, реактива Драгендорфа, реактива Майера, реактива Бертрана, реактива Шейблера, реактива Зонненштейна, раствора кислоты пикриновой и раствора таннина. Реакции окрашивания (частные качественные реакции) многочисленны. В качестве реагентов используют концентрированную кислоту серную или азотную (оранжево-красное или красно-бурое окрашивание берберина соответственно), раствор пероксида водорода (фиолетовое окрашивание берберина), раствор калия бихромата и концентрированную кислоту серную (красно-фиолетовое окрашивание стрихнина), раствор калия бихромата и концентрированную кислоту азотную (оранжево-красное окрашивание бруцина), реактивы Эрдмана, Марки, Фреде, которые имеют различную окраску в зависимости от строения алкалоида. Кроме того, существуют групповые качественные реакции: мурексидная проба на пуриновые алкалоиды, реакция Витали – Морена на тропановые алкалоиды и другие. Эти реакции позволяют выявить у лекарственных растений целую группу алкалоидов или какой-либо определенный представитель, который в дальнейшем может послужить активным компонентом будущего лекарственного средства. В этом заключается первый этап создания лекарственного растительного препарата на основе алкалоида.
Второй этап подразумевает собой количественное определение данного биологически активного вещества. Сначала необходимо извлечь сумму алкалоидов из лекарственного растительного сырья. Для этого применяют такой метод, как экстракцию водой или спиртом, подкисленными винной, уксусной или хлороводородной кислотой. Перейдя в форму оснований, алкалоиды могут экстрагироваться органическими растворителями. При этом остальные ненужные сопутствующие вещества не связываются с ними, а остаются в исходном водном или спиртовом растворе. Затем органическую смесь алкалоидов подкисляют раствором соответствующей кислоты, вновь переводя алкалоид в солевую форму. Таким образом, выполняя данную операцию некоторое количество раз, можно добиться высокой степени очистки препарата.
В настоящее время на фармацевтических предприятиях все чаще отдают предпочтение иному методу выделения и очистки алкалоидов – ионному обмену. Этот метод представляет собой вполне простую технологическую схему, включающую в себя 5 основных процессов [6]. Как правило, индивидуальные алкалоиды извлекают с помощью нескольких видов катионитов (например, КУ-1, КУ-2, СБС-3). Данный метод применяют для производства цитизина из травы Thermopsis lanceolata R.Br. и многих других алкалоидов. Достоинствами ионного обмена являются относительная дешевизна материалов, простота оборудования и малая трудоемкость процесса. В других случаях используют метод электродиализа, совмещающего несколько этапов производства препаратов на основе алкалоидов – экстракцию, выделение и очистку. Но в связи с низкой эффективностью и сложностью эксплуатации оборудования на фармацевтическом производстве данный метод применяется крайне редко.
За извлечением и очисткой следует разделение суммы алкалоидов на индивидуальные компоненты, с которыми в дальнейшем будут иметь дело. Этот этап является крайне важным и достаточно сложным, так как в зависимости от того, насколько успешно пройдет разделение на конкретные алкалоиды, будет зависеть качество будущего лекарственного средства. Для выделения индивидуальных веществ на фармацевтическом производстве используют следующие основанные на физико-химических свойствах алкалоидов методы: вакуум-разгонку, дробную кристаллизацию, жидкостную экстракцию, сорбцию и избирательное элюирование (десорбцию) [7].
Последнее, что необходимо сделать, это провести собственно количественное определение алкалоида. Его проводят различными способами: гравиметрическим, титриметрическим и физико-химическим методами, включающими в себя фотоэлектроколориметрический метод (клубни с корнями Stephania glabra (Roxb.) Miers, трава Glaucium flavum Crantz.), спектрофотометрический метод (трава Thermopsis lanceolata R.Br.) и полярографический метод (семена Thermopsis lanceolata R.Br.).
Прежде чем выпустить новый лекарственный растительный препарат, необходимо провести тщательное изучение его производящих компонентов – лекарственного растительного сырья и содержащихся в нем биологически активных веществ – с целью определения фармакологической группы будущего лекарственного средства.
Алкалоид зонгорин, выделенный из различных видов Aconitum (A. Barbatum Pers., A. soongaricum Stapf., A. monticola Steinb., A. karakolicum Rapaics.), относящихся к семейству Ranunculaceae, обладает анксиолитической активностью [8]. По сравнению с другими лекарственными препаратами этой группы (ксанакс, феназепам), имеющими побочные эффекты, зонгорин не вызывает серьезных последствий и может применяться при лечении тревожных состояний. В этом заключаются перспективы использования данного алкалоида в качестве основного действующего компонента для лекарственного препарата. Результаты его разработок пока неизвестны.
Седативное действие проявляет алкалоид гиндарин, содержащийся в корнях Stephania glabra (Roxb.) Miers, принадлежащей семейству Menispermaceae. В качестве лекарственного препарата используют его производное – гиндарина гидрохлорид. Помимо оказания седативного действия он снижает артериальное давление, вызывает миорелаксацию и в больших дозах способен выступать в роли транквилизатора. Для производства пероральных препаратов гиндарина используют различные вспомогательные вещества [9]. Это необходимо для того, чтобы препарат более длительное время сохранял свою фармакологическую активность и не подвергался каким-либо химическим изменениям.
Растения семейства Fabaceae – Thermopsis lanceolata R.Br. и Cytisus ruthenicus Fisch. ex Wol. – применяются в качестве лекарственного растительного сырья для получения таких препаратов, как цититон и табекс. Их активным компонентом является алкалоид цитизин, который обладает стимулирующей и антитабачной активностью. Показаниями к применению цититона выступают асфиксия, шоковые, коллаптоидные состояния и ослабление дыхательной и сердечно-сосудистой деятельности при различных интоксикациях химическими веществами. Табекс назначают как средство для лечения никотиновой зависимости. Помимо цитизина схожей активностью обладает алкалоид лобелин, извлекаемый из Lobelia inflata L. (семейство Campanulaceae), который входит в состав препаратов лобелина гидрохлорид и лобесил. Кроме того, производные цитизина способны оказывать другие фармакологические свойства, не характерные для самого алкалоида – гиполипидемические, противовоспалительные, холинотропные, гемостатические, антиаритмические [10].
В медицинской практике используют такое химическое соединение, как стрихнина нитрат. Это производное алкалоида растения семейства Loganiaceae – Strychnos nux-vomica L. Он оказывает стимулирующее влияние на спинной мозг, возбуждает дыхательные и сосудодвигательные центры, усиливает функцию анализаторов, т.е. обладает адаптогенной, общетонизирующей активностью. Данный препарат назначают внутрь или внутривенно (инъекции). Также существуют другие лекарственные формы – настойка и экстракт чилибухи сухой, применяемые внутрь. Но оказывать свое терапевтическое действие алкалоид стрихнин может только в небольших концентрациях. Превышение допустимых концентраций приводит к серьезному отравлению, способному вызвать гибель организма.
Алкалоид глауцин, содержащийся в Glaucium flavum Crantz. семейства Papaveraceae, обладает противокашлевым, бронхолитическим и антиоксидантным действием. Проведенные исследования доказывают, что производное этого алкалоида (изомер дес-глауцин) имеет более выраженное антиоксидантное действие, чем исходный природный компонент [11]. Данных о его препаратах нет. Но препараты самого алкалоида глауцина существуют – это глаувент и глауцина гидрохлорид. В комбинации с другими алкалоидами (эфедрин, который содержится в различных видах рода Ephedra семейства Ephedraceae) и прочими соединениями глауцин входит в состав бронхотона, бронхолитина и бронхоцина.
За последние столетия медицина продвинулась далеко вперед. Сейчас человечеству известны способы профилактики и лечения многих заболеваний, ранее считавшихся неизлечимыми. Но и по сей день существуют болезни, справиться с которыми современным врачам непросто. Ярким примером этого являются онкологические заболевания. С каждым годом во всем мире наблюдается прирост пациентов с данным диагнозом, что обусловлено различными факторами. Для лечения доброкачественных и злокачественных опухолей используют химиотерапевтические, гормональные, противовирусные и многие другие препараты. Важнейшими из них являются растительные препараты, которые в меньшей степени, чем синтетические препараты, способны пагубно воздействовать на организм больного. Данная особенность является немаловажной и, несомненно, должна учитываться лечащим врачом. В лечении онкологических заболеваний применяют некоторые виды алкалоидов. Это винбластин, извлекаемый из Vinca rosea L., который относится к семейству Apocynaceae, и паклитаксел, выделяемый из коры Taxus brevifolia Nutt. семействаTaxaceae [12]. Доказано, что сумма алкалоидов A. baicalense Turcz. exRapaics, настойка и настой, обуславливают противоопухолевое и противометастатическое действие [13].
Заключение
Результаты, полученные в ходе исследования информационно-поисковых и библиотечных баз данных исследовательской литературы, показали, что алкалоиды способны оказывать множество различных фармакотерапевтических эффектов. Они могут влиять на различные системы органов и протекающие в человеческом организме процессы. Препараты алкалоидов оказывают действие на сердечно-сосудистую и центральную нервную системы, периферические нейромедиаторные процессы и афферентные нервные окончания. Вероятно, такое богатство терапевтических действий обусловлено сложным и разнообразным химическим строением данных биологически активных веществ. Кроме того, были рассмотрены основы производства лекарственных препаратов алкалоидов. Они имеют свои особенности в зависимости от того, на основе какого представителя хотят произвести/изготовить лекарственное средство. Проанализированные исследования и клинические испытания позволяют прийти к выводу, что ученым известно еще не так много об этой группе веществ. Обладая столь широким спектром терапевтического действия, алкалоиды способны стать действующими веществами лекарственных препаратов многих фармакологических групп. Таким образом, использование данных биологически активных веществ является перспективным в современной медицине.
Источник