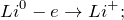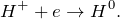- Реакция лития и воды
- Реакция взаимодействия лития и воды.
- Уравнение реакции взаимодействия лития и воды:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Свойства лития. Реакции воды и некоторых кислот с литием
- Физические свойства лития
- Химические свойства
- Li + H2O = ? уравнение реакции
- Литий вода что получится
- Литий вода что получится
- Реакция лития, натрия, калия с водой
Реакция лития и воды
Реакция взаимодействия лития и воды.
Уравнение реакции взаимодействия лития и воды:
Литий и вода взаимодействуют друг с другом.
Реакция лития и воды протекает при обычных условиях.
Реакция протекает бурно.
В результате реакции лития и воды образуются гидроксид лития и водород .
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 481)
- Экономика Второй индустриализации России (102 474)
- Программа искусственного интеллекта ЭЛИС (27 488)
- Метан, получение, свойства, химические реакции (23 723)
- Этилен (этен), получение, свойства, химические реакции (22 769)
- Природный газ, свойства, химический состав, добыча и применение (21 156)
- Крахмал, свойства, получение и применение (20 565)
- Целлюлоза, свойства, получение и применение (19 410)
- Пропилен (пропен), получение, свойства, химические реакции (19 073)
- Прямоугольный треугольник, свойства, признаки и формулы (18 723)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Свойства лития. Реакции воды и некоторых кислот с литием
C какими веществами реагирует литий
Литий — металл первой группы второго периода в таблице Менделеева — был открыт в 1817 году. Сделал это открытие шведский ученый Иоганн Аугуст Арфведсон, когда он исследовал разные минералы. Элемент этот находился в петалите, сподумене и лепидолите. Немного позднее, в 1818 году, Гемфри Деви получил металлический литий.
Литий и его соединения являются незаменимыми химическими элементами в жизни человека. Литий используется во многих промышленных сферах:
- в производстве химических источников тока;
- в пиротехнике: нитрат лития придает огню красный цвет;
литий часто используется как металл для сплавов — с ним получаются легкие, но в тоже время прочные припои;
также литий используют в радиоэлектронике и ядерной энергетике;
в медицине широко применяют соли лития.
Вообще, в небольших количествах литий необходим для здоровья человека и поддерживает функционирование жизненно важных органов, таких как сердце, печень и легкие.
И это далеко не все сферы, где применяется этот металл и его соединения.
Физические свойства лития
Литий представляет собой щелочной металл серебристо-белого цвета. Он пластичен и легко поддается обработке: кубик металлического лития можно разрезать ножом.
Примечательно, что литий является единственным металлом из этой группы, который кипит и плавится при довольно высоких температурах: 1340 и 180,54 °С соответственно. Но также примечательно, что, по сравнению с «щелочными соседями», у лития самая низкая плотность (она в два раза меньше плотности воды). Из-за этого свойства литий не тонет даже в керосине.
Химические свойства
Литий относится к щелочной группе металлов, однако он устойчиво ведет себя на воздухе и практически не взаимодействует с кислородом, даже с сухим . Из-за необычных свойств лития — в отличие от других щелочных металлов — его не хранят в керосиновой жидкости. Кроме того, из-за малой плотности он держался бы на плаву. Хранить литий стоит в парафине, петролейном эфире, газолине или минеральном масле в герметичной жестяной упаковке.
Во влажном воздухе литий может вступать в медленные реакции с азотом и другими газами, которые входят в состав воздуха. При этом образуется: Li₃N, LiOH и Li₂CO₃ — нитрид, гидроксид и карбонат соответственно.
Другие химические свойства лития
При нагревании с кислородом литий сгорает с образованием оксида лития Li₂O.
Литий и его соли окрашивают пламя в карминно-красный цвет.
Такая качественная реакция на литий была установлена Леопольдом Гмелином в 1818 году.
При температурах от 100 до 300 °С на поверхности лития образуется плотная оксидная пленка, которая защищает металл от дальнейшего окисления. Литий легко реагирует с галогенами (кроме йода).
С водой литий реагирует спокойно: реакция не сопровождается возгоранием или взрывом.
Литий взаимодействует со спиртами, образуя алкоголяты.
При нагревании реагирует с серой, кремнием, йодом, водородом с образованием сульфида, силицида, йодида и гидрида лития.
Реакция лития с водой
Реакция проходит довольно спокойно. Если литий — как и все щелочные металлы — опустить в воду, начнет образовываться щелочь и выделяться водород, а металл будет плавать на поверхности и буквально таять на глазах. Реакция растворения лития в воде сопровождается характерным шипением.
Щелочь, образующаяся в растворе, — гидроксид лития LiOH. Он представляет собой кристаллы белого цвета и является довольно сильным основанием:
2Li + 2H₂O → 2LiOH + H₂↑
Реакция лития и серной кислоты
Если добавить небольшую пластинку лития в концентрированную серную кислоту, получится сульфат лития, сероводород и вода.
Внимание! Не пытайтесь повторить этот опыт самостоятельно! Здесь вы найдете безопасные эксперименты, которые можно проводить дома.
Сама по себе реакция опасна, особенно в домашних условиях, поскольку литий моментально загорается ярким пламенем:
8Li + 5H₂SO₄ → 4Li₂SO₄ + Н₂S + 4H₂O
С разбавленной серной кислотой литий взаимодействует с образованием сульфата лития и водорода.
2Li + H₂SO₄ → Li₂SO₄ + Н₂
Реакция лития с азотной кислотой
Если опустить кусочек лития в разбавленную азотную кислоту, образуется нитрат лития, нитрат аммония и вода:
8Li + 10HNO₃ → 8LiNO₃ + NH₄NO₃ + 3H₂O
С концентрированной азотной кислотой литий реагирует иначе. Продуктами реакции будут нитрат лития, вода и диоксид азота:
Li + 2HNO₃ → LiNO₃ +NO₂ + H₂O
Реакция с соляной кислотой
С соляной кислотой литий реагирует как и другие металлы — образуется хлорид лития и выделяется водород:
2Li + 2HCl = 2LiCl + H₂
Стоить отметить, что реакция лития и других щелочных металлов с кислотами идет неоднозначно, поскольку в растворах кислот содержится вода, с которой литий активно взаимодействует с образованием гидроксида лития, который вступает в реакцию с кислотами с образованием соли и воды.
Источник
Li + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме Li + H2O = ? Запишите молекулярное и уравнение реакции. Охарактеризуйте химический элемент литий: запишите его электронную конфигурацию, укажите основные физические и химические свойства, а также способы получения.
В результате взаимодействия лития с водой (Li + H2O = ?) происходит образование гидроксида лития и выделение газа водорода. Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы литий и водород изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Литий – третий элемент Периодической таблицы. Обозначение – Li от латинского «lithium». Расположен в во втором периоде в IA группе. Относится к группе щелочных металлов. Заряд ядра равен 3. Электронная конфигурация выглядит следующим образом:
Литий достаточно широко распространен в земной коре. Наиболее ценны минералы сподумен 


В виде простого вещества литий представляет собой металл серебристо-белого цвета. Является самым легким из металлов (плотность 0,539 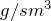

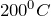
Для получения лития в промышленных масштабах наиболее часто используют его минералы, в лаборатории же – электролиз расплава хлорида лития в смеси хлоридов бария и калия.
Источник
Литий вода что получится
Реакция лития с водой
Рубидий и цезий реагируют с водой со взрывом. Если бросить в воду маленькие кусочки калия, они загораются, а кусочки побольше взрываются. Крохотные (с пшеничное зерно) кусочки натрия реагируют с водой спокойно, кусочки большего размера (примерно с горошину) плавятся и загораются, а еще большего (примерно с фасолину) — плавятся, загораются и взрываются.
Литий — наименее активный щелочной металл. В отличие от соседей по группе он реагирует с водой без плавления, воспламенения или взрыва. В прошлом номере журнала было описано несколько вариантов реакции лития с водой ссылка.
Водород, который при этом выделяется, можно поджечь. Благодаря брызгам гидроксида лития пламя окрашивается в красивый малиновый цвет.
Для реакции с водой мы взяли несколько кусочков лития, самый маленький был объемом примерно 0.5см 3 , самый большой — 1см 3 . Первое, что обратило на себя внимание — литий режется ножом не так легко как натрий.
Когда кусочки бросили в воду, началась бурная реакция: литий стал плавать по поверхности воды, выделяя пузырьки водорода. Бросалось в глаза, что металл исключительно легкий: он плавал по поверхности воды, почти как пенопласт. По сравнению с натрием реакция шла заметно медленнее, в отличие от натрия литий не плавился. Образовывалось много брызг и аэрозоля щелочи, который сильно раздражал органы дыхания.
Оставалось самое красивое: наблюдать малиновое пламя, но, увы: все попытки поджечь водород (зажигалкой или спичкой) оказались безрезультатны — брызги и аэрозоль гасили пламя.
Источник
Литий вода что получится
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Лектор — Загорский Вячеслав Викторович — ст.н.сотр., к.х.н., д.п.н.
Реакция лития, натрия, калия с водой
Посмотреть видео:
2Na + 2H 2 O = 2NaOH + H 2 + Q
2K + 2H 2 O = 2KOH + H 2 + Q
2K + 2H 2 O = K 2 O 4 + Q
В бытовых микроволновых (сверхвысокочастотных или СВЧ) печах используются микроволны, частота f которых составляет 2450 МГц. Длина волны L микроволнового излучения данной частоты: L = c/f = 12,25 см.
Поле, в котором находятся полярные молекулы воды, меняет полярность 4 900 000 000 раз в секунду; с такой же частотой движутся молекулы и в буквальном смысле трутся одна о другую. Выделяющееся при этом тепло и служит причиной разогрева пищи. Прогрев воды в микроволновых печах осуществляется равномерно. Если вода была предварительно пропущена через бытовой фильтр, в ней практически отсутствуют взвешенные частицы. Поэтому в данных условиях в воде отсутствуют центры парообразования, и ее можно перегреть в чистом стакане на несколько градусов выше температуры кипения. При внесении в воду растворимого кофе (центры парообразования) вода бурно вскипает.
Внимание! Категорически не рекомендуется повторять этот эксперимент в домашних условиях! Возможна поломка СВЧ-печки и ожоги. Греть воду в СВЧ-печке можно только в стакане с чайной ложкой.
Автор (постановка, съемка, монтаж)
Загорский В.В.
Ассистент
Петрова Е.П.
Подготовка Интернет-публикации
Миняйлов В.В.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Источник