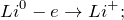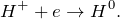- Li + H2O = ? уравнение реакции
- Гидрид лития: способы получения и химические свойства
- Способ получения
- Химические свойства
- Реакция лития и воды
- Реакция взаимодействия лития и воды.
- Уравнение реакции взаимодействия лития и воды:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Гидроксид лития: способы получения и химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
Li + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме Li + H2O = ? Запишите молекулярное и уравнение реакции. Охарактеризуйте химический элемент литий: запишите его электронную конфигурацию, укажите основные физические и химические свойства, а также способы получения.
В результате взаимодействия лития с водой (Li + H2O = ?) происходит образование гидроксида лития и выделение газа водорода. Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы литий и водород изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Литий – третий элемент Периодической таблицы. Обозначение – Li от латинского «lithium». Расположен в во втором периоде в IA группе. Относится к группе щелочных металлов. Заряд ядра равен 3. Электронная конфигурация выглядит следующим образом:
Литий достаточно широко распространен в земной коре. Наиболее ценны минералы сподумен 


В виде простого вещества литий представляет собой металл серебристо-белого цвета. Является самым легким из металлов (плотность 0,539 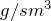

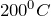
Для получения лития в промышленных масштабах наиболее часто используют его минералы, в лаборатории же – электролиз расплава хлорида лития в смеси хлоридов бария и калия.
Источник
Гидрид лития: способы получения и химические свойства
Гидрид лития LiH — неорганическое бинарное соединение щелочного металла лития и водорода, белого цвета, легкий, плавится без разложения, разлагается при дальнейшем нагревании.
Относительная молекулярная масса = 7, 95; относительная плотность для тв. и ж. состояния = 0, 82; tпл = 680◦ C
Способ получения
Гидрид лития получают реакцией взаимодействия лития и водорода:
2Li + H2 = 2LiH
Химические свойства
Гидрид лития белый, легкий, плавится без разложения, разлагается при дальнейшем нагревании.
1. Гидрид лития — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. При взаимодействии с кислородом гидрид лития образует гидроксид лития:
2LiH + O2 = 2LiOH
1.2. Гидрид лития взаимодействует с хлором , образуя хлорид лития и хлороводород:
LiH + Cl2 = LiCl + HCl
1.3. Гидрид лития реагирует с серой с образованием сульфида лития и сероводорода:
2LiH + 2S = Li2S + H2S
1.4. При взаимодействии гидрида лития и азота образуется нитрид лития и аммиак:
1.5. Взаимодействуя с углеродом (графитом) гидрид лития образует ацетиленид лития и ацетилен:
2. Гидрид лития взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид лития образует гидроксид лития и газ водород:
LiH + H2O = LiOH + H2↑
2.2. С хлороводородной кислотой гидрид лития реагирует при комнатной температуре с образованием хлорида лития и водорода:
LiH + HCl(разб.)= LiCl + H2↑
2.3. Гидрид лития может реагировать с такими оксидами , как:
2.3.1. Оксидом серы IV , образуя сульфат лития и хлороводород:
2.3.2. Оксидом кремния , с образованием силиката лития, кремния и водорода:
2.4. Гидрид лития реагирует с аммиаком с образованием нитрида лития и водорода:
Источник
Реакция лития и воды
Реакция взаимодействия лития и воды.
Уравнение реакции взаимодействия лития и воды:
Литий и вода взаимодействуют друг с другом.
Реакция лития и воды протекает при обычных условиях.
Реакция протекает бурно.
В результате реакции лития и воды образуются гидроксид лития и водород .
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 482)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 489)
- Метан, получение, свойства, химические реакции (23 725)
- Этилен (этен), получение, свойства, химические реакции (22 782)
- Природный газ, свойства, химический состав, добыча и применение (21 160)
- Крахмал, свойства, получение и применение (20 569)
- Целлюлоза, свойства, получение и применение (19 411)
- Пропилен (пропен), получение, свойства, химические реакции (19 080)
- Прямоугольный треугольник, свойства, признаки и формулы (18 725)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Гидроксид лития: способы получения и химические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
Способы получения
1. Гидроксид лития получают электролизом раствора хлорида лития :
2LiCl + 2H2O → 2LiOH + H2 + Cl2
2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
2LiH + 2H2O → 2LiOH + H2
3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
Качественная реакция
Качественная реакция на гидроксид лития — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид лития реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид лития реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
Сера взаимодействует с гидроксидом лития только при нагревании:
6. Гидроксид лития взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
7. Гидроксид лития вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
Также с гидроксидом лития взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида лития образуются хлорид лития, аммиак и вода:
NH4Cl + LiOH = NH3 + H2O + LiCl
8. Гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Гидроксид лития проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
LiOH ↔ Li + + OH —
10. Гидроксид лития в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4LiOH → 4Li + O2 + 2H2O
Источник