- § 4. Чистые вещества и смеси
- 1. Как влияет наличие примесей в воде на температуру ее кипения?
- 2. Представьте себе, что из путешествия вы привезли домой в качестве сувенира две одинаковые бутыли, в одной из которых вода из Средиземного, а в другой — из Мертвого моря. Как с помощью термометра можно определить, где какая вода находится?
- 3. Загляните внутрь чайника, в котором долго кипятилась водопроводная вода, и сделайте вывод, является ли она чистым веществом.
- 4. Приведите по пять примеров известных вам однородных и неоднородных смесей.
- 5. Однородная или неоднородная смесь образуется при смешивании воды с: а) сахаром; б) мукой; в) растительным маслом; г) поваренной солью; д) уксусом?
- 6. Чем различаются между собой вещества, смесь которых можно разделить: а) отстаиванием; б) фильтрованием; в) выпариванием; г) перегонкой?
- 7. Для засолки овощей приготовили смесь, состоящую из соли массой 25 г и сахара массой 15 г. Чему равны массовые доли компонентов данной смеси?
- 8. Как бы вы разделили смесь сахара, песка и древесных опилок? Составьте план разделения, кратко опишите каждый его этап и расскажите об ожидаемых результатах.
- Химические смеси: виды, названия, интересные факты
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Масло с водой однородная или неоднородная смесь
§ 4. Чистые вещества и смеси
1. Как влияет наличие примесей в воде на температуру ее кипения?
Наличие примесей приводит к изменению температуры кипения. Когда в жидкости растворяется летучее вещество, температура кипения воды понижается, в противном случае вода закипает при более высокой температуре.
2. Представьте себе, что из путешествия вы привезли домой в качестве сувенира две одинаковые бутыли, в одной из которых вода из Средиземного, а в другой — из Мертвого моря. Как с помощью термометра можно определить, где какая вода находится?
Возьмем образцы воды из Мертвого и Средиземного морей. При нагревании вода испаряется, соль остается. Большее количество соли укажет на образец из Мертвого моря.
3. Загляните внутрь чайника, в котором долго кипятилась водопроводная вода, и сделайте вывод, является ли она чистым веществом.
Если после кипячения водопроводной воды внутри чайника появилась накипь (белый налет), то можно сделать вывод, что вода не является чистым веществом.
4. Приведите по пять примеров известных вам однородных и неоднородных смесей.
| Однородные смеси | Неоднородные смеси |
| Водопроводная вода, бензин, воздух, минеральная вода, раствор сахара и соли в воде, растительное масло | Молоко, бетон, зубная паста, асфальт, шоколад, краски |
5. Однородная или неоднородная смесь образуется при смешивании воды с: а) сахаром; б) мукой; в) растительным маслом; г) поваренной солью; д) уксусом?
Однородная смесь: сахар с водой, поваренная соль с водой, уксус с водой.
Неоднородная смесь: мука с водой, растительное масло с водой.
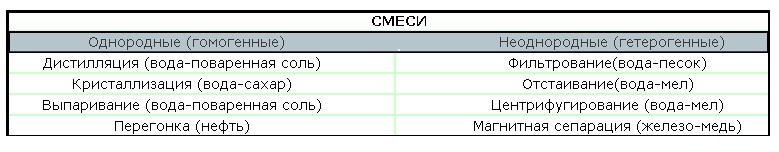
6. Чем различаются между собой вещества, смесь которых можно разделить: а) отстаиванием; б) фильтрованием; в) выпариванием; г) перегонкой?
а) отстаивание основано на различной плотности компонентов смеси;
б) фильтрование — на способности пористых материалов задерживать некоторые частицы, его применяют для разделения смесей твердых и жидких веществ;
в) выпаривание основано на различии температур кипения компонентов смеси и используют его для разделения твердых и жидких веществ;
г) перегонка основана на разности температур кипения компонентов смеси.
7. Для засолки овощей приготовили смесь, состоящую из соли массой 25 г и сахара массой 15 г. Чему равны массовые доли компонентов данной смеси?
Дано:
m(сахара) = 15 г
m(соли) = 25 г
Найти:
Решение:
w(сахара) = m(сахара) : m(смеси)
w(соли) = m(соли) : m(смеси)
m(смеси) = m(сахара) + m(соли)
m(смеси) = 25 г + 15 г = 40 г
w(сахара) = 15 г : 40 г = 0,375 или 37,5%
w(соли) = 25 г : 40 г = 0,625 или 62,5%
Ответ: w(сахара) = 0,375; w(соли) = 0,625.
8. Как бы вы разделили смесь сахара, песка и древесных опилок? Составьте план разделения, кратко опишите каждый его этап и расскажите об ожидаемых результатах.
В смесь сахара, песка и древесных опилок добавим воду. В результате сахар растворится, песок осядет на дно, древесные опилки всплывут на поверхности. Таким образом, древесные опилки отделяются от неоднородной смеси (сахар, песок, вода). Фильтрованием можно отделить песок от однородной смеси (сахар, вода). Методом выпаривания можно отделить воду от сахара, при нагревании летучая вода испаряется, а нелетучий сахар остается в виде твердого вещества.
Источник
Химические смеси: виды, названия, интересные факты
Одним из основных аспектов химии является сочетание различных веществ. Иногда сочетание веществ может вызвать химическую реакцию и связь, что создает совершенно новое вещество, которое называют соединением. Однако иногда нету химической реакции или связи. В этом случае из комбинированных веществ образуется смесь.
Смесь изготавливают тогда, когда объединяются два или более веществ. Каждое вещество, содержащееся в смеси, называют компонентом. При их смешивании новое вещество не образуется. А чтобы узнать о других сочетаниях веществ, где происходит химическая реакция или связь, читайте учебник по химии за 7 класс О.В. Григоровича.
Компоненты смеси можно легко отделить.
Каждый компонент сохраняет свои первоначальные свойства.
Доля компонентов изменчива.
Существуют однородные (гомогенные) и неоднородные (гетерогенные) смеси. В однородной смеси все вещества равномерно распределяются по всей смеси. Частицы других веществ в них невозможно обнаружить даже с помощью микроскопа (соленая вода, воздух, кровь).
В неоднородной смеси вещества не равномерно распределены (шоколадное печенье, пицца, масло в воде). Такие смеси формируют дисперсные системы. Компоненты дисперсных систем называют дисперсионной средой и дисперсной фазой.
К однородным смесям относятся смеси газов, растворы, сплавы, а к неоднородным – суспензии и коллоиды.
Раствор – это смесь, где одно из веществ растворяется в другом. Вещество, которое растворяется, называется растворимым веществом. Вещество, которое не растворяется, называется растворителем.
Пример раствора – соленая вода. Эти компоненты можно легко отделить путем испарения, и каждый из них сохраняет свои первоначальные свойства. Однако соль равномерно распределяется в воде. В этом примере вода является растворителем, а соль – растворимым веществом.
Следует заметить, чтобы приготовить раствор, нужно газообразное, жидкое или твердое вещество смешать с растворителем (водой, спиртом, ацетоном).
Есть разница между раствором и смесью. В химии раствор – это тип смеси. Раствор – это смесь, которая одинакова или равномерная в течение всего времени. Смесь, которая не является раствором, не является равномерной в течение всего времени. Например, песок в воде – это гетерогенная смесь.
Сплав – это смесь элементов, которая имеет характеристику металла. По крайней мере один из смешанных элементов – это металл. Примером является сталь, которая изготавливается из смеси железа и углерода. Узнать о других сплавах можно в учебнике по химии 7 класс Г.А. Лашевской.
Суспензия – это смесь жидкости или газа и частиц твердого вещества, которые не растворяются. Эти частицы «подвешены» в жидкости. Основная характеристика суспензии заключается в том, что твердые частицы со временем оседают и отделяются, если их оставить в покое.
Примером суспензии является смесь воды и песка. При смешивании песок будет рассеиваться по всей воде. Если его оставить в покое, песок оседает на дно.
Коллоид – это смесь, где очень маленькие частицы одного вещества равномерно распределяются по всему остальному веществу. Они выглядят очень похожими на растворы, но частицы суспендуються, а не полностью растворяются.
Разница между коллоидом и суспензией заключается в том, что частицы в течение определенного периода пор не будут оседать на дне, они останутся взвешенными или плавающими.
Примером коллоида является молоко. Молоко – это смесь жидкого жира, рассеянного и суспендированного в воде. Коллоиды, как правило, считаются неоднородными смесями, но имеют и некоторые качества однородных.
Интересные факты о смесах:
Дым – это смесь частиц, что суспендуються в воздухе.
Вода из крана – это смесь воды и других частиц. Чистую воду или H2O обычно называют дистиллированной водой.
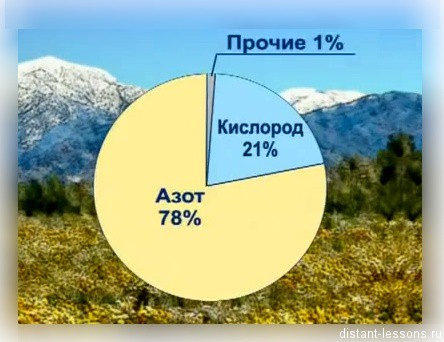
Многие вещества, с которыми мы сталкиваемся каждый день, – это смеси. Воздух, которым мы дышим, – это смесь газов, таких как кислород и азот.
Кровь – это смесь, которую можно разделить центрифугой на две ее основные части: плазму и эритроциты.
Смеси могут быть жидкостями, газами и твердыми веществами.
Не можете выполнить задание из учебника или рабочей тетради? Тогда вам в этом помогут ГДЗ и решебники по химии за 7 класс.
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ
Начнем с определений
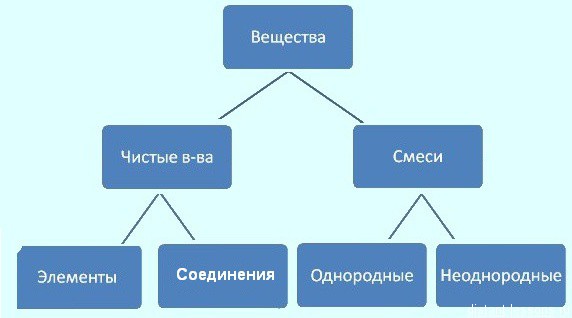
Чистое вещество состоит из молекул одного вида.
Чистые вещества могут быть элементного состава (т.е. состоять из элементов одного вида) — простые вещества:
Чистые вещества — соединения — сложные вещества — состоят из молекул одного вида.
В природе не существует абсолютно чистых веществ. Например, особо чистый алюминий содержит 0,001% примесей.
Даже когда мы считаем воду чистой, то должны понимать, что там есть примеси. Даже дистиллированная вода не может считаться абсолютно чистым веществом — это тоже смесь, только примесей в ней намного меньше, чем в обычной воде.
Фильтрованная вода — тоже не чистое вещество, а смесь растворимых компонентов и воды, водопроводная — тем более!
Смеси — содержит молекулы нескольких видов.
Вещества, составляющие смесь, могут быть простыми и сложными .
Запомните: если вам дана задачи и в условии этой задачи дана смесь веществ, то вещества из этой смеси не реагируют друг с другом !
Однородные смеси (гомогенные)
«Гомо» — означает «одинаковый». Т.е. вещества в гомогенной смеси находятся в одинаковых агрегатных состояниях ( в одинаковых фазах):
Воздух — пример однородной газовой смеси (если учитывать именно газовый состав, частички пыли и т.п. мы здесь не учитываем), молярная масса воздуха принята равной 29 г\моль.
Все растворы — однородные смеси растворимого вещества и растворителя.
Неоднородные смеси (гетерогенные)
Неоднородная смесь — это смесь, где вещества находятся в разных фазах.
- Суспензия: тв. фаза+ жидка фаза; существует только в «смешанном» виде. Если такую смесь оставить на время. то под действием силы тяжести твердые частички осядут. Примеры: зубная паста, гуашь, эмалевые краски и т.д.
- Эмульсия — смесь двух жидкостей разной плотности. Со временем четко разделяются на две фазы. Примеры: жидкость для снятия макияжа, масло в воде, молоко и т.д.
- Аэрозоль — смесь газа и жидкости. Самый известный пример — туман или лак для волос.
С определениями чистых веществ и смесей мы определились, теперь давайте разберем способы разделения смесей.
- Химический способ разделения смеси: в реакцию вводится вещество, реагирующее с одним компонентом и не взаимодействующее с другим. В идеале образующееся новое вещество может образовывать другую фазу, чтобы его можно было легко удалить (осадок или газ).
Еще одно важное отличие чистых веществ от смесей — температуры плавления и кипения:
Чистые вещества
Смеси
имеют четкие температуры плавления и кипения
Источник
Масло с водой однородная или неоднородная смесь
Каждый из нас в повседневной жизни имеет дело как с чистыми, так и с загрязненными веществами и, конечно же, со смесями веществ. Данный урок посвящен изучению понятий «чистое вещество», «загрязненное вещество», «смесь веществ». Вы научитесь по определенным признакам различать чистые вещества и смеси веществ.
I. Понятие “компонент”, “смесь”, “примесь”
В повседневной жизни каждый из нас сталкивается со множеством смесей веществ, имеет дело не только с чистыми, но и загрязненными веществами. Важно уметь различать данные понятия и уметь определять по конкретным признакам, с чем имеешь дело: чистым или загрязненным веществом, индивидуальным веществом или смесью веществ. Ведь человек хочет употреблять только ту воду, которая не содержит вредных примесей. Дышать мы хотим воздухом, не загрязненным вредными для здоровья газами. В медицине и производстве лекарственных препаратов проблема получения и использования чистых веществ особенно актуальна.
Познакомимся с основными терминами урока.
«Смесь – целостная система, состоящая из разнородных компонентов».
Смесь – это то, что образуется при перемешивании двух и более различных по свойствам веществ.
Вещества, составляющие смесь, называют компонентами. Например, воздух – смесь газов: азота, кислорода, углекислого газа и других.
Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью. Говорят, что вещество загрязнено. Например, воздух может быть загрязнен угарным газом, продуктом неполного сгорания органических соединений, в частности бензина. Кстати, бензин – это смесь органических веществ – углеводородов.
Смеси отличаются друг от друга по внешнему виду. Например, соленая вода (смесь поваренной соли и воды) и смесь речного песка и воды. В первом случае нельзя увидеть границы раздела фаз твердое-жидкое. Такую смесь называют однородной (или гомогенной). Другими примерами однородных смесей являются уксус (смесь уксусной кислоты и воды), воздух, сахарный сироп.
Смесь речного песка и воды относят к неоднородным (или гетерогенным) смесям, т.к. состав такой смеси неодинаков в разных точках объема. Неоднородными являются смеси глины и воды, бензина и воды.
В суспензиях видны частицы твердого вещества, в эмульсиях – капельки жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах компоненты не различимы, они являются однородными (гомогенными) смесями.
II. Степень частоты вещества
Если примеси не обнаруживаются при использовании вещества в технических целях, то вещество называется технически чистым. Например, вещество, из которого делают фиолетовые чернила, может иметь в своем составе примеси. Но если эти примеси никак не влияют на качество чернил, то оно — технически чистое.
Если примеси не обнаруживаются с помощью химических реакций, то вещество относят к химически чистым. Например, это дистиллированная вода.
III. Способы разделения смесей
В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей
Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных и гомогенных смесей.
| Пример смеси | Способ разделения |
| Смесь песка и поваренной соли в воде | |
| Смесь порошка железа и серы | |
| Раствор соли в воде – гомогенная смесь | |
| Смесь красных чернил | |
| Активированный уголь |