Химические процессы в алюминиевых радиаторах
Хорошо известны сомнения проектировщиков и монтажников относительно приемлемости установки алюминиевых радиаторов в той или иной отопитель-ной системе. В одних случаях они беспроблемно работают долгие годы, в других — постоянно заполняются каким-то газом, корродируют и в результате довольно быстро разрушаются. Из-за чего это происходит? О причинах химических процессов, происходящих в отопительных приборах из алюминия, мы и поговорим в данной статье.
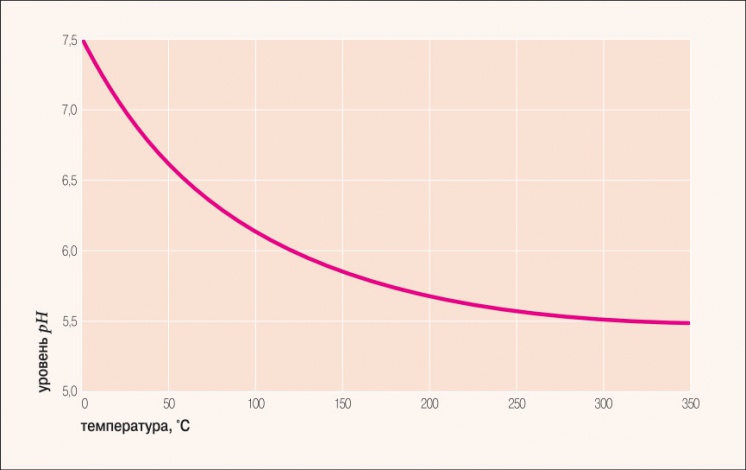
Рис. 1. Водородный показатель дистиллированной воды в зависимости от температуры
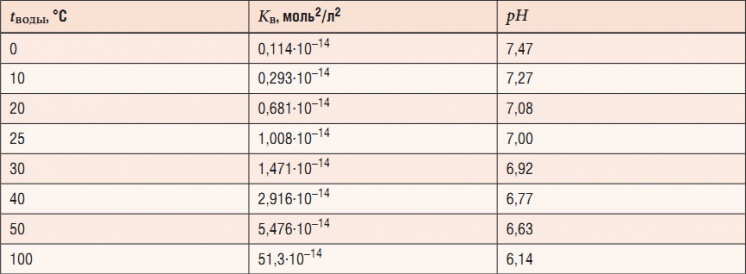
Табл. 1. Значения нейтрального pH в чистой воде при различных температура
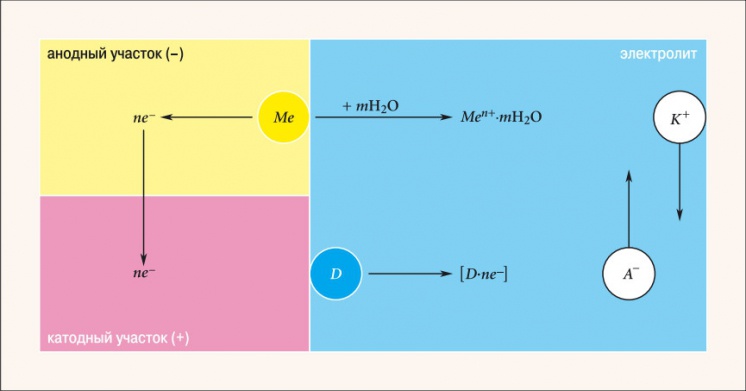
Рис. 2. Схема электрохимического коррозионного процесса
Табл. 2. Значения электродных потенциалов некоторых элементов
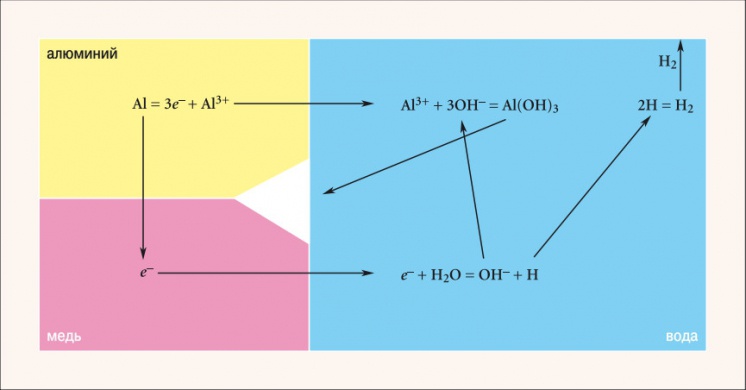
Рис. 3. Схема процесса коррозии при контакте алюминия и меди
Алюминиевые радиаторы очень удобны: они компактны, эстетичны, обладают малой инерционностью и очень высокой теплоотдачей. Теплопроводность изделий из алюминиевых сплавов — 202–236 Вт/(м⋅K). Из металлов, используемых для изготовления радиаторов, выше эта величина только у меди: 382–390 Вт/(м⋅K). У других материалов теплопроводность ниже в разы. При этом алюминий как сырье примерно в два раза дешевле меди.
В то же время с алюминиевыми радиаторами связано множество предрассудков, основанных на незнании потребителем природы химических процессов, происходящих внутри отопительной системы, — существует, например, устойчивое мнение, что с алюминиевыми радиаторами нельзя использовать медные и оцинкованные трубы. Но почему и какому из материалов от этого будет хуже — знают не все. Известно также, что алюминий предъявляет высокие требования к pH теплоносителя. Насколько это серьезно и чем грозит превышение? Попробуем разобраться.
Если не брать в расчет ошибки при расчетах максимального давления, гидроудары и производственный брак, самой распространенной проблемой в алюминиевых радиаторах является т.н. «завоздушивание», в результате которого повышается нагрузка на воздухоотводчик, увеличивается объем подпитки, при неблагоприятном раскладе может лопнуть секция.
На самом деле, выделяющийся газ — это водород H2, продукт взаимодействия алюминия с разнообразными веществами. Происходит данный процесс в трех случаях: реакция алюминия с теплоносителем-водой, реакция алюминия с теплоносителем-гликолем, электрохимическая коррозия алюминия.
Водородный показатель
В первую очередь, возникает вопрос, каким образом алюминий вообще может вступать в реакцию с чем бы то ни было: ведь на воздухе (т.е. сразу после изготовления на заводе) на его поверхности образуется тонкая прочная беспористая оксидная пленка Аl2О3, защищающая металл от дальнейшего окисления и обусловливающая его высокую коррозионную стойкость.
Кроме того, производители дополнительно покрывают внутренние поверхности радиаторов различными составами, препятствующими доступу теплоносителя к алюминию. Поэтому, чтобы «добраться» до металла, надо сперва разрушить оксид.
Самый простой способ — механическое воздействие твердых частиц, которые могут присутствовать в теплоносителе: они вызывают абразивный износ и разрушают защитный слой на внутренней поверхности прибора. Данная проблема легко решается установкой фильтров и грязевиков в нужных местах отопительной системы.
Более интересную ситуацию представляет собой «химическая атака». Она связана с амфотерностью оксида алюминия, т.е. его способностью проявлять как кислотные, так и основные свойства: взаимодействовать как с щелочами, так и с кислотами с образованием солей, хорошо растворимых в воде (это значит, что они не остаются на металле, а поступают в теплоноситель). Пример реакции с кислотой (свойства основного оксида):
Пример реакции с водным раствором щелочи (свойства кислотного оксида):
Взаимодействует оксид алюминия, правда, не со всеми соединениями: так, серная или азотная кислоты разрушения пленки не вызовут.
Важнейшим индикатором наличия в воде растворенных кислот является водородный показатель pH (по первым буквам латинских слов potentia hydrogeni — сила водорода или pondus hydrogenii — вес водорода) — концентрация ионов водорода H + в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов в молях на литр:
Вообще, в химии сочетанием pX принято обозначать величину, равную –lgX, а буква H в данном случае обозначает концентрацию ионов водорода H + . Несколько меньшее распространение получила обратная pH величина — показатель основности раствора pOH, равный отрицательному десятичному логарифму концентрации в растворе ионов OH – : pOH = –lg[OH – ].
В чистой воде при 25 °C величины концентрации ионов водорода H + и гидроксидионов OH – одинаковы и составляют 10 –7 моль/л. Это напрямую следует из определения ионного произведения воды, гласящего, что произведение концентраций ионов водорода Н + и ионов гидроксида OH – в воде или в водных растворах при определенной температуре равно константе Kв. Нормальными условиями принято считать 25 °C, при которых Kв = 10 –14 моль 2 /л 2 . Таким образом, при 25 °C — pH + pOH = 14.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксидионов, соответственно, уменьшается. При добавлении основания, наоборот, повышается содержание гидроксидионов, а концентрация ионов водорода падает. При [H + ] > [OH – ] раствор называют кислым, при [OH – ] > [H + ] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который и назвали водородным показателем pH.
При более высоких температурах константа диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH + , так и OH – ); при понижении температуры, напротив, нейтральный pH возрастает. В табл. 1 и на рис. 1 показаны изменения значения нейтрального pH в чистой воде в зависимости от температуры.
При сильных отклонениях значения pH от нейтрального можно с достаточной степенью уверенности говорить о наличии в воде растворенных кислот или оснований, которые могут вступать в реакцию с оксидом алюминия или с защитным покрытием, нанесенным производителем, разрушая их и обнажая алюминий. Из этого следует также, что применять химические реагенты для контроля жесткости теплоносителя в случае с алюминиевыми радиаторами надо с большой осторожностью. В идеале вода должна быть дистиллированной.
Реакция алюминия с теплоносителем
Если оксид алюминия Al2O3 с классическими окислителями в реакцию не вступает, сам алюминий после контакта с водой преобразуется в гидроксид (тоже, к слову, амфотерное соединение) с выделением водорода:
Если же pH теплоносителя далек он нейтрального, этот же газ будет выделяться в качестве продукта реакции алюминия с щелочами и некоторыми кислотами с образованием растворимых солей:
Если в качестве теплоносителя используется незамерзающая жидкость, то ситуация будет сходная. При взаимодействии водного раствора этиленгликоля, самого распространенного антифриза, с алюминием происходит замещение гидроксильного водорода на металл и выделение свободного водорода Н2.
Электрохимическая коррозия
Электрохимическая коррозия — наиболее распространенный вид коррозии металлов. При контакте двух металлов, обладающих разными электродными (электрохимическими) потенциалами и находящихся в электролите, образуется гальванический элемент (рис. 2). Поведение металлов зависит от значения их электродного потенциала. Металл Me, имеющий более отрицательный электродный потенциал (анод), переходит в качестве положительно заряженных ионов Men + в раствор. Избыточные электроны ne – перетекают по внешней цепи в металл, имеющий более высокий электродный потенциал (катод). Катод при этом не разрушается, а электроны из него ассимилируются какими-либо ионами или молекулами раствора (деполяризаторами D), способными к восстановлению на катодных участках. Чем ниже электродный потенциал металла по отношению к стандартному водородному потенциалу, принятому за нулевой уровень, тем легче металл отдает ионы в раствор, тем ниже его коррозионная стойкость. Значения электродного потенциала Е0 некоторых элементов приведены в табл. 2. Расположение металла выше (хотя обычно говорят «левее») водорода означает, что он способен вытеснить водород из соединений (воды, кислот и пр.).
Теперь рассмотрим конкретный пример: пару «медь–алюминий». Сразу отметим, что для возникновения разности потенциалов требуется непосредственный контакт двух металлов (алюминиевый радиатор и медный фитинг), а не просто наличие их в системе (алюминиевый радиатор, медный теплообменник, металлопластиковые трубы). Во втором случае имеет место разрыв цепи, поэтому электроны никуда перетекать не смогут. Использование диэлектрических вставок — самый надежный способ предотвращения неконтролируемой миграции заряженных частиц.
И еще одно замечание, касающееся направления движения электролита: реакция пойдет лишь в случае, если анод расположен «ниже по течению» относительно катода (медный фитинг на входе в алюминиевый радиатор). Правда, если будут моменты простоя системы без движения теплоносителя, это замечание значения не имеет.
Алюминий обладает большей способностью отдавать электроны по сравнению с медью, что видно из значений их стандартных электродных потенциалов (–1,66 и +0,34 соответственно). Следовательно, в случае замкнутой цепи медь является катодом, а алюминий — анодом (рис. 3). Ионы алюминия Al 3+ из кристаллической решетки переходят в раствор, образуя вместе с гидроксидионами OH – гидроксид алюминия Al(OH)3, а электроны поступают в медь. Оторванные от воды потерявшие электрон ионы водорода H + используют их для объединения в молекулу H2. Коррозия алюминия продолжается, т.к. электроны непрерывно уходят из него, смещая тем самым равновесие в сторону образования ионов. Ход электрохимического процесса определяется разностью потенциалов элемента. Для пары «медь–алюминий» разность потенциалов составляет 2 В. Если взять пару «цинк–алюминий», то разность будет менее значительной — 0,9 В, а, значит, реакция пойдет в два раза медленнее.
Подведем итоги
Если при проектировании и монтаже будут приняты меры по предотвращению описанных выше процессов, алюминиевые радиаторы отлично прослужат десятки лет. Изолирующие диэлектрические вставки и контроль состава теплоносителя позволят заказчику наслаждаться отопительным прибором с множеством положительных характеристик: высокая теплоотдача, пластичность (т.е. устойчивость к гидроударам), небольшой вес, возможность легко изменять мощность путем добавления или удаления секций и пр.
Источник
Превращаем алюминий в медь!
Эта работа была прислана на наш «бессрочный» конкурс статей.
Здравствуй, о оверклокер.
Тебе не даёт покоя мысль о том, что твой проц или видюха раскалены до предела? Есть только два выхода: убиться или охладиться. Я расскажу о втором. Да к тому же я расскажу не о совсем традиционном методе охлаждения. Я расскажу, как сделать медь из алюминия.
реклама
Сразу предупреждаю: материал чисто теоретический, я не проделывал этого дома (да и где бы то ни было), поэтому никакой ответственности я НЕ несу. Я хочу описать способ химического превращения алюминиевого радиатора в медный (начинай вспоминать химию). Нам понадобится вот что (ниже объясню подробнее):
- Радиатор алюминиевый — 1 шт.
- Купорос медный — полкило больше, чем достаточно.
- Кислота или щёлочь (желательно кислота) — половина литра — больше, чем достаточно (будет раствор)
- Ёмкость, устойчивая к воздействию кислоты.
- Прибор для нагревания (газовая плита вполне подойдёт).
- Оверклокер со своим собственным мозгом (головным), прямыми руками и немного свободного времени.
(1) ты можешь найти в комповом магазе или использовать свой старый. В цветочном или хозяйственном магазине ты найдёшь (2). В качестве (3) можно использовать уксусную кислоту, которою ты можешь найти в бутылке с надписью «уксус» или в продуктовом магазине (рекомендую второй вариант, так как в уксусе кислоты максимум 9%, а в кислоте — ближе к ста). Если найдёшь более сильную кислоту (серную, соляную и пр.) — хорошо, но будь аккуратнее (позже расскажу, почему). (4) — может быть стеклянной или керамической, но не пластиковой (металлическую тоже лучше не использовать). (5) дожен быть у тебя дома на кухне. (6) — ты (по идее), найти ты себя можешь там, где ты сейчас находишься.
Подготовить растворы кислоты и купороса (отдельно). Опустить радиатор в кислоту, чтобы снять защитную плёнку с металла. Опустить радиатор в купорос, после чего на нём выделится медь. Подготовить радиатор к использованию. Всё.
Любишь химию? Впрочем, это совершенно неважно. Химия — наука страшная, потому что тебе может оторвать руки, ноги, голову и прочие выступающие части тела. Шутка 😉 Сначала расскажу тебе немного о растворах.
Раствор кислоты не стоит делать очень насыщенным, особенно если кислота сильная (неорганическая). Если же использовать уксусную кислоту (её легче достать), то можно сильно не разбавлять. Дело в том, что кислота нужна для того, чтобы снять с металла оксидную плёнку, которая мешает взаимодействовать металлу с медным купоросом, который представляет из себя соль (кристаллогидрат, но об этом позже). Вот пример взаимодействия оксида алюминия с кислотой (в данном случае с соляной):
реклама
Формула уксусной кислоты: CH3COOH — на всякий случай.
Сначала была кислота и оксид, а стала вода и соль. Главное, что мне хотелось бы сказать — не передержите радиатор в кислоте, ведь сам металл тоже взаимодействует с кислотой, а этого нам не надо. Сначала поэкспериментируй с отдельными кусками алюминия, чтобы на глаз определить скорость протекания реакции. Замечу, что оксид алюминия — амфотерный оксид, то есть взаимодействует как с кислотами, так и с щелочами. Можешь попробовать щёлочь, но я бы не рекомендовал, а вот по какой причине: Твой радиатор, скорее всего, сделан не из чистого алюминия, а из сплава. Алюминий слишком мягкий, поэтому, скорее всего он сплавлен со сталью (железом). Оксид железа не будет взаимодействовать со щёлочью, так как, по-моему, он слабо амфотерный, либо вообще основный (реагирует только с кислотами). При взаимодействии медного купороса с железом пройдёт тот же процесс, что и при взаимодействии с алюминием, поэтому желанного результата (получение меди) мы всё равно достигнем.
Ещё хотел бы предостеречь: НЕ надо использовать концентрированную (более 60%) серную или азотную кислоту — железо и алюминий в них пассивируются (образуется защитная плёнка). Разбавлять серную кислоту тоже занятие не из приятных (не знаю, как насчёт азотной): она взаимодействует с водой (гидролиз), при этом шипя, булькая и брызгаясь. Если надумаешь разбавлять, то вливай кислоту в воду, а не наоборот. Кислота тяжелее, поэтому реакция будет проходить не на поверхности воды, а поглубже, тогда брызг не будет. Да, кстати, если реакция оксида с кислотой проходит очень уж медленно, то надо всё это дело нагреть. Принцип Вант-Гоффа: При повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза.
Вот тебе ещё полезная вещь — электрохимический ряд напряжений металлов:
Li, K, Ba, Ca, Na, Mg, Be, Al, Mn, Zn, Cr, Fe 2+ , Cd, Ni, Sn, Pb, Fe 3+ , H, Cu, Ag, Hg, Au.
Правило, которое должен знать каждый: Металл, стоящий в электрохимическом ряду напряжений металлов левее, вытесняет из растворов солей металл, стоящий правее. Мы имеем дело с алюминием и с железом (со степенью окисления 2+), которые стоят намного левее меди. Они будут вытеснять медь из медного купороса, а она будет выделяться на радиаторе. Реакции с металлами, стоящими в ряду напряжений в самом начале, будут проходить НУ ОЧЕНЬ активно. Иногда со взрывом. Это НЕ шутка! Хотя вряд ли ты найдёшь литиевый радиатор.
И ещё. Помни: медный купорос это кристаллогидрат, то есть его молекулы связаны с молекулами воды, хотя вещество в твёрдом состоянии:
Поэтому разбавляй не очень сильно, ведь воды и так уже много. Реакции с алюминием и железом проходят вот так:
В этих реакциях без нагрева не обойтись. Надо кипятить радиатор 😉 ! Шутка, конечно же! А вот подогреть немного можно. А что делать? Только так можно ускорить процесс. Если немного отшлифовать поверхность радиатора (создать шероховатости), то меди выделится немного больше, хотя лучше подобной чушью не заниматься (микрограммы не играют роли).
Важно: Я искренне надеюсь на то, что тем, кто захочет проделать какие-либо из описанных мною реакций, не придёт в голову мысль вмешиваться в ход реакции руками или другими выступающими частями тела, о которых я писал выше. Химия — наука, не терпящая баловства! Ну вот уже и мораль прочитал 😉 .
Если результат устраивает, то можешь тестировать заново рождённый радиатор, а можешь подшлифовать его или сделать что-нибудь в этом роде, если уж сильно хочется. Я уже говорил о том, что сначала надо проводить опыты над отдельными кусками алюминия (или железа), а уж потом переходить на радиатор. Кстати, перед опытами необходимо снять или счистить с радиатора неметаллические части (вентилятор, провода, термодатчики, термопаста) 😉
реклама
Я уверен, что все оверклокеры знакомы с радиаторами из алюминия, в которых имеется медный пятак-вставка в подошве. В покрытом по моему способу слоем меди радиаторе (именно слоем, ведь изнутри он не реагировал) принцип охлаждения примерно такой же. Так вот, если сравнивать радиаторы со вставкой с тем, что по идее должно получиться после прочтения данного текста, то можно сказать о преимуществах и недостатках того, о чём я писал:
Металлы плотнее соединены между собой, следовательно, тепло лучше передаётся между ними и они не распадаются (вставки-пятаки могут выпадать, а в моём способе слои металлов соединены химическим путём гораздо прочнее).
Имеется не только маленькое круглое пятно меди на подошве, а весь радиатор покрыт равномерным (при правильном проведении реакций) слоем меди, что благоприятно сказывается на температурном режиме охлаждаемого девайса.
реклама
Тепло хорошо проводится в рёбрах радиатора (если они были достаточно тонкие, то могли даже полностью стать медными), что обеспечивает (при хорошем продуве) сильную отдачу тепла, что нам и нужно.
Моим способом можно даже «сварить» две металлические детали, плотно прижав их друг к другу при проведении реакции в купоросе.
Радиатор не полностью медный (как и в радиаторах с медными пятаками)
Может получиться не совсем ровная поверхность радиатора, если реакции проходили бурно (например, в кипящей воде), хотя это исправимо.
реклама
Возможно, существенного улучшения ситуации с охлаждением и не произойдёт, но мне кажется, что пара-тройка градусов выигрыша тоже неплохо (искренне надеюсь на то, что этот выигрыш будет больше). Весь материал чисто теоретический и направлен на общее развитие умственных способностей оверклокера. Просто должно быть приятно осознание того, что всё сделано своими руками и продумано не хуже, чем у производителей радиаторов с медными вставками.
Надеюсь, что интересно было не только мне. Весь материал придуман лично мною, поэтому, если мои идеи каким-либо образом совпадают или пересекаются с чужими, то довожу до общего сведения, что я ни у кого не воровал идеи, а это просто совпадение. Прошу прощения, если я допустил какие-либо ошибки или неточности в тексте.
Желаю успехов оверклокерам в их нелёгком деле!
реклама
Мне показалась очень интересной сама идея, поэтому статья опубликована, хотя я далёк от уверенности, что всё задуманное можно воплотить в жизнь. Автор не зря несколько раз подчёркивал, что материал чисто теоретический и прежде чем «варить» свой алюминиевый радиатор, нужно потренироваться на алюминиевых кусочках. Я бы даже посоветовал предварительно хорошенько разобрать статью с теоретической точки зрения, прежде чем переходить к практическим экспериментам. Самое первое предположение, которое приходит в голову, что радиатор покроется тончайшим слоем меди, если замещение всё же пойдёт, после чего реакция прекратится. Впрочем, полагаю, что хорошо разбирающиеся в химии читатели найдут ещё множество причин, по которым подобное превращение алюминиевого радиатора в медный невозможно. Предлагаю обсудить статью в конференции.
Источник