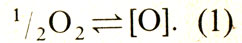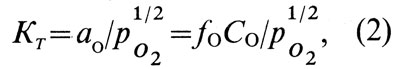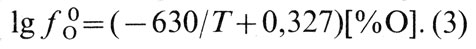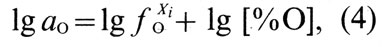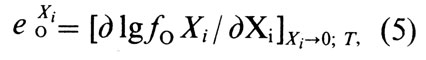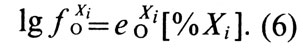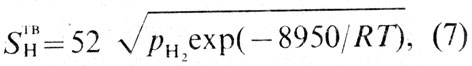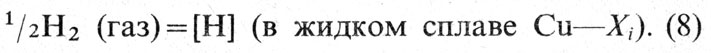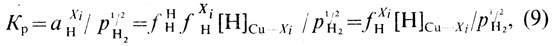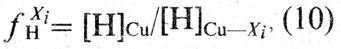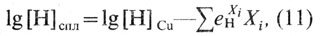- Медь вода кислород что это
- 5. Взаимодействие меди и ее сплавов с кислородом, водородом
- Диаграмма состояния системы медь — кислород
- Кислород в меди и медных сплавах
- Раскисление сплавов меди
- Диаграмма состояния системы медь — водород
- Водород в меди и медных сплавах
- Медь. Химия меди и ее соединений
- Положение в периодической системе химических элементов
- Электронное строение меди
- Физические свойства
- Нахождение в природе
- Способы получения меди
- Качественные реакции на ионы меди (II)
- Химические свойства меди
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Соли меди
- Соли меди (I)
- Соли меди (II)
- Медь и соединения меди
Медь вода кислород что это
5. Взаимодействие меди и ее сплавов с кислородом, водородом
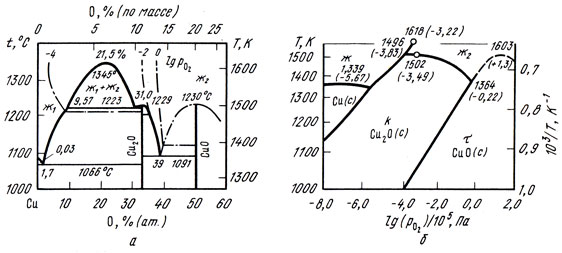
Диаграмма состояния системы медь — кислород
Диаграмма состояния меди с кислородом [до 60% (ат.) O2] по обобщенным литературным данным [21, 22] приведена на рис. 35, f. В системе существуют следующие фазы: твердый раствор на основе меди — до 0,03% (ат.) O2 при 1066 °С, Cu2O при 33,3% (ат.) O2, Cu4О3 при 42,9% (ат.) O2. На рис. 35,6 показана диаграмма состояния этой системы в координатах lgpO2 — Т, где рO2— парциальное давление кислорода, Па; Т — температура, К. Эта диаграмма позволяет судить о стабильности различных фаз: твердого раствора на основе меди — Cu(c), Cu2O (с) — куприта,CuО(с) — тенорита. При нагреве на воздухе (lg pO2= — 0,67) CuО диссоциирует при 1031 °С с образованием Cu2O, которая плавится конгруэнтно при 1134 °С.
Рис. 35. Диаграмма состояния сплавов системы медь — кислород
Кислород в меди и медных сплавах
( Чурсин В. M. Плавка медных сплавов (Физико-химические и технологические основы). — М.: Металлургия. -1982. -152 с.)
Растворение кислорода в меди можно описать уравнением
Константа равновесия реакции окисления
где aO, fO — активность и коэффициент активности кислорода в меди соответственно; СO — концентрация кислорода, % (ат.).
Коэффициент активности кислорода 0 O уменьшается с увеличением концентрации кислорода и понижением температуры расплава. В соответствии с полученными экспериментальными данными значения 0 O можно определить из следующего выражения:
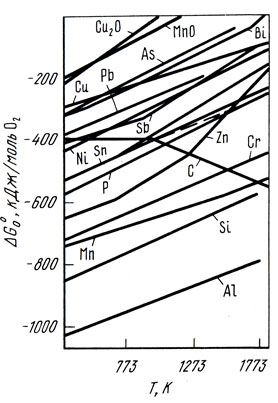
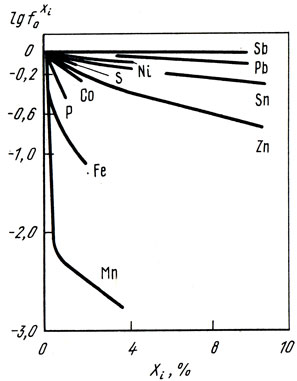
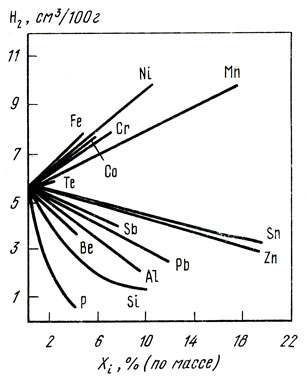
В сплавах меди активность кислорода отличается от его активности в чистой меди. Активность кислорода в медных сплавах зависит от сродства элементов или примесей к кислороду (рис. 36) [23]. Большинство элементов, входящих в состав медных сплавов, снижает активность кислорода в расплавах. В сплавах, содержащих элементы, обладающие высоким сродством к кислороду (Al, Si, Мn), активность кислорода очень мала [∼ 10 -6 % (ат.)]. Сплавы, содержащие элементы с меньшим сродством к кислороду (Zn, Fe, Sn, Со, Pb), имеют большее количество кислорода, и его активность составляет 10 -2 . 10 -5 % (ат.). В реальных условиях ведения плавки [при содержании кислорода в меди менее 0,4% (по массе)] коэффициент активности кислорода, учитывающий отклонение системы Cu-О от закона Генри, может быть принят равным единице. В конечном виде активность кислорода в сплаве меди с каким-либо компонентом Хi описывается выражением:
где xi O — коэффициент активности кислорода, учитывающий влияние элемента; [%O] — концентрация кислорода, % (по массе).
Рис. 36. Зависимость стандартных термодинамических потенциалов образования сплавов в меди от температуры
Для сравнительной оценки влияния различных элементов на активность кислорода в сплавах пользуются показателями параметров взаимодействия [О] и Xi при определенных температурах Т:
где е Xi O, — параметр взаимодействия при концентрации [О], % (по массе).
Параметр взаимодействия и коэффициент активности (которые имеют одни и те же знаки) могут иметь положительные и отрицательные значения в зависимости от природы Xi. На основе формулы (5) коэффициент активности кислорода в бинарном сплаве меди с Хi можно определить по соотношению
Это выражение тем точнее, чем ближе сплав к разбавленным растворам.
На рис. 37 приведены экспериментальные данные о влиянии некоторых элементов на активность кислорода в меди.
Рис. 37. Влияние элементов Хi на активность кислорода в меди при 1423 К
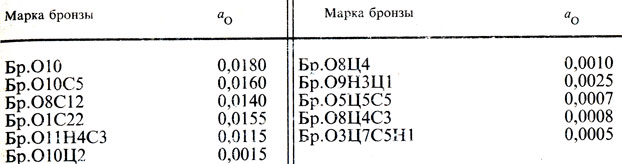
Данные в виде параметров взаимодействия и коэффициентов активности позволяют оценить влияние каждого компонента Xi на активность кислорода в бинарных сплавах Cu-Xi. В табл. 8 приведены активности кислорода аO в бронзах [23].
Таблица 8. Активность кислорода в бронзах при 1473 К
В бронзах, не содержащих цинка, активность кислорода относительно заметна (0,01. 0,02), поэтому эти бронзы необходимо тщательно раскислять, а оловянно-цинковые бронзы содержат очень мало кислорода (aO = 0,001÷0,002), что свидетельствует о заметной раскислительной способности цинка в бронзах.
Раскисление сплавов меди
Экспериментальные значения активности кислорода в сплавах меди позволяют сделать количественную оценку раскислительной способности элементов по отношению к меди [23]. С увеличением содержания элементов Pb, Ni, Sn, Zn, Р, Mn, Cr, В, Fe, Co и других активность кислорода в меди линейно уменьшается. Выделяются сильные раскисляющие способности углерода, фосфора, железа, марганца, хрома, бора, бериллия в меди. К раскис-лителям меди предъявляются следующие требования.
1. Сродство к кислороду у раскислителя R должно быть, выше, чем у меди, т. е. ΔGRO >ΔGCu2O.
2. Раскислитель не должен отрицательно влиять на свойства меди, в первую очередь на его механические свойства.
3. Продукт раскисления (оксид RO или другое соединение) должен хорошо удаляться из металла.
4. Раскислитель должен быть дешевым, недефицитным, легко вводиться в расплав.
При плавке медных сплавов, используемых для ювелирного и художественного литья, фосфор — наиболее часто применяемый раскислитель [в виде фосфористой меди, содержащей 7. 11% (по массе) Р]. Он хорошо растворяется в меди с образованием шлаковой фазы состава х Cu2O·у Р2О5.
Практика многолетней работы показывает целесообразность использования для раскисления небольших присадок фосфора (0,01. 0,1%) почти для всех сплавов меди. Изменение вязкости и поверхностного натяжения оказывает благоприятное влияние на литейные свойства расплава.
Важность раскисления сплавов меди имеет практическое значение при последующей обработке отливок. В меди, раскисленной фосфором, окисный слой независимо от температуры его образования отслаивается легче. В то же время установлено, что ряд элементов (Be, Mg, Al) сильно замедляют окисление меди из-за образования барьерного защитного слоя, тормозящего диффузию кислорода внутрь металла [24]. Заметно замедляют окисление меди кадмий и кремний, а также цинк и олово, но в больших концентрациях. Все это необходимо учитывать при изготовлении отливок из сплавов меди.
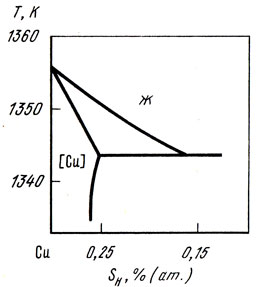
Диаграмма состояния системы медь — водород
Экспериментально определены фазовый состав и растворимость водорода в меди [25]. На рис. 38 приведена диаграмма состояния системы медь — водород при давлении водорода 100 мПа. Растворимость водорода в меди зависит от температуры и давления и может быть рассчитана по уравнению
где S TB H — растворимость водорода в твердой меди, см 3 /100 г;
pН2 — парциальное давление водорода, мПа; R — универсальная газовая постоянная, Дж/(моль·К); Т — температура, К.
Рис. 38. Диаграмма состояния сплавов системы медь — водород при давлении водорода 100 мПа
Водород в меди и медных сплавах
Водород, растворяясь в меди и сплавах на основе меди, отрицательно влияет на их свойства. Растворимость водорода в жидкой меди в широком интервале температур носит экспоненциальный характер. Процесс растворения водорода в системах Cu-Xi можно выразить уравнением
Константа равновесия процесса
где Xi H — коэффициент активности водорода в сплаве Cu-Xi при постоянных (одинаковых) температурах и давлении; [Н]Cu-Xi.- растворимость водорода в сплаве Cu-Хi.
Коэффициент активности Xi H рассчитывают по уравнению
где [Н]Cu — растворимость водорода в чистой меди.
Растворимость водорода в многокомпонентных сплавах можно рассчитывать по формуле, предложенной К. Вагнером [26]:
где [Н]СПЛ — растворимость водорода в сплавах, см 3 /100 г, при расчетной температуре и рН2 = 0,101 МПа; [Н]Cu— растворимость водорода в чистой меди, см 3 /100 г, при расчетной температуре и рН2 = 0,101 МПа; е Xi H — параметры взаимодействия при расчетной температуре и pН2 = 0,101 МПа; Хi — содержание легирующих компонентов, % (по массе).
Равновесную расчетную растворимость при меньших, реальных парциальных давлениях можно определить по выражению Сивертса: [Н] = КН2(рH2)1/2, где KH2 = [Н]СПЛ при расчетной температуре и рН2 = 0,101 МПа; pH2 — реальное парциальное давление водорода в плавильной атмосфере.
Рис. 39. Влияние элементов на растворимость водорода в жидкой меди при Т = 1423 К и рН2 = 0,101 МПа
Легирующие элементы в меди могут понижать, повышать или существенно не изменять величину растворимости кислорода в сплавах. Влияние элементов на растворимость водорода в жидкой меди показано на рис. 39 [23]. В системах медь — никель, медь — марганец, медь — железо с увеличением содержания легирующих элементов в сплаве растворимость водорода возрастает. В чистом марганце и никеле растворимость водорода значительно больше, чем в меди. В сплавах медь — никель [до 9% (по массе) Ni] и сплавах медь — марганец [до 18% (по массе) Mn] и в области давлений до 0,101 МПа соблюдается уравнение Сивертса. В сплавах медь — кремний, медь — олово, медь — цинк, медь — свинец растворимость водорода уменьшается. Исследованы следующие концентрационные интервалы, % (по массе): Si — до 10, олова — до 70, цинка — до 27, свинца — до 35. Свинец снижает растворимость водорода в меди особенно заметно в интервале концентраций 1. 5%. Установлено также, что алюминий уменьшает растворимость водорода в сплавах с медью [23].
Источник
Медь. Химия меди и ее соединений
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии :
+29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 

3s 


У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 .
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: р астворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например , вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод : получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II).
Например , сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий:
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II):
Но, обратите внимание:
2Cu + I2 = 2CuI
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например , медь не реагирует с разбавленной серной кислотой :
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь реагирует даже при обычных условиях с азотной кислотой .
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей .
Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями.
Например , хлорид меди (I) окисляется концентрированной азотной кислотой :
Также хлорид меди (I) реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака :
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например , соли меди (II) окисляют иодиды и сульфиты :
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
Бромиды и иодиды меди (II) можно окислить перманганатом калия :
Соли меди (II) также окисляют сульфиты :
Более активные металлы вытесняют медь из солей.
Например , сульфат меди (II) реагирует с железом :
CuSO4 + Fe = FeSO4 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II):
Еще одна форма этой реакции:
CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например , растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II):
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Источник