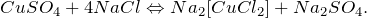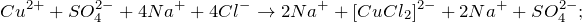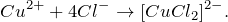- Медный купорос хлорид натрия вода
- Медный купорос хлорид натрия вода
- —>СТАТИСТИКА —>
- —>МЫ ВКОНТАКТЕ —>
- —>НЕМНОГО РЕКЛАМЫ —>
- Наши спонсоры
- Эксперимент «Битва металлов»
- Пошаговая инструкция
- Пояснение процессов
- Меры предосторожности
- CuSO4 + NaCl = ? уравнение реакции
- Медь. Химия меди и ее соединений
- Положение в периодической системе химических элементов
- Электронное строение меди
- Физические свойства
- Нахождение в природе
- Способы получения меди
- Качественные реакции на ионы меди (II)
- Химические свойства меди
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Соли меди
- Соли меди (I)
- Соли меди (II)
- Медь и соединения меди
Медный купорос хлорид натрия вода
С помощью каких реакций можно получить водород? В любом школьном учебнике написано, что водород выделяется при реакции серной или соляной кислот с активными металлами. Как правило, для этой цели используют цинк или железо. Но как можно получить водород, не имея кислот? Таких возможностей много: например, реакция алюминия с раствором щелочи, электролиз воды, реакция магния с горячей водой. Одним из самых доступных вариантов является реакция алюминия со смесью сульфата меди и хлорида натрия. Алюминий не реагирует с раствором сульфата меди, поскольку его поверхность защищена прочной оксидной пленкой. Хлорид-ионы способствуют разрушению этой оксидной пленки, в результате чего алюминий начинает одновременно взаимодействовать с катионами меди и молекулами воды:
2Al + 6H2O => 2Al(OH)3 + 3H2 3Cu 2+ + 2Al => 3Cu + 2Al 3+
Проведем эксперимент. Возьмите 15 см 3 медного купороса и 30 см 3 поваренной соли. Добавьте воды, чтобы общий объем смеси составил примерно 80 см 3 . Перемешайте вещества до растворения солей. Раствор станет зеленым в результате образования комплексного иона [CuCl4] 2- :
Теперь профильтруйте жидкость через вату или фильтровальную бумагу. Соберите фильтрат в стаканчике и опустите в него алюминиевую пластинку. Через несколько секунд на поверхности алюминия начнут выделяться пузырьки водорода, немного позже появится красная губчатая медь. Со временем реакция ускорится, раствор нагреется. Алюминиевая пластинка будет быстро разрушаться. Мы использовали кусок алюминиевого гофрированного шланга, который растворился за несколько минут, оставив темный мутный раствор и красный осадок меди.
Операция фильтрования не обязательна, но если ее опустить, раствор будет мутным, что будет мешать наблюдению реакции с алюминием. Все приведенные соотношения веществ ориентировочные — если вы от них отклонитесь, это существенно не повлияет на эксперимент. Чистота реактивов также не имеет большого значения.
Реакция алюминия со смесью сульфата меди и хлорида натрия
Образующийся в предыдущем опыте водород можно собрать в пробирку, цилиндр или другие сосуды, после чего использовать для экспериментов (например, поджечь). Возьмите высокий стакан на 350 мл, наполните его почти доверху водой и опустите на дно несколько кусочков алюминия. Мы воспользовались ручкой от старой алюминиевой ложки. Накройте алюминий воронкой (на первой фотографии воронка не показана). Наберите воды в мерный цилиндр (объем 50-100 мл), закройте его пальцем так, чтобы внутри не осталось пузырьков воздуха. Переверните цилиндр дном вверх и опустите его нижнюю часть под воду. Откройте отверстие и наденьте цилиндр на воронку. Вылейте из стакана примерно 2/3 воды. Это нужно делать осторожно, чтобы пузырьки воздуха не попали внутрь цилиндра. Насыпьте в стакан медный купорос и хлорид натрия, аккуратно перемешайте.
Через пару минут в стакане начнется реакция, цилиндр заполнится пузырьками водорода. Теперь цилиндр можно вынуть из стакана и осторожно поджечь газ. Водород сгорит желтоватым пламенем. Пламя чистого водорода почти бесцветное, но брызги солей натрия придают ему желтую окраску.
Держите цилиндр подальше от лица. Не забывайте о необходимости использовать защитную маску или очки.
Источник
Медный купорос хлорид натрия вода
Среднестатистический человек привык думать, что любая жидкость по сути своей не имеет собственной формы, однако, это заблуждение. Примечательно, что даже школьная программа говорит об этом. Но естественная форма любой жидкость шарообразная. Единственная причина по которой она не находиться в такой форме – сила притяжения.
—>СТАТИСТИКА —>
—>МЫ ВКОНТАКТЕ —>
—>НЕМНОГО РЕКЛАМЫ —>
Наши спонсоры
Водород – это необычайно легкий газ – он в 14 раз легче воздуха и в два раза легче гелия. Если надуть им резиновый шарик, он взлетит ввысь. Это свойство водорода использовали раньше для наполнения воздушных шаров и дирижаблей.
Сегодня мы будем получать водород химическим способом из легкодоступных материалов и заставим шарик летать.
Мы изучили несколько способов получения водорода при помощи химической реакции. При выборе мы исходили из наличия доступных реактивов и безопасности. И самый простой способ получить водород в домашних условиях – это реакция алюминия, медного купороса и пищевой соли в воде (Al+CuSO4+NaCl+H2O).
Для эксперимента нам понадобилось следующее оборудование: бутылка пластиковая 1л, капельница (продается в любой аптеке за копейки), медный купорос (в хоз-товарах в отделе удобрения для растений), пищевая соль, алюминиевая пищевая фольга (или алюминиевая проволока), надувной шарик.
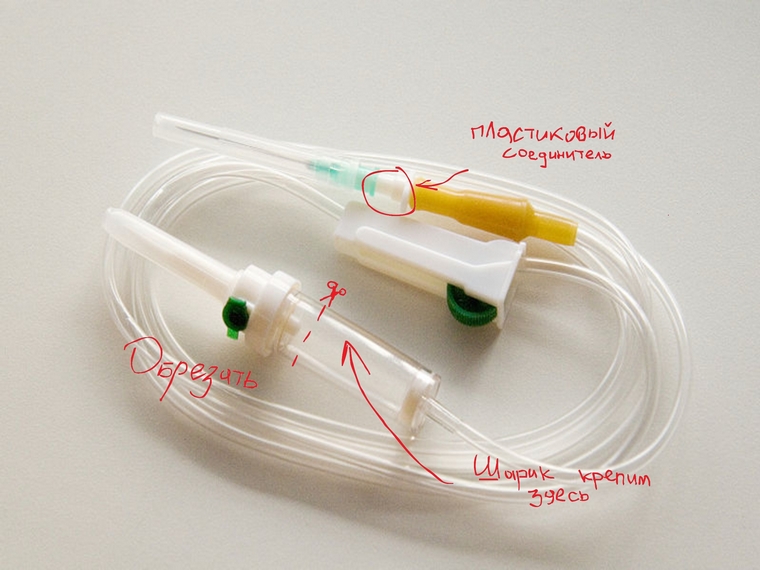
В пробке от пластиковой бутылки нагретым на плите гвоздем проделываем отверстие. В это отверстие вставляем пластиковый соединитель от капельницы и приклеиваем (мы использовали супер-клей). Затем на этот соединитель надеваем трубку капельницы. Толстый конец капельницы обрезаем, как показано на рисунке. На него мы надеваем резиновый шарик.
В литровую пластиковую бутылку насыпали равное количество медного купороса и пищевой соли (по 100г, соли можно больше).
Затем залили водой (примерно 700 мл) и взболтали до полного растворения.
Раствор окрасился в ярко зеленый цвет.
Далее необходимо заготовить алюминиевые комочки из пищевой фольги (такие по размеру, чтобы легко и быстро проходили в горлышко бутылки) . Если есть алюминиевая проволока, используйте ее (метра два алюминиевой проволоки сложите зигзагом, чтобы получился пучок легко пролезающий в бутылку). Мы использовали и то ,и другое.
Бутылку с раствором медного купороса и соли нужно поставить предварительно в емкость с водой (кастрюля или ведерко). Так как в ходе реакции бутылка будет сильно нагреваться и может расплавиться. ( Также раствор может быстро закипеть без охлаждения и выскочить наружу прежде, чем Вы закроете пробку. Проверено!).
Затем нужно закинуть в бутылку проволоку и фольгу и закрыть подготовленной крышкой с трубкой. Делать это нужно быстро, так как реакция начинается мгновенно и водород начинает выделяться сразу.
Мы наблюдем, как образуется множество пузырьков водорода около алюминия. Над поверхностью раствора виден белый дымок пара. При реакции выделяется большое количество тепла и наша бутылка сильно нагревается. Со временем цвет раствора меняется на более темный, а затем и вовсе становится черным. Комочки алюминия окрашиваются в ржаво-оранжевый цвет. Это на них выделяется медь из раствора медного купороса.
Через отверстие в пробке по трубке водород поступает в шарик. Шарик постепенно наполняется водородом и через 10-20 минут реакции уже видно, как он поднимается в воздух.
Примечание: для того, чтобы шарик проще надувался водородом следует до начала эксперимента его растянуть, т.е. надуть несколько раз и сдуть.
Смотрите видео эксперимента.
Как это работает (Химическая реакция):
Алюминий – активный металл. В чистом виде он вступает в химическую реакцию с водой, растворяясь в ней, при этом выделяется водород. Но, если бросить алюминий в воду, никакой реакции не наблюдается. Почему?! А все потому, что алюминий защищен оксидной пленкой. Чтобы реакция началась нужно разрушить эту пленку. Под действием медного купороса ( CuSO 4 ) + пищевой соли ( NaCl ) эта оксидная плёнка разрушается, а алюминий реагирует с водой с образованием водорода H 2 и гидроокиси алюминия Al ( OH )3.
Медный купорос и хлорид натрия образуют комплекс. Раствор становится ярко зеленого цвета.
2) Образовавшийся хлорид меди CuCl 4 разрушает оксидную пленку алюминия.
3) 2 Al + 6 H 2 O = 2 Al ( OH )3 + 3 H 2 ↑
Происходит реакция алюминия с водой с выделением водорода ( H 2 ).
1) CuSO4 + 4NaCl Na2[CuCl4] + Na2SO4
Медный купорос и хлорид натрия образуют комплекс. Раствор становится ярко зеленого цвета.
2) Образовавшийся хлорид меди CuCl4 разрушает оксидную пленку алюминия.
3) 2Al + 6 H2O = 2 Al(OH)3 + 3 H2↑
Происходит реакция алюминия с водой с выделением водорода (H2).
Источник
Эксперимент «Битва металлов»
Алюминий Vs. Медь
В химии, как и в жизни, тоже есть конкуренция, например, когда металлы вытесняют друг друга из соединений. В этом красочном опыте мы покажем основное правило замещения металлов на примере «битвы» между алюминием и медью.
Реагенты и оборудование:
- алюминиевая фольга;
- сульфат меди(II);
- хлорид натрия;
- дистиллированная вода;
- химический стакан.
Пошаговая инструкция
Для начала сформируем небольшую чашечку из алюминиевой фольги и «вставим» ее в химический стакан, как показано на видео. Теперь нальем в эту чашечку голубой раствор сульфата меди(II) и прозрачный раствор хлорида натрия. Раствор в «чашечке» окрасился в зеленый цвет. Через несколько секунд запускается бурная реакция с выделением газа и красно-бурого осадка на поверхности алюминиевой фольги. Постепенно фольга теряет целостность, и через нее раствор просачивается в стакан.
Пояснение процессов
Фольга покрыта прочной оксидной пленкой, которая не дает алюминию реагировать с раствором сульфата меди. Когда мы смешиваем растворы сульфата меди(II) и хлорида натрия, образуется комплексная соль хлорида меди(II), и раствор окрашивается в зеленый цвет:
CuSO₄ + 4NaCl ↔ Na₂[CuCl₄] + Na₂SO₄
Хлорид-ионы разрушают оксидную пленку, и в результате алюминий начинает одновременно реагировать с катионами меди и молекулами воды:
2Al + 6H₂O → 2Al(OH)₃ + 3H₂
3Cu²⁺ + 2Al → 3Cu + 2Al³⁺
В электрохимическом ряду напряжения металлов алюминий является более активным, чем медь, поэтому он вытесняет ее из соединения. В результате выделяется красная металлическая медь и газообразный водород. Реакция протекает очень интенсивно и сопровождается выделением тепла.
Меры предосторожности
Проводите опыт в защитных перчатках и очках.
Внимание! В эксперименте использованы токсичные и опасные для здоровья вещества. Не пытайтесь повторить этот опыт самостоятельно.
Источник
CuSO4 + NaCl = ? уравнение реакции
Составьте химическое уравнение по схеме CuSO4 + NaCl = ? Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Дайте краткую характеристику физических и химических свойств сульфата меди (II); приведите способы его получения.
Реакция взаимодействия между сульфатом меди (II) и хлоридом натрия (CuSO4 + NaCl = ?) носит обратимый характер и приводит к образованию двух других солей: сульфата и дихлоркупрата натрия. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения:
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Реакционная смесь принимает зеленый цвет из-за гидратированного иона 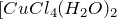
Сульфат меди (II) представляет собой весьма гигроскопичные кристаллы белого цвета, разлагающиеся при сильном нагревании. Образует кристаллогидраты состава 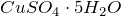
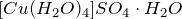
Сульфат меди (II) реагирует со щелочами, гидратом аммиака, сероводородом, активными металлами. Вступает в реакции обмена и комплексообразования.
Источник
Медь. Химия меди и ее соединений
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии :
+29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 

3s 


У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 .
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: р астворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например , вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод : получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II).
Например , сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий:
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II):
Но, обратите внимание:
2Cu + I2 = 2CuI
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например , медь не реагирует с разбавленной серной кислотой :
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь реагирует даже при обычных условиях с азотной кислотой .
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей .
Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями.
Например , хлорид меди (I) окисляется концентрированной азотной кислотой :
Также хлорид меди (I) реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака :
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например , соли меди (II) окисляют иодиды и сульфиты :
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
Бромиды и иодиды меди (II) можно окислить перманганатом калия :
Соли меди (II) также окисляют сульфиты :
Более активные металлы вытесняют медь из солей.
Например , сульфат меди (II) реагирует с железом :
CuSO4 + Fe = FeSO4 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II):
Еще одна форма этой реакции:
CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например , растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II):
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Источник