Крезолы (метилфенолы, гидрокситолуолы)
Технический крезол (трикрезол) — это темная маслянистая жидкость, с молекулярной массой 108,14, выкипающая при 185—205 °С. Она представляет собой трудноразделимую смесь трех изомеров с близкими температурами кипения: орто -крезол ( о -крезол), мета -крезол ( м -крезол) и пара -крезол ( п -крезол).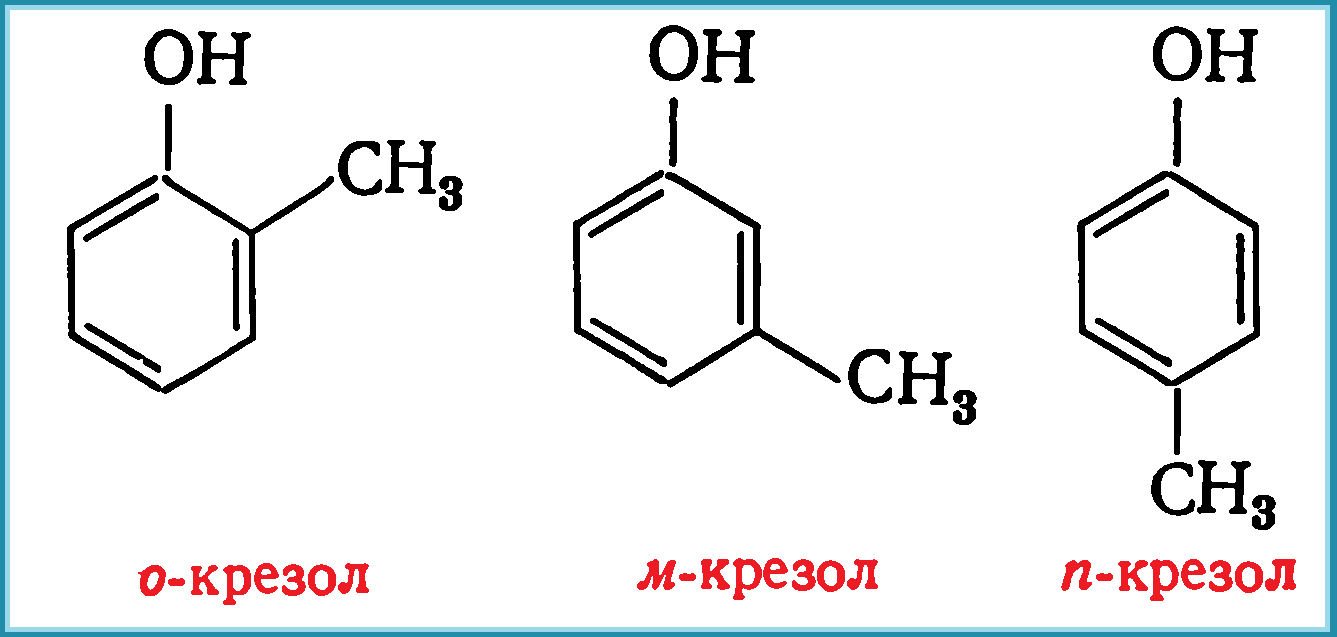
Крезолы (метилфенолы, гидрокситолуолы) имеют химическую формулу C7H8O
Изомеры крезола представляют собой бесцветные кристаллы или жидкости. Крезолы хорошо растворяются в этаноле, диэтиловом эфире, бензоле, хлороформе, ацетоне, воде, и растворах щелочей (с образованием солей-крезолятов).
Химические свойства крезолов
Подобно фенолу, крезолы являются слабыми кислотами. Они легко вступают в реакции электрофильного замещения, поликонденсации, например с альдегидами. п -Крезол окисляется оксидами Рb, Мn или Fe до n-гидроксибензойной кислоты, более сильными окислителями – до хинона или гидрохинона. При каталитическом восстановлении крезолы превращаются в метилциклогексанолы и метилцихлогексаноны.
Качественная реакция на крезолы
Изомеры крезолов при смешении с хлорной водой в присутствии NH3 образуют окрашенные соединения:
- о -крезол дает желто-бурую окраску, переходящую в зеленоватую;
- м -крезол – зеленую, переходящую в темно-желтую;
- п -крезол – темно-желтую, переходящую в оранжевую или красную.
Характеристики крезолов
| Показатель | о –Крезол | м –Крезол | п –крезол | Смесь изомеров (сырой крезол, трикрезол) |
| Температура плавления, °С. | 30,9 | 11,0 | 31,8 | 11-35 |
| Температура кипения °С. | 191,0 | 202,8 | 201,9 | 190-203 |
| D4 20 | 1,0465 | 1,0336 | 1,0347 | 1,03-1,05 |
| nD 20 | 1,4423 | 1,5398 | 1,5395 | —— |
| Ка(водный раствор, 20 °С. | 6,3 · 10 -11 | 9,8·10 -11 | 6,7·10 -11 | —— |
| Растворимость в воде при 20 °С,% | 3,1 | 2,4 | 2,35 | —— |
Получение крезолов
Крезолы получают из фенольной фракции каменноугольной смолы. В промышленности основной источник получения крезолов – крезольные фракции смол, образующихся при коксовании каменного угля, термообработке горючих сланцев и пиролизе древесины. Разделяют крезолы фракционной дистилляцией.
Синтез гомологов фенола (крезолов и ксиленолов) может быть осуществлен по методу Сергеева, например:
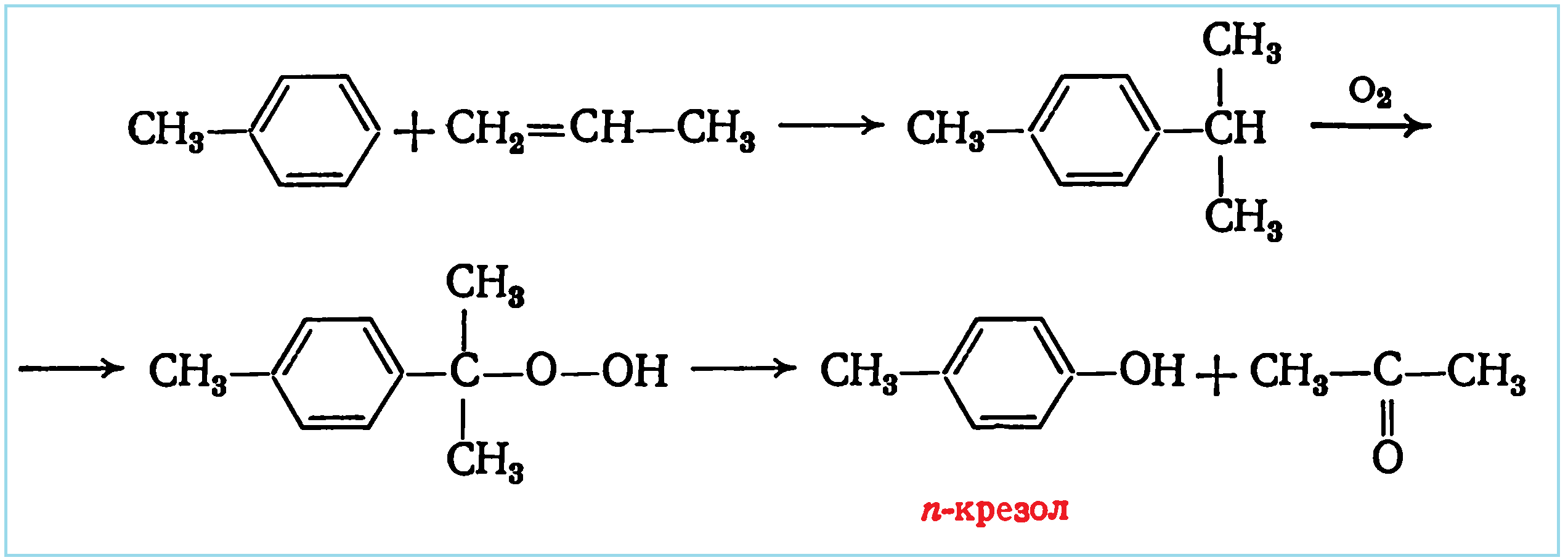
Кроме того, п -крезол можно синтезировать сульфированием толуола серной кислотой с последущим щелочным плавлением натриевой соли n-толуолсульфокислоты, а о -крезол – алкилированием фенола метанолом. Трикрезол применяют в производстве феноло-альдегидных смол, дезинфекционных средств. А изомеры о-крезол и п -крезол используются в произодстве азокрасителей, о- и n- гидроксибензальдегида, аминометокситолуолов (крезидинов), п -Крезол используют для синтеза антиоксиданта 2,6-ди-трет-бутил-4-метилфенола, о -крезол – для получения 2,6-динитро-о-крезола – сырья для производства инсектофунгицидов и гербицидов, салицилового альдегида, м-крезол – для получения мускус-кетона, мускус-амбретта и др. Крезолы раздражают слизистые оболочки дыхательных путей, вызывают конъюнктивиты; Предельно допустимая концентрация (ПДК) 0,5 мг/м 3 (для м -крезола и п -крезола) и 0,1 мг/м 3 (для о -крезола).
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |





