- Растворимость некоторых газов в воде (аргона, метана, этилена, этанола, углекислого газа, диоксида углерода, хлорина, водорода, сероводорода , гелия, азота, аммиака, кислорода, диоксида серы).
- Большая Энциклопедия Нефти и Газа
- Растворимость — метан
- Метан
- метан
- оглавление
- этимология
- история
- Античность и позднее средневековье
- 17-19 века
- 20 век
- Вхождение
- Земной
- Инопланетянин
- титан
- Энцелад
- Извлечение и представление
- Добыча как природный газ
- Производство биогаза
- Получается из гидрата метана
- Метанирование
- Лабораторные синтезы
- характеристики
- Физические свойства
- Молекулярные свойства
- Химические свойства
- использовать
- Использовать как топливо и топливо
- Использование в качестве химического сырья
- Паровой риформинг и частичное окисление
- Термокаталитическое разложение
- Производство этина
- Производство сероуглерода
- Производство цианистого водорода
- Производство галометанов
- Биологическое значение
- Метаногенные археи
- Метанотрофные микробы
- Зоопарк и фитопланктон
- Экологическая значимость
- Атмосферная химия
- Потенциал глобального потепления
- Источники метана
- Гидроразрыв
- Вечная мерзлота
- Добыча и транспортировка нефти и угля
- Выращивание риса, козоводство, овцеводство и животноводство
- Аспекты безопасности
- доказательство
Растворимость некоторых газов в воде (аргона, метана, этилена, этанола, углекислого газа, диоксида углерода, хлорина, водорода, сероводорода , гелия, азота, аммиака, кислорода, диоксида серы).
Растворимость некоторых газов в воде (аргона, метана, этилена, этанола, углекислого газа, диоксида углерода, хлорина, водорода, сероводорода , гелия, азота, аммиака, кислорода, диоксида серы).
Зависимость растворимости в воде при давлении в одну атмосферу (101.325 кПа) и разных значениях температур показана на графиках ниже:
Растворимость Аргона -Ar- в воде (г газа на кг воды).
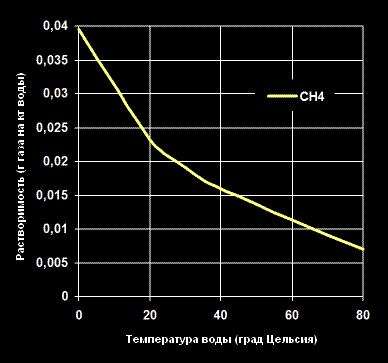
Растворимость Метана -CH4— в воде (г газа на кг воды).
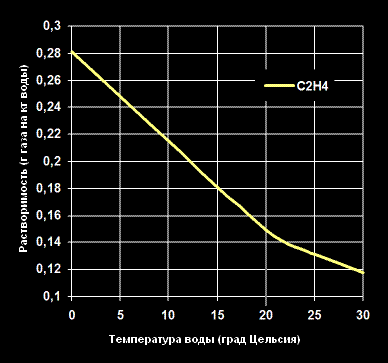
Растворимость Этилена -C2H4— в воде (г газа на кг воды).
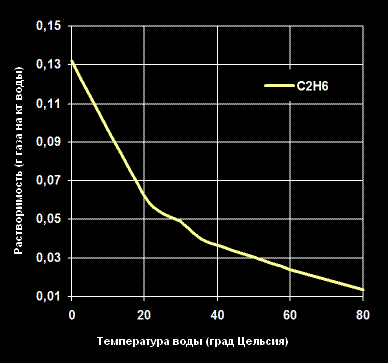
Растворимость Этанола -C2H6— в воде (г газа на кг воды).
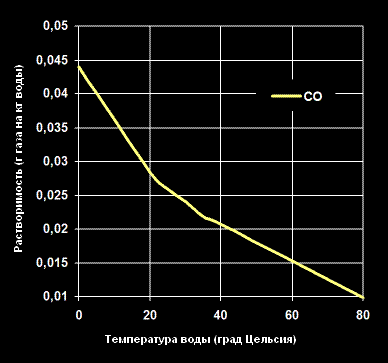
Растворимость Монооксида углерода (Углекислого газа) -CO- в воде (г газа на кг воды).
Растворимость Диоксида углерода -CO2— в воде (г газа на кг воды).
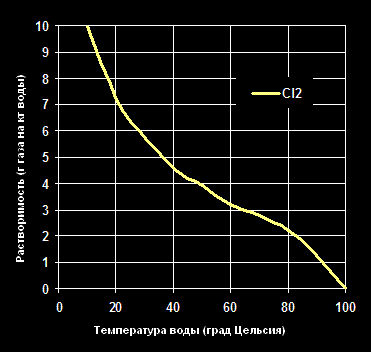
Растворимость Хлорина -Cl2— в воде (г газа на кг воды).
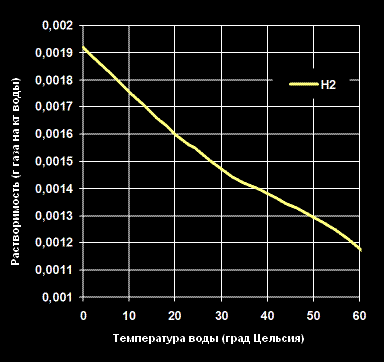
Растворимость Водорода -H2— в воде (г газа на кг воды).
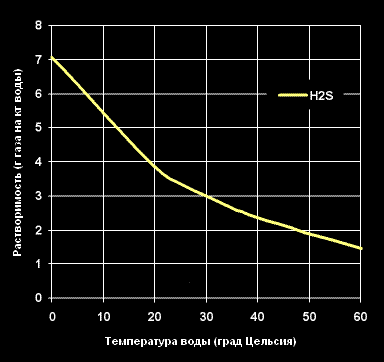
Растворимость Сероводорода -H2S- в воде (г газа на кг воды).
Растворимость Гелия -He- в воде (г газа на кг воды).
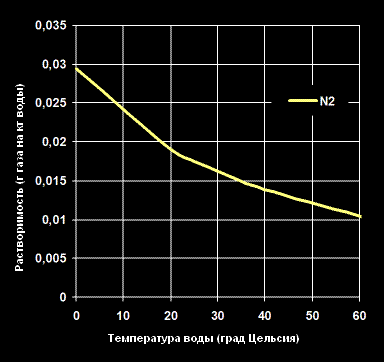
Растворимость Азота -N2— в воде (г газа на кг воды).
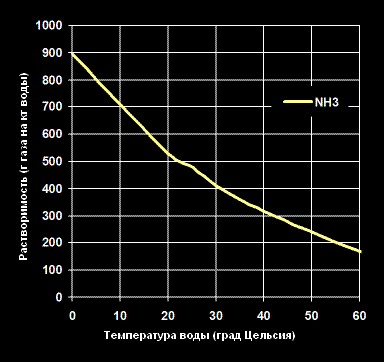
Растворимость Аммиака -NH3— в воде (г газа на кг воды).
Растворимость Кислорода -O2— в воде (г газа на кг воды).
Растворимость Диоксида серы -SO2— в воде (г газа на кг воды).
Источник
Большая Энциклопедия Нефти и Газа
Растворимость — метан
Растворимость метана в ксилоле при t — 20 и Р 50 мм равна 0 05 объема ( приведенного к нормальным условиям) на 1 объем растворителя. [1]
Растворимость метана в воде составляет около 4: 100 по объему. [2]
Растворимость метана в углеводородах уменьшается при переходе от парафиновых углеводородов к нафтеновым и ароматическим. [3]
Растворимость метана , выраженная в нормальных объемах: rasa на массу нефти, уменьшается не только с увеличением молекулярного веса нефти, но и с увеличением содержания в ней нафтеновых и ароматических углеводородов. [4]
Растворимость метана в полярных растворителях почти та же, что и в неполярных; в спиртах от метанола СН3ОН до пентанола ( амилового спирта) С5НпОН растворимость метана составляет 72 — 80 % значения для керосина. Силы вандерваальсова притяжения молекул растворителя в отношении молекул метана остаются почти одинаковыми для разных растворителей. С другой стороны, растворимость водяных паров при давлении 0 313 атм в амиловом спирте в 1400 раз больше, чем в керосине, и вода смешивается в любых соотношениях с легкими спиртами. [5]
Растворимость метана в воде при давлениях до 6 МПа возрастает с понижением температуры. Растворимость газа в воде с увеличением давления также растет. Максимальное значение растворимости газа в воде при заданной температуре соответствует значению равновесного давления образования гидратов. [6]
Растворимость метана в воде невелика — около 30 л в 1 м3 воды при нормальных условиях. По мере увеличения давления метана растет и его растворимость. Поэтому в толщах пород на больших глубинах количество растворенного в воде метана может достигать 3 — 5 м3 и больше в 1 л 3 воды. [8]
Растворимость метана в углеводородах повышается с увеличением давления по прямолинейной зависимости. [9]
Растворимость метана растет при повышении давления. Это его свойство играет огромную роль при образовании залежей газа. Высока растворимость метана и его гомологов в нефти, и возрастает она также с повышением давления. Поэтому нефть повсеместно содержит растворенные в ней газы, которые при снижении давления во время добычи нефти выделяются из нее. При высоком давлении нефть может растворяться в углеводородных газах и углекислоте. [10]
Растворимость метана в углеводородах при этом значительно уменьшается. Растворимость в метане углеводородов при одинаковых критических давлениях хотя и повышается, при переходе от парафиновых к нафтеновым и ароматическим углеводородам, однако в значительно-меньшей степени. [11]
Растворимость метана в декалине значительно хуже, чем в цетане, но декалин растворяется в метане лучше, чем цетан. [12]
Растворимость метана в воде составляет около 4: 100 по объему. [13]
Исследование растворимости метана в сланцевом бензине показало, что до давлений 19 6 МПа в диапазоне температур от 25 до 150 С отклонения экспериментальных значений растворимости от теоретических ( согласно закону Генри) сравнительно невелики. [15]
Источник
Метан
Метан, CH4 – простейший по составу предельный углеводород, органическое вещество класса алканов.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в рудничном и болотном газах.
Также растворен в нефти, в пластовых и поверхностных водах.
В твердом состоянии встречается в виде газогидратов.
Метан – в обычных условиях легкий бесцветный газ, без вкуса и запаха.
Однако в метан, используемый в качестве технического газа, могут добавляться одоранты – вещества, имеющие резкий неприятный запах для предупреждения его утечки.
Метан является одним из парниковых газов.
Его вклад в парниковый эффект составляет 4-9 %.
Он пожаро- и взрывоопасен.
Почти не растворяется в воде и других полярных растворителях.
Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Метан по токсикологической характеристике относится к веществам 4 го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Метан трудно вступает в химические реакции.
В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства метана аналогичны свойствам других представителей ряда алканов.
Так как метан в большом количестве встречается в природе (например, содержится в природном газе, попутном нефтяном газе и выделяется при крекинге нефтепродуктов), его, как правило, не получают искусственно.
Его выделяют при очистке и сепарации из природного газа, ПНГ и нефти при перегонке.
Кроме того, его получают из метаногидратов (гидратов природного газа), в процессе эксплуатации биогазовых установок и пр.
Метан в промышленных и лабораторных условиях получается в результате следующих химических реакций:
1. газификации твердого топлива:
C + 2H2 → CH4 + H2O (повышенное давление и to, kat = Ni, Mo или без катализатора).
2. синтеза Фишера-Тропша:
CО + 3H2 → CH4 (kat = Ni, to = 200-300 о С);
3. реакции взаимодействия оксида углерода (IV) и водорода:
CО2 + 4H2 → CH4 + 2H2O (kat, to = 200-300 о С);
5. щелочного плавления солей одноосновных органических кислот
CH3-COONa + NaOH → CH4 + Na2CO3 (повышенная to).
Источник
метан
| Структурная формула | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||
| Общий | ||||||||||||||||||||||||||
| Фамилия | метан | |||||||||||||||||||||||||
| другие имена |
| |||||||||||||||||||||||||
| Молекулярная формула | CH 4 | |||||||||||||||||||||||||
| Краткое описание | ||||||||||||||||||||||||||
| Внешние идентификаторы / базы данных | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| характеристики | ||||||||||||||||||||||||||
| Молярная масса | 16,04 г моль -1 | |||||||||||||||||||||||||
| Физическое состояние | ||||||||||||||||||||||||||
| плотность |
| |||||||||||||||||||||||||
| Температура плавления | ||||||||||||||||||||||||||
| растворимость |
| |||||||||||||||||||||||||
| Дипольный момент | ||||||||||||||||||||||||||
| правила техники безопасности | ||||||||||||||||||||||||||
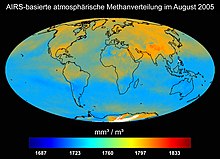
Метан представляет собой химическое соединение с молекулярной формулой CH 4 и простейшим представителем из группы веществ из алканов . В нормальных условиях это горючий газ без цвета и запаха . Метан не растворяется в воде и образует с воздухом взрывоопасные смеси. Он горит голубоватым пламенем в присутствии кислорода, достаточного для образования углекислого газа и воды . Помимо прочего, он встречается в природе как основной компонент природного газа . Поскольку он существует в изобилии в месторождениях, он является привлекательным источником энергии . Транспортировка осуществляется по трубопроводам или в виде замороженной жидкости цистернами . Он также встречается в виде гидрата метана, связанного на морском дне и в районах вечной мерзлоты , хотя точное количество неизвестно. Метан используется в качестве нагревающего газа и имеет большое значение в химической промышленности в качестве исходного материала для технических синтезов, таких как производство метанола или производство галогенированных производных метана. Он до сих пор используется для производства водорода в промышленных масштабах. Газ вырабатывается в значительных количествах в результате биотических процессов, либо анаэробно — микроорганизмами, либо аэробно — фитопланктоном , растениями и грибами. Антропогенные источники косвенно, например, выращивание риса и овец и скотоводства . Абиотические источники, такие как лесные пожары или извержения вулканов, также выделяют метан. Метан — самый распространенный углеводород в атмосфере Земли, концентрация которого колеблется между северным и южным полушариями, а также в зависимости от сезона. Как парниковый газ , метан обладает высоким потенциалом глобального потепления . Он способствовал глобальному потеплению в истории климата и влияет на текущее глобальное потепление . В земной атмосфере он окисляется до воды, формальдегида и, наконец, до двуокиси углерода. Метан является частью атмосферы других планет и лун и был обнаружен как в кометах, так и в межзвездной среде . оглавлениеэтимологияНазвание метан происходит от слова Méthylène . Это имя дали французские химики Жан-Батист Дюма и Эжен-Мельхиор Пелиго в 1834 году жидкости, которая сейчас известна как метанол ; он образован от древнегреческого μέθυ ( мети ) для «вина, опьяняющего напитка» и ὕλη ( hýlē ) для «дерева». Немецкий химик Август Вильгельм фон Хофманн впервые предложил систематическую номенклатуру в английской публикации в 1866 году , согласно которой название газа произошло от метилена и должно было называться метаном . Это дало начало немецкой форме метана . В древних текстах метан иногда упоминался как метиловый водород . историяАнтичность и позднее средневековьеМетан питает так называемые «вечные огни» как компонент утечки природного газа. Они были названы так потому, что о наличии пламени сообщалось в исторических записях в течение длительного периода времени. Эти пожары часто возникают в нефтеносных районах с тектоническими разломами, например, в Химайре (Ликия) . Уже с 2000 г. до н.э. Эти пожары известны. Вечный огонь в Баба Гургуре в Ираке , возможно, является огненной печью , которая уже описана в Библии в Книге Даниила и в которую соратники царя Навуходоносора Даниила Седрах, Мисах и Авденего бросили золотую статую, потому что они отказались поклоняться ( Дан. 3.23 ЕС ). Дельфийский оракул находился в храме Аполлона , который был построен около 1000 г. до н.э. над вечным огнем. Возможно, что гадание на Пифию произошло под влиянием вдыхания наркотических газов, таких как метан, этан и этен, известных как пневма , которые были обнаружены в следах в находящемся там источнике. Метан, компонент природного газа, уже использовался в энергетике в Китае в 4 веке до нашей эры для испарения рассола . В некоторых случаях и метан, и рассол просачивались из скважин, а в некоторых случаях газ подавался по бамбуковым трубопроводам из так называемых сухих скважин для обработки рассола. В то время природа газа была неизвестна, но алхимикам в средние века он был известен как компонент газов гниения , также известный как «болотный воздух». Возникновение рудничного газа , газовой смеси метана и воздуха , было известно на ранних этапах разработки подземных горных работ как опасность, поскольку источник воспламенения мог вызвать взрыв рудничного газа . 17-19 векаВ феврале 1659 года англичанин Томас Ширли исследовал источник горючей воды недалеко от Уигана . Он смог показать, что причиной этого явления была не вода, а газ, поднявшийся со дна плотины. Он подозревал, что газ поступал из нижележащего угольного месторождения и что это был шахтный газ . Осенью 1776 года священник Карло Джузеппе Кампи указал Алессандро Вольта на явление «горючего воздуха», поднимавшегося в излучине реки Ламбро. Это явление уже было исследовано и описано несколькими годами ранее Антуаном Лораном де Лавуазье , Бенджамином Франклином и Джозефом Пристли . Вольта попытался взболтать землю на болотах озера Маджоре с помощью палки и увидел, как поднимаются пузырьки газа. Он собирал газ в баллоны и количественно исследовал их с помощью разработанного им эвдиометра . Вольта также разработал так называемый пистолет Вольта , эвдиометр, в котором можно было воспламенить смесь воздуха и метана. В 1777 году он предложил использовать пистолет Вольта в качестве своего рода телетайпа . Через проводную линию между Миланом и Комо электрический импульс должен был взорвать смесь воздуха и метана в пистолетах Вольта, в результате чего серия таких разрядов представляла собой буквенно-цифровой код для передачи информации. Вольта описал свои исследования в письмах Карло Кампи, опубликованных в виде книги. Попытки использовать городской газ , смесь метана, окиси углерода , водорода и азота , для уличного освещения начались около 1800 года . В то время Уильям Генри исследовал свойства смесей горючих газов, такие как их растворимость в жидкостях в зависимости от парциального давления . Эта работа привела к формулировке закона Генри . Он определил относительную светимость газов и различия в их составе. Его результаты подтвердили предположение Джона Далтона о составе метана и этена и о том, что углерод и водород связаны друг с другом только в определенных пропорциях. После катастрофы на шахте Феллинга (Тайн и Уир) в 1812 году, одной из крупнейших горнодобывающих катастроф того времени, Хэмфри Дэви обнаружил, что опасный шахтный газ состоял в основном из метана. Потеря 92 человек стала одной из движущих сил разработки лампы Дэви с пламенным экраном . Примерно в 1821 году Уильям Харт, известный как «отец природного газа», нашел первую в США скважину с природным газом во Фредонии . Газ использовался на месте для освещения. В 1858 году Харт основал первую газовую компанию в США — Fredonia Gas Light Company. 20 векКогда начиналась добыча сырой нефти, метан, основной компонент одновременно добываемого природного газа, обычно сжигался на устье скважины . Один из первых крупных трубопроводов был построен в 1891 году. Его длина составляла 193 километра, и он соединял скважины с природным газом в Индиане и Чикаго . В начале расширения и более интенсивного использования трубопроводов природного газа в 1930-х годах в трубопроводах природного газа был обнаружен гидрат метана, который образовывался из метана и воды и забивал трубопроводы. Только после Второй мировой войны достижения в области трубопроводных технологий позволили расширить трубопроводную инфраструктуру и использовать метан в качестве компонента природного газа в промышленных целях, а также в личных целях для отопления и приготовления пищи. С ростом глобального спроса на энергию метан становится постоянно растущим фактором мирового производства первичной энергии. Между 1980 и 1990 годами эта доля выросла с 18 до 22%. ВхождениеЗемнойНаряду с аммиаком и водяным паром метан был основным компонентом первозданной атмосферы Земли . Это происходит по-разному и постоянно переформируется на Земле , например, в технических, биологических или геологических процессах, таких как серпентинизация . Концентрация метана в атмосфере Земли более чем удвоилась с 0,73 до 1,869 частей на миллион с 1750 по 2018 год и, таким образом, достигла самого высокого уровня за 800000 лет. После выхода из строя спутника Envisat японский спутник наблюдения за парниковыми газами (GOSAT) и спектрометр Tropomi спутника Sentinel 5P предоставляют данные о глобальном распределении концентраций метана в атмосфере. Еще одну миссию Sentinel по наблюдению за составом атмосферы планируется начать в 2023 году . В атмосфере метан сначала реагирует с кислородом с образованием формальдегида и, возможно, озона. Дальнейшее окисление в конечном итоге приводит к образованию диоксида углерода. С. ЧАС 4-й + 4-й О 2 ⟶ С. ЧАС 2 О + 2 О 3 + ЧАС 2 О <\ Displaystyle \ mathrm Микроорганизмы составляют большую часть наземного метана. При гниении органических веществ в герметичных условиях на болотах или в донных отложениях на дне водоемов образуется болотный газ , смесь метана и углекислого газа . Биогаз содержит около 60% метана и около 35% углекислого газа, помимо меньшего количества водорода , азота и сероводорода . Образование происходит биотически у поверхности : с одной стороны, анаэробно, в ходе метаногенеза, в основном из ацетата , но также из углекислого газа, среди прочего, группой архей , метаногенов . Они используют простые соединения, такие как диоксид углерода или метанол, и восстанавливают их до метана, в результате чего они генерируют энергию — в первую очередь за счет связанного окисления партнеров реакции. Например, когда метан и вода образуются из CO 2 и водорода (H 2 ) в стандартных условиях при значении pH, равном семи, выделяется около 131 кДж / моль свободной энтальпии (энергия Гиббса, ΔG 0 ‘ ): С. О 2 + 4-й ЧАС 2 → С. ЧАС 4-й + 2 ЧАС 2 О <\ displaystyle \ mathrm Небольшая часть биотического образования основана на аэробном расщеплении метилфосфонатов . Под поверхностью земли метан создается в более глубоких недрах при высоких температурах и давлениях и в основном выделяется во время вулканической активности . Как компонент природного газа , его концентрация колеблется от 35 до 98% в зависимости от месторождения. Другими компонентами природного газа могут быть высшие углеводороды, особенно этан , а также диоксид углерода и азот. «Влажный газ», который обычно встречается вместе с сырой нефтью , содержит углеводороды, такие как пентан, гексан, гептан и даже высшие углеводороды, в то время как «сухой» природный газ содержит метан в качестве основного компонента. Шахтный газ, задерживаемый в угольных месторождениях, в основном содержит метан. Он может развиваться абиотически- термическим путем в контексте процесса созревания угля в геохимической фазе углефикации , а также от всех типов керогенов и нефти. В 2008 году было доказано, что метан из гидротермальных источников Лост-Сити имеет геохимическое происхождение. Метан, выходящий со дна океана, вступает в реакцию с водой под высоким давлением и низкой температурой с образованием твердого гидрата метана , который также известен как «метановый лед». Содержание углерода в мировых месторождениях гидрата метана оценивалось примерно в 11 000 гигатонн в конце 1980-х годов , содержание углерода в доказанных запасах природного газа, угля и нефти составляет около 5 000 гигатонн. Более поздние оценки предполагают гораздо меньшее количество отложений, которые составляют около 1800 гигатонн углерода. Инопланетянин
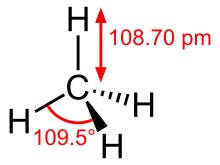
Атмосфера планет Марс , Юпитер , Сатурн , Уран , Нептун и карликовая планета Плутон также содержат метан, как и атмосферы лун, таких как Титан или Энцелад . После водорода и гелия метан является третьим по распространенности компонентом атмосферы Урана. Из-за полос поглощения в красном и ближнем инфракрасном диапазоне Уран выглядит аквамариновым или голубым. Немного более светлые синие оттенки Сатурна, вероятно, связаны с тем же эффектом. За пределами нашей Солнечной системы метан был первой органической молекулой, обнаруженной на экзопланете HD 189733 b типа Горячий Юпитер . В спектрах поглощения холодных коричневых карликов , известных как метан- Т-карлики , преобладают метан и вода. Существуют также более горячие, так называемые L-карлики , которые также обладают характеристиками поглощения метана, но слабее, чем у T-карликов. В 2009 г. на Марсе были зарегистрированы извержения метана ; метан был обнаружен в атмосфере Марса, около 10,5 частей на миллиард . Поскольку он обычно не может оставаться в атмосфере и нет свидетельств наличия метеоритов в качестве источника, он должен был образоваться недавно на планете, что может указывать на наличие жизни на Марсе . Метан может иметь вулканическое происхождение, свидетельств о котором на Марсе пока не обнаружено. Богатая метаном изначальная атмосфера на Марсе и вызванный ею парниковый эффект могут предложить объяснение парадокса слабого молодого Солнца . Низкий уровень излучения молодого Солнца в первые дни противоречит температуре поверхности Марса выше точки замерзания воды, на что есть указания по следам текущей и стоячей воды в доисторические времена Марса. титанНа спутнике Сатурна Титане есть почти тройная точка метана при -180 ° C и атмосферном давлении около 1,6 бар . Таким образом, метан может присутствовать на этой Луне во всех трех агрегатных состояниях. Есть облака метана, из которых идут метановые дожди, которые текут через реки, включая Вид Флумина , в метановые озера, где он снова испаряется и, таким образом, образует замкнутый цикл метана, аналогичный круговороту воды на Земле. Жидкий метан прозрачен для радарных лучей, поэтому космический зонд Cassini смог определить глубину озера Лигейя-Маре, равную 170 м. На этих озерах, вероятно, есть айсберги из метана и этана. Они плавают в метановых озерах, если они содержат не менее 5% газообразного азота . Если температура снизится незначительно, азот сжимается настолько, что лед опускается на дно. Если температура снова повысится, грунтовый лед снова может подняться на поверхность озера. При определенных температурах поверхностный и грунтовый лед могут образовываться одновременно. Этан было установлено, что основным компонентом в Онтарио Lacus , озеро недалеко от южного полюса Титана . ЭнцеладЭнцелад извергает колонны извержения соленой воды, смешанной с аммиаком и следами метана и высших углеводородов. Это интерпретируется как результат гидротермальной активности в океане жидкой воды под поверхностью Луны. Там могут происходить аналогичные химические реакции, которые дадут возможность жизни в непосредственной близости от гидротермальных источников в глубоком море на Земле. Также присутствует молекулярный водород, который может метаболизироваться метаногенными микробами. Поэтому было предложено несколько миссий для дальнейшего изучения Энцелада и оценки его обитаемости. Извлечение и представлениеДобыча как природный газПомимо метана, природный газ может содержать другие газы, такие как этан, высшие углеводороды, кислые газы, такие как сероводород и диоксид углерода, и инертные газы, такие как азот, гелий и другие благородные газы . Так называемые «сухие природные газы» содержат от 75 до 95% метана. Обычно нет отделения от других углеводородных компонентов, но отделяются кислые газы и инертные газы. В 19 веке метан появился как компонент природного газа, первоначально как нежелательный побочный продукт добычи нефти. Поскольку в то время не было достаточного количества транспорта и носителей для хранения добытого количества, его в основном просто сжигали в газовых факелах . Этот метод все еще используется сегодня, если нет коммерчески жизнеспособных альтернатив. Часть газа вдавливается в землю. В качестве альтернативы его можно сжижать путем охлаждения и транспортировать как сжиженный природный газ . Производство биогазаБиогаз — это газовая смесь, которая возникает в результате микробного разложения органических веществ в отсутствие кислорода и состоит примерно на две трети из метана и на одну треть из двуокиси углерода. Биогаз образуется генераторами метана в результате метаногенеза сельскохозяйственных и зеленых отходов, сточных вод, пищевых отходов и отходов животноводства и считается возобновляемым источником энергии. Метан, образующийся на биогазовых установках, можно использовать, например, в качестве топлива. Получается из гидрата метанаИзвлечение гидрата метана может помочь решить земные энергетические проблемы, но это проблематично. Особая проблема заключается, например, в том, что много метана попадет в атмосферу Земли во время восстановления и, как очень эффективный парниковый газ , будет способствовать дальнейшему нагреванию и, следовательно, дальнейшему высвобождению метана. Кроме того, производство гидрата метана сопряжено с риском. Первые попытки финансирования уже предпринимаются. Последствия чрезмерной эксплуатации в значительной степени необъяснимы; Исследователи опасаются, что континентальные склоны , которые в основном состоят из метанового льда, могут стать нестабильными в результате добычи. Из-за глобального потепления и связанного с ним потепления морской воды некоторые исследователи опасаются, что гидрат метана будет таять и испаряться. Это также принесет метан в атмосферу Земли в качестве парникового газа и усилит антропогенный парниковый эффект. Выброс метана из тающей вечной мерзлоты — еще один решающий элемент изменения климата . МетанированиеМетанирование или процесс Сабатье это процесс , используемый для генерации синтетического природного газа. В этом процессе уголь или другие углеродсодержащие материалы превращаются в монооксид углерода или диоксид углерода посредством газификации угля , которые затем каталитически превращаются в метан с водородом. Эта реакция была обнаружена в 19 веке французом, лауреатом Нобелевской премии Полем Сабатье и названа в его честь. С. О + 3 ЧАС 2 → С. ЧАС 4-й + ЧАС 2 О Δ ЧАС 0 знак равно — 206 , 2 k J / м О л <\ displaystyle \ mathrm Реакция не используется в больших масштабах для производства метана, но она играет роль в удалении следов моноксида углерода, который действует как каталитический яд в некоторых процессах. Лабораторные синтезыЕсть два метода производства карбида алюминия . Карбид алюминия может реагировать с водой с образованием оксида алюминия и метана или с хлористым водородом с образованием хлорида алюминия и метана. Эти методы в основном используются только в лаборатории. А. л 4-й С. 3 + 12-е ЧАС 2 О ⟶ 4-й А. л ( О ЧАС ) 3 + 3 С. ЧАС 4-й <\ displaystyle \ mathrm Термическое разложение ацетата натрия — еще один источник для представления в лабораторном масштабе . С. ЧАС 3 — С. О О N а + N а О ЧАС ⟶ N а 2 С. О 3 + С. ЧАС 4-й <\ displaystyle \ mathrm характеристикиФизические свойстваМетан плавится при -182,6 ° C и кипит при -161,7 ° C. Из -за неполярных свойств он плохо растворяется в воде , но хорошо растворяется в этаноле и диэтиловом эфире . Теплота плавления и теплота парообразования составляют 1,1 кДж / моль и 8,17 кДж / моль. Теплотворная Н я это 35,89 МДж · м -3 или 50,013 МДж кг -1 . Стандарт энтропия 188 Дж моль -1 К -1 , то теплоемкость 35.69 Дж моль -1 К -1 . Тройной точки метана 90.67 К и 0,117 бар, то критическая точка является 190,56 К и 45,96 бар. Твердый метан существует в нескольких модификациях , на данный момент известно девять различных. Когда метан охлаждается при нормальном давлении, образуется метан I. Это кубическое кристаллизующееся вещество, пространственная группа Fm 3 m (пространственная группа № 225) . Положение атомов водорода не фиксировано, что означает, что молекулы метана могут свободно вращаться. Следовательно, это пластиковый кристалл . Шаблон: room group / 225 Молекулярные свойстваМолекула метана состоит из атома углерода (C), с которым ковалентно связаны четыре атома водорода (H) , что делает ее самым простым представителем алканов C n H 2 n +2 (с n = 1). В центре молекулы находится атом углерода, вокруг которого атомы водорода расположены в тетраэдрическом порядке на расстоянии 108,7 пикометров (пм). Тетраэдрическая структура, оптимально реализуемая в случае молекулы метана со средним по времени валентным углом H — C — H 109,5 °, является фундаментальной для структуры насыщенных углеводородов и, следовательно, обычно используется в начале каждого введения в органическую химию . Качественно это регулярное расположение четырех идентичных атомов H вокруг центрального атома C можно понять уже на простой картине VSEPR , поскольку таким образом атомы H — и, следовательно, повышенная плотность электронов вдоль осей связей C — H — являются максимально возможное Уберите их друг от друга, что минимизирует эффекты отталкивания. Четыре одинаково длинные связи C — H могут быть описаны в контексте теории локализованных валентных связей с использованием гибридных орбиталей следующим образом: атом C является sp 3- гибридизованным, четыре связи C — H σ возникают в результате попарного перекрытия одной из четырех sp 3 -Гибридные орбитали с 1s-орбиталью одного атома H каждая. Однако эта модель с четырьмя энергетически эквивалентными орбиталями не может объяснить экспериментально определенный электронный спектр метана, а также противоречит теоретическим расчетам . Теория молекулярных орбиталей дает описание, которое согласовывает теорию и эксперимент . Получена электронная конфигурация метана в основном состоянии (1a 1 ) 2 (2a 1 ) 2 (1t 2 ) 6 , в результате чего молекулярная орбиталь 1a 1 по существу соответствует атомной орбитали 1s атома C вблизи ядра . Два различных энергетических уровня для валентных электронов — относительно низкоэнергетическая орбиталь 2a 1 и тройной вырожденный t 2 — HOMO — соответствуют измеренным значениям энергии ионизации 23 и 14 электрон-вольт . Благодаря симметрии тетраэдра они могут быть разработаны с использованием подхода ЛКАО с адаптированными к симметрии линейными комбинациями орбиталей H-1s. Наложив все молекулярные орбитали, сформулированные таким образом, мы снова получаем четыре эквивалентных связи C — H, как в модели гибридных орбиталей.
Результаты измерений, полученные с помощью инфракрасной и рамановской спектроскопии, соответствуют тетраэдрической симметрии. Есть четыре нормальные моды для молекулярных колебаний примерно при 2914, 1534, 3018 и 1306 см -1 , которые обозначены как ν 1 , ν 2 , ν 3 и ν 4 . Колебания ν 2 (только в случае взаимодействия с другими молекулами, т.е. нарушения симметрии), ν 3 и ν 4 являются инфракрасными. Измеряемый спектр колебаний состоит из линейных комбинаций этих нормальных мод, каждая в диапазоне от 4800 см -1 до диады (две комбинации в диапазоне 940-1850 см -1 ), пентады (пять комбинаций в диапазоне 2150 см -1 ). –3350 см –1 ) и Octad (восемь комбинаций в диапазоне 3550–4800 см –1 ), а также некоторые переходы между возбужденными состояниями различных полиад (так называемые горячие полосы ). Химические свойстваПо сравнению с другими алканами связь CH в метане имеет более высокую энергию связи . В реакциях с радикальным отрывом атома водорода метан обычно является наименее реакционноспособным алканом. Катион метила (CH 3 + ) — наиболее нестабильный ион карбения . Следовательно, метан также не очень активен в реакциях с отводом гидридов . В реакциях переноса электрона метан обычно реагирует вяло из-за своего высокого потенциала ионизации . Фотохимически возбужденный метан реагирует с атомами железа, меди или алюминия в матрице метана при низких температурах, вставляя металл в связь H — C с образованием металлического комплекса, такого как H — Fe — CH 3 . Метан устойчив к обычным кислотам и щелочам. С суперкислотами, такими как гексафторантимоновая кислота , метан может быть протонирован до иона метания (CH 5 + ). Название метаний было выбрано по аналогии с ионом аммония . Его нельзя окислить окислителями, такими как перманганат калия или дихромат калия . С окислителями, такими как пероксодисульфаты или соли церия (IV), метан образует монометиловый эфир (CH 3 -OSO 3 H) в серной кислоте . Метан легко воспламеняется и горит в воздухе голубоватым пламенем без образования сажи . В результате реакции молекулы метана с двумя молекулами кислорода образуются две молекулы воды и одна молекула диоксида углерода. Он может взрывоопасно реагировать с кислородом или хлором , что требует начального воспламенения (подачи энергии активации ) или катализа . С кислородом метан — это разные реакции , в зависимости от того, сколько кислорода доступно для реакции. Полное сгорание метана с оптимальным выходом энергии возможно только при наличии достаточного количества кислорода . С. ЧАС 4-й + 2 О 2 → С. О 2 + 2 ЧАС 2 О Δ ЧАС 0 знак равно — 802 , 4-й k J ⋅ м О л — 1 <\ displaystyle \ mathrm Однако, если подача кислорода недостаточна, образуются побочные продукты, такие как окись углерода (CO) и углерод ( сажа ). Кроме того, в этом случае полезная энергия ниже. 2 С. ЧАС 4-й + 3 О 2 → 2 С. О + 4-й ЧАС 2 О <\ Displaystyle \ mathrm <2 \, ch_ <4>+3 \, O_ <2>\ rightarrow 2 \, CO + 4 \, H_ <2>O>> Под воздействием света, метан вступает в реакцию замещения с хлором и бромом , причем атомы водорода заменяются атомами галогена. Такая реакция часто приводит к множественным заменам, поскольку первоначально образовавшийся моногалогенированный продукт имеет более слабые связи НС, чем сам метан, и поэтому избирательно дополнительно окисляется. Соединения йода могут быть получены путем обмена галогенов. Под действием пара при высоких температурах и в условиях катализа образуются водород, монооксид углерода и диоксид углерода. Так называемый паровой риформинг — это технический процесс, с помощью которого производятся водород и синтез-газ. При температуре около 2000 ° C этин образуется при быстром охлаждении . Без охлаждения метан распадается на элементы примерно с 1100 ° C. При температуре около 1200 ° C метан реагирует с аммиаком с образованием цианистого водорода и водорода. использоватьМетан в основном используется в качестве отопительного газа для выработки тепла и для работы двигателей посредством сгорания. В период с 1950 по 2020 год использование метана в качестве компонента природного газа увеличилось примерно в 5 раз. В дополнение к метану из природного газа , биогаз ( биометан ) с содержанием метана от 50 до 70% из навоза , жидкого навоза , Для этого получают осадок сточных вод или органические отходы. В прошлом, метан был получен путем пиролиза из древесины , который производит древесный газ ( газификации древесины ). Древесный газ, содержащий, помимо прочего, метан, использовался для питания гражданских автомобилей из-за нехватки нефти во время Второй мировой войны . Отопительные дровяные газификаторы в основном строились снаружи. Сегодня неочищенный биогаз из очистных сооружений часто преобразуется непосредственно в электричество с помощью двигателей внутреннего сгорания. Использовать как топливо и топливоИз-за высокого отношения водорода к углероду в метане при сгорании выделяется большее количество энергии на одну высвобождаемую молекулу углекислого газа, чем при сгорании жидких углеводородов на основе нефти, приблизительное соотношение водорода и углерода в которых составляет около двух, или угля с приблизительным содержанием водорода. к углероду Отношение углерода равно единице. Из-за высокого молярного отношения водорода к углероду, равного 4: 1, в метане, при сжигании метана выделяется большее количество энергии на одну высвободившуюся молекулу углекислого газа, чем при сжигании любого другого углеродсодержащего источника энергии. С. + О 2 → С. О 2 Δ ЧАС С. знак равно 393 , 5 k J ⋅ м О л — 1 <\ displaystyle \ mathrm При использовании метана в качестве альтернативного топлива в двигателях около 2% метана не сгорает и его необходимо преобразовать с помощью каталитического нейтрализатора транспортного средства . До внедрения системы дополнительной обработки выхлопных газов и топлива, не содержащего серы, топливо на основе метана имело более низкий потенциал подкисления и эвтрофикации и меньшее воздействие на здоровье человека, чем сжигание дизельного топлива . Это было связано с меньшими выбросами оксидов азота при сгорании. В транспортных средствах, соответствующих действующему стандарту выбросов , выбросы после доочистки выхлопных газов находятся на одинаковом уровне независимо от топлива. Использование в качестве химического сырьяМетан — важный исходный продукт для технического синтеза этина , цианистого водорода , сероуглерода , галогеналканов и многих других органических соединений . Метан — важное сырье для производства водорода и окиси углерода. Дальнейшая химия смесей водорода и окиси углерода разнообразна. Они используются, среди прочего, для производства метанола или в синтезе Фишера-Тропша для производства алканов. Паровой риформинг и частичное окислениеПаровой риформинг с частичным окислением, конверсией CO и абсорбцией диоксида углерода
| ||||||||||||||||||||||||||
Реформинга с водяным паром , то частичное окисление и вода-газ сдвига реакцию крупномасштабные реакции проводили. Первым продуктом парового риформинга является газовая смесь, известная как синтез- газ, которая используется, среди прочего, для производства метанола .
С. ЧАС 4-й + ЧАС 2 О → С. О + 3 ЧАС 2 Δ ЧАС знак равно + 206 , 2 k J / м О л <\ displaystyle \ mathrm
Частичное окисление метана также осуществляется как каталитический процесс. Метан реагирует с кислородом в экзотермической реакции с образованием окиси углерода и водорода. Таким образом, потребность в энергии для частичного окисления ниже, чем для парового риформинга, но для этого требуется использование чистого кислорода в качестве реагента. Также существует опасность взрыва, если условия процесса нестабильны.
2 С. ЧАС 4-й + О 2 → 2 С. О + 4-й ЧАС 2 <\ Displaystyle \ mathrm <2 \ ch_ <4>+ O_ <2>\ rightarrow 2 \ CO + 4 \, H_ <2>>>
Комбинация обоих процессов, в которой частичное окисление покрывает энергетические потребности парового риформинга, называется автотермическим риформингом .
Если водород является целевым продуктом, полученный монооксид углерода превращается с дополнительным количеством воды в так называемой установке вторичного риформинга, реакции конверсии водяного газа, с образованием диоксида углерода и дополнительного водорода. Контакты оксида железа (III) служат катализаторами .
С. О + ЧАС 2 О ⇌ С. О 2 + ЧАС 2 Δ ЧАС Р. 298 0 знак равно — 41 год , 2 k J / м О л <\ displaystyle \ mathrm
98% водорода, произведенного в 2010 году, было произведено путем парового риформинга. Побочные продукты парового риформинга и частичного окисления разнообразны. В зависимости от монооксида углерода в соотношении водорода, синтез — газ используется для производства метанола или для гидроформилирования из олефинов . Чистый водород используется для производства аммиака в процессе Габера-Боша или для гидрирования .
Термокаталитическое разложение
В трех упомянутых процессах в качестве дополнительного продукта получают либо монооксид углерода, либо диоксид углерода. Путь к водороду без диоксида углерода заключается в термическом или термокаталитическом разложении метана на углерод и водород. Производство водорода из метана с отделением углерода предлагает способ получения энергии из водорода путем сжигания или в топливных элементах также без диоксида углерода.
С. ЧАС 4-й ⟶ С. + 2 ЧАС 2 + 75 , Шестой k J / м О л <\ displaystyle \ mathrm
В качестве катализатора используется никель , который можно использовать либо в виде сетки, либо в виде соли никеля на различных носителях. По сравнению с чисто термическим разложением, которое происходит при температуре около 1200 ° C, уровень температуры термокаталитического разложения составляет от 500 до 600 ° C.
Производство этина
Для производства этина из метана были разработаны различные процессы, такие как автотермическое сжигание в процессе Саксе-Бартоломе . Этин также можно получить термическим расщеплением метана в электрической дуге при температурах от 2000 до 3000 ° C в соответствии со следующим уравнением:
2 С. ЧАС 4-й → С. 2 ЧАС 2 + 3 ЧАС 2 Δ ЧАС 0 знак равно + 398 k J ⋅ м О л — 1 <\ Displaystyle \ mathrm <2 \, ch_ <4>\ rightarrow C_ <2>H_ <2>+3 \, H_ <2>> \ qquad \ Delta H ^ <0>= + 398 \; \ mathrm <кДж \ cdot mol ^ <- 1>>>
Сажа образуется как побочный продукт. Окислительное сочетание метана с этином через реакцию с кислородом также возможно, селективность по этину довольно низкая и составляет 20%.
Производство сероуглерода
Помимо кислорода , метан вступает во множество других реакций, например с серой . Реакция на сероуглерод протекает при температуре около 600 ° C в присутствии катализаторов на основе силикагеля или оксида алюминия :
С. ЧАС 4-й + 4-й С. → С. С. 2 + 2 ЧАС 2 С. <\ displaystyle \ mathrm
Сероуглерод широко используется при производстве вискозы .
Производство цианистого водорода
В процессе Андруссова метан реагирует с аммиаком в присутствии кислорода с образованием цианистого водорода и воды.
2 С. ЧАС 4-й + 2 N ЧАС 3 + 3 О 2 → 2 ЧАС С. N + Шестой ЧАС 2 О <\ Displaystyle \ mathrm <2 \, ch_ <4>+2 \, NH_ <3>+3 \, O_ <2>\ rightarrow 2 \, HCN + 6 \, H_ <2>O>>
В процессе BMA компании Degussa метан реагирует с аммиаком в присутствии платинового катализатора при температуре около 1200 ° C с образованием цианистого водорода.
С. ЧАС 4-й + N ЧАС 3 → ЧАС С. N + 3 ЧАС 2 <\ displaystyle \ mathrm
Цианистый водород используется для получения адипонитрила , промежуточного продукта при производстве нейлона 6,6 , путем гидроцианирования , каталитического присоединения цианистого водорода к 1,3-бутадиену . Производство ацетона осуществляется каталитическим добавлением цианистого водорода к ацетону. Кроме того, α- аминокислота DL — метионин , использование в корм для животных — добавки происходит, и гетероцикл цианурхлорида , полученного из цианистого водорода.
Производство галометанов
Хлорирование метана может происходить каталитически, термически или фотохимически. В случае хлорирования после всех трех процессов, помимо хлорметана , образуются более хлорированные продукты — дихлорметан , хлороформ и четыреххлористый углерод . Более высокозамещенные продукты образуются в начале реакции, когда еще остается достаточно непрореагировавшего метана. Реакция сильно экзотермична с примерно 100 килоджоулей на реакцию замещения:
С. ЧАС 4-й + С. л 2 ⟶ С. ЧАС 3 С. л + ЧАС С. л <\ displaystyle \ mathrm 



Фотохлорирования метана происходит при воздействии с участием метильных и хлором радикалов в качестве носителей цепи в соответствии со следующей схемой:
С. л 2 → ЧАС ν С. л ⋅ + ⋅ С. л ( K е т т е п s т а р т ) <\ displaystyle \ mathrm 



Высшие галогенированные продукты получают по той же схеме, причем целевой синтез хлороформа предпочтительно происходит посредством хлорирования ацетона, а синтез четыреххлористого углерода посредством хлорирования сероуглерода.
С. ЧАС 3 С. л + С. л 2 ⟶ С. ЧАС 2 С. л 2 + ЧАС С. л <\ displaystyle \ mathrm 


Производные хлорированного метана находят широкое применение в промышленности. Метилхлорид используется для производства метилцеллюлозы , ранее из него производили тетраметилсвинец . Дихлорметан в основном используется в качестве растворителя. Бромметан используется для борьбы с вредителями при фумигации почвы и фумигации транспортных контейнеров.
Биологическое значение
Метаногенные археи
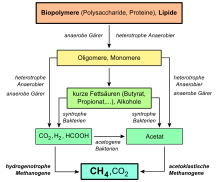
Метаногенез в метана производителей из области в архебактерий или первобытных бактерий является одной из форм анаэробного дыхания. Диоксид углерода, уксусная кислота и соединения C1, такие как метанол и муравьиная кислота, служат источниками углерода . Преобладающая часть наземного метана поступает в результате биотического метаногенеза за счет восстановления диоксида углерода биологически произведенным водородом, а также за счет разложения уксусной кислоты на диоксид углерода и метан путем расщепления уксусной кислоты, ацетокластических образователей метана.
Метанотрофные микробы
Метан окисляется некоторыми метанотрофными прокариотами , такими как Methylococcus capsulatus , в воде и почве кислородом с образованием диоксида углерода и воды. Это могут быть бактерии или археи, которые растут в аэробных или анаэробных условиях. Эта реализация является экзергонической, и прокариоты используют ее в качестве источника энергии. Их часто можно найти рядом с источниками метана, например, в водно-болотных угодьях или в водной среде. Из-за его роли в качестве стока метана, который снижает выбросы метана в атмосферу, исследуется его возможное положительное влияние на уменьшение глобального потепления.
Метан — движущая сила жизни в пещерах и подземных реках полуострова Юкатан . Метан, растворенный в воде, преобразуется бактериями и, таким образом, составляет основу местной пищевой сети. Живущие там ракообразные, например, получают до 21% своей пищи косвенно из метана через метанотрофные микробы.
Метан преобразуется, среди прочего, с помощью фермента метанмонооксигеназы , который катализирует окисление до метанола . Метанмонооксигеназа находится в растворимой форме с двумя связанными кислородом атомами железа в активном центре и нерастворимой форме, которая содержит атом меди в активном центре.
Зоопарк и фитопланктон
Морские водоросли, такие как Emiliania huxleyi и другие гаптофиты, производят значительное количество метана в океане: эксперименты с 13 C-меченными субстратами, такими как гидрокарбонат , метилированные соединения серы, такие как диметилсульфид , диметилсульфоксид и метионинсульфоксид, привели к образованию 13 C -обогащенный метан. Полевые исследования, например в Тихом океане, показали, что производство метана водорослями, вероятно, является обычным и важным процессом в морских поверхностных водах. Когда водоросли поедаются, зоопланктон также выделяет метан, который, как полагают, образуется в пищеварительном тракте. Одним из возможных механизмов является превращение вновь образованных метиламинов, таких как метиламин и триметиламин .
Экологическая значимость
Метан как парниковый газ мог вызвать самое массовое вымирание в фанерозое около 252 миллионов лет назад . Увеличение его концентрации в атмосфере Земли в наше время — один из аспектов антропоцена . Согласно двум исследованиям Global Carbon Project , более 60% выбросов метана в 2017 году приходилось на человеческую экономику.
Атмосферная химия
Поскольку газ без цвета и запаха имеет меньшую плотность, чем воздух, он поднимается в более высокие слои атмосферы Земли . Там он действует как парниковый газ и в 20-30 раз эффективнее углекислого газа, хотя в гораздо меньших количествах, чем в атмосфере. В кислородсодержащей атмосфере метан медленно окисляется, в частности, гидроксильными радикалами до диоксида углерода и воды. Этот процесс идет медленно, период полураспада оценивается в 12 лет. По другим оценкам, время пребывания в атмосфере составляет 8–15 лет и мало по сравнению с другими парниковыми газами.
Потенциал глобального потепления
Его потенциал глобального потепления в течение 100 лет в 28 раз выше, чем у того же количества двуокиси углерода по весу . Согласно более позднему исследованию, этот коэффициент равен 33, если учесть взаимодействие с атмосферными аэрозолями . Через 20 лет этот коэффициент повышается до 84. Метан вносит от 20 до 30% в антропогенный парниковый эффект. По оценкам Программы Организации Объединенных Наций по окружающей среде , меры по борьбе с выбросами метана могут привести к повышению средней глобальной температуры почти на 0,3 ° C медленнее, чем ожидалось, к 2045 году. По сравнению с углекислым газом, метан разлагается в атмосфере Земли за более короткий период времени.
Источники метана
Концентрация метана ежегодно увеличивалась в период с 2000 по 2006 год примерно на 0,5 частей на миллиард , а с 2006 года — более чем в десять раз. Это означает, что в атмосфере Земли гораздо больше метана , чем когда-либо за последние 650 000 лет. Исследование, проведенное учеными из Университета Рочестера, опубликованное в феврале 2020 года, дает убедительные доказательства того, что естественным путем из геологических источников улетучивается примерно в десять раз меньше метана, чем предполагалось ранее. И наоборот, продвижение ископаемых источников энергии (нефти, газа и угля) имеет значительно более высокую долю выбросов метана.
Ежегодно на Земле выбрасывается около 600 миллионов тонн метана. В Германии выбросы снизились с 121,2 млн тонн до примерно 52,6 млн тонн эквивалента CO 2 в период с 1990 по 2018 год .
В начале 2014 года исследовательский журнал Science сообщил после мета-исследования более 200 исследований, что Агентство по охране окружающей среды США (EPA) заявило, что выбросы метана в США были слишком низкими в течение 20 лет. В Соединенных Штатах ежегодно в атмосферу выбрасывается на 40 миллионов тонн больше, чем предполагалось ранее, как из естественных источников, так и от домашнего скота, например 88 миллионов голов крупного рогатого скота в стране, а также из-за утечек в конвейерах и трубопроводах . Основываясь на данных полевых измерений, ежегодные выбросы метана из цепочки поставок нефти и газа оцениваются примерно в 13 миллионов тонн в год, что на 60% выше оценок Агентства по охране окружающей среды США. В случае добычи нефти и газа измеренные выбросы даже вдвое превышают официальные оценки. С помощью спектрометра Tropomi только в 2018 году в Пермском бассейне в Техасе были измерены годовые выбросы в размере 2,9 ± 0,5 миллиона тонн. Пока (2014 г.) неясно, в какой степени неверная информация влияет на расчетные модели развития глобального климата.
Гидроразрыв
Выбросы метана значительно увеличились, особенно в США. Это может быть связано с добычей сланцевого газа путем гидроразрыва пласта ( гидроразрыва пласта ). Существует значительная неопределенность в отношении степени утечки метана, связанной с гидравлическим разрывом пласта, и признаки того, что утечки могут свести на нет преимущества сжигания природного газа по сравнению с другими ископаемыми видами топлива. Согласно исследованию, опубликованному в 2020 году, установки гидроразрыва выделяют в два раза больше метана, чем предполагалось ранее. Предполагается, что установки гидроразрыва пласта в Пенсильвании имеют уровень утечки приблизительно 10%, что, как полагают, является типичным для отрасли гидроразрыва пласта в Соединенных Штатах в целом. Выбросы метана в районе формации Марцеллус оцениваются примерно в 0,67 миллиона тонн в год.
Вечная мерзлота
Выброс метана из вечной мерзлоты и морского дна — возможное следствие и еще одна причина глобального потепления. Метан как геологического, так и биологического происхождения выделяется из арктических вечномерзлых почв, биогенов, путем преобразования вечной мерзлоты в водно-болотные угодья. Биогенный метан выделяется в зависимости от погодных условий, таких как температура и количество солнечных лучей, в то время как метан геологического происхождения выделяется независимо.
Добыча и транспортировка нефти и угля
Значительные количества метана выбрасываются из-за необнаруженных утечек на нефтеперерабатывающих заводах, а также при транспортировке нефти и газа по трубопроводам . Международное энергетическое агентство (МЭА) в Париже оценивается эта сумма в конце 2017 года, составит около 75 миллионов тонн в год и , таким образом , 1,7% от общего объема производства.
Исследования показывают, что выбросы метана из угольных шахт сильно недооцениваются. Например, в 2014 году в районе Четырех Углов с помощью спутниковых данных были обнаружены массивные выбросы метана с близлежащих участков добычи угля . По оценкам, выбросы метана в год составляют 600 000 тонн, что превышает выбросы всей британской нефтегазовой и угольной промышленности.
Утечки в газовой инфраструктуре могут привести к значительным выбросам метана. Например, в 2015 году утечка в подземном хранилище в каньоне Алисо привела к массовому выбросу природного газа, в результате чего было выделено около 100 000 тонн метана. В результате выброса в Огайо в 2018 году за 20 дней было выброшено около 57000 тонн метана.
Выращивание риса, козоводство, овцеводство и животноводство
Около 70% микробных выбросов метана на Земле связано с деятельностью человека. 39% выбросов метана в сельском хозяйстве и животноводстве приходится на животноводство, а 17% — на выращивание влажного риса . Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО) приписано только под пятой антропогенных выбросов парниковых газов в животноводческом секторе в 2006 году, чуть больше , чем транспортный сектор . Многие предприятия непрерывно производят метан и поэтому всегда вносят свой вклад в содержание метана в атмосфере.
В архейных производители метана в рубце жвачных животных , ответственны за формирование постоянной нового метана. А домашний скот испускает примерно от 150 до 250 литров метана каждый день , потому что метаногены участвуют в разложении целлюлозы в желудке крупного рогатого скота . Проводятся интенсивные исследования по снижению выбросов метана от коров с помощью кормовых добавок. Не исключено, что выбросы метана от жвачных животных удастся снизить с помощью специальных вакцинаций. Образование метана также снижает энергию, доступную животным через прием пищи, и поэтому она не используется для производства молока, мяса или клетчатки. По оценкам, потери энергии составляют от 6 до 10% от общего потребления энергии.
Аспекты безопасности
Метан легко воспламеняется, температура вспышки −188 ° C, температура воспламенения 595 ° C. Метан образует взрывоопасные смеси с объемной долей от 4,4 до 16,5% в воздухе.
Незаметная утечка природного газа неоднократно приводила к серьезным газовым взрывам, таким как взрыв Новой Лондонской школы в 1937 году. В результате было предписано добавление метантиола , тетрагидротиофена или подобных легко уловимых одорантов к природному газу. Емкости для метана следует хранить в хорошо вентилируемых местах и вдали от источников возгорания. Необходимо принять меры для предотвращения электростатического заряда. Ужасные взрывы шахтного газа в угольных шахтах, так называемые рудничные газы , могут быть связаны с метановоздушными смесями.
Для увеличения плотности метан хранится под высоким давлением в газовых баллонах при 200 бар. Метан доступен в стандартных 50-литровых стальных баллонах или в автомобильных баках, часто с эпоксидной смолой, армированной углеродным волокном, поверх алюминиевой гильзы, сжатой до 200 бар в газообразной форме, так называемый сжатый природный газ (CNG).
Судно транспорта в больших количествах происходит почти избыточное давление свободных мембранных баках, но сжижается при температуре около -162 ° C, так называемый сжиженный природный газ (СПГ). Суда с трубчатыми и сферическими резервуарами транспортируют природный газ под давлением от 200 до 300 бар и при более высокой температуре.
Метан хранится в жидкой форме при низких температурах, потому что в результате может значительно увеличиться плотность. По этой причине при утечке охлажденного метана легко может произойти обморожение. Сам по себе метан нетоксичен , но за счет вытеснения кислорода из нормального воздуха для дыхания поглощение метана может привести к учащению дыхания ( гипервентиляции ) и учащению пульса, кратковременному снижению артериального давления , онемению конечностей, сонливости, спутанности сознания. и потеря памяти , все из-за недостатка кислорода. Метан не причиняет непоправимого ущерба. При появлении симптомов покиньте пораженный участок и сделайте глубокий вдох; если симптомы не проходят, пострадавшего следует доставить в больницу.
доказательство
Метан можно обнаружить с помощью инфракрасной спектроскопии. Установлено инфракрасное спектроскопическое свидетельство обнаружения внеземных происшествий. Метан может быть обнаружен и количественно определен с помощью газовой хроматографии и газовой хроматографии с масс-спектрометрическим сопряжением . В прошлом различные методы обнаружения качественные были использованы в добыче , чтобы предупредить о рудничного газа , таких как лампы Дэви с экрана пламени .
Источник