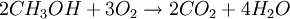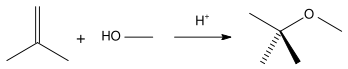- Метанол: химические свойства и получение
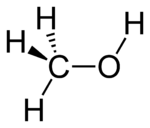
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Метиловый спирт
- Содержание
- Получение
- Применение
- Биометанол
- Метанол в качестве топлива
- Свойства М. спирта и его реакции.
- Здравоохранение
- Интересные факты
- См. также
- Примечания
- Ссылки
- Примечания
- Полезное
- Смотреть что такое «Метиловый спирт» в других словарях:
Метанол: химические свойства и получение
Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
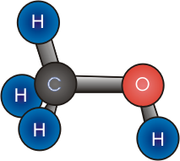
Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Получение метанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Источник
Метиловый спирт
Метиловый спирт
| Метанол | |
|---|---|
  | |
| Общие свойства | |
| Молекулярная формула | CH3OH |
| Молярная масса | 32,04 г/моль |
| Внешний вид | бесцветная жидкость |
| Номер CAS | [67-56-1] |
| Свойства | |
| Плотность и агрегатное состояние | 791,8 кг/м³, жидкость |
| Растворимость в воде | Полностью растворим |
| Температура плавления | −97 °C (176,15 K) |
| Температура кипения | 64,7 °C (337,85 K) |
| Тройная точка | −97,7 °C (175,45 K), ? бар |
| Критическая точка | 240 °C (513,15 K), 78.5 бар |
| pKa | |
| Вязкость | 0,59 Пз при 20 °C |
| Поверхностное натяжение | 22,5•10 -3 Н/м при 20 °C |
| Строение | |
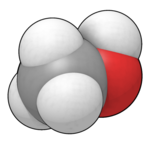
| Форма молекулы | Тетраэдр с изгибом |
| Дипольный момент | 1,69 D (газ) |
| Опасность | |
| Температура вспышки | 11 °C |
| Температура самовоспламенения | 436 °C (709,15 K) |
| Пределы взрываемости | 6,72 — 36,5 % |
| Родственные соединения | |
| Родственные спирты | Этанол Бутанол |
| Другие соедининия | Диметиловый эфир Метилхлорид |
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол — это первый представитель гомологического ряда одноатомных спиртов.
С воздухом образует взрывоопасные смеси (температура вспышки 11 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Содержание
Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400°С и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²). Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300°С и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II) (CO) и водорода (2H2) при следующих условиях:
- температура — 250 °C,
- давление — 7МПа (= 70 Бар = 71,38 кгс/см²),
- катализатор — смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
Молекулярная формула — CH4O или CH3—OH, а структурная: 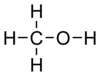
Производство метанола (в тыс. тон):
| год | США | Германия | Мир | Продажная цена ($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | нет данных | нет данных |
| 1936 | 97 | 93 | нет данных | нет данных |
| 1950 | 360 | 120 | нет данных | нет данных |
| 1960 | 892 | 297 | нет данных | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида и формалина, уксусной кислоты, ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Благодаря высокой скорости распространения пламени воздушной смеси и высокой теплоте испарения используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде и при его окислении образуется двуокись углерода и вода:
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основаны на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H + ) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300-400 °С и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60% или цеолитов — селективность процесса близка к 100%. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90% меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол).
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15%, в Польше — 5%. В России в среднем составе бензинов содержание МТБЭ составляет до 12% для АИ92 и до 15% для АИ95, АИ98.
Биометанол
Промышленное культивирование и биотехнологическая конверсия морского фитопланктона рассматривается как одно из наиболее перспективных направлений в области получения биотоплива. [2]
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть.
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее гидроксилирование метана с получением метанола.
Основными доводами в пользу использования микроскопических водорослей являются следующие:
- высокая продуктивность фитопланктона (до 100 т/га в год);
- в производстве не используются ни плодородные почвы, ни пресная вода;
- процесс не конкурирует с сельскохозяйственным производством;
- энергоотдача процесса достигает 14 на стадии получения метана и 7 на стадии получения метанола;
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объемная и массовая энергоемкость (теплота сгорания) метанола на 40-50% меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого рост мощности двигателя повышается на 10-15%. Двигатели гоночных автомобилей работающих на метаноле с более высоким октановым числом чем бензин имеют степень сжатия, превышающую 15:1, в то время как в обычном карбюраторном ДВС степень сжатия для неэтилированного бензина как правило не превышает 10.1:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
- метанолтравиталюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС.
- гидрофильность. Метанол втягивает воду, что является причиной засорения систем подачи топлива в виде желеобразных ядовитых отложений.
- метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к повышению концентрации озона и возможно усилению солнечной радиации.
- уменьшенная летучесть при холодной погоде: Моторы, работающие на метаноле могут иметь проблемы с запуском и отличатся повышенным расходом топлива до достижения рабочей температуры.
- метанол может сравнительно быстро попасть в источники питьевой воды и отравить её. Этот сценарий исследован пока недостаточно, но к сожалению существует опыт утечки Метил-трет-бутилового эфира и загрязнения воды.
Свойства М. спирта и его реакции.
М. спирт есть бесцветная жидкость с запахом, напоминающим запах этилового спирта. Температура кипения 66,78° (Renault); 64,8° (Vincent и Delachanal); 65,75-66,25° (Grodzki и Kr ä mer); 65,8-66° (Perkin); 64,96° при 760 мм (Dittmar и Fawsitt); 64,8° при 763 мм (Schiff). Удельный вес при 0°/0° = 0,8142 (Kopp); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Schiff); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a 2 =5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн). М. спирт смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. В крепких водных растворах М. спирт, принятый внутрь, ядовит. Безводный М. спирт, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в М. спирте; но он не растворяет CuSO 4.7H2 O (Клепль). М. спирт дает со многими солями соединения, подобные кристаллогидратам, например: CuSO 4.2СН 3 ОН; LiCl.3СН 3 ОН; MgCl 2.6СН 3 ОН; CaCl 2.4СН 3 ОН представляет собой шестисторонние таблицы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение ВаО.2СН 3 ОН.2Н 2 О получается в виде блестящих призм при растворении ВаО в водном М. спирте и испарении на холоде полученной жидкости при комнатной температуре (Форкранд). С едкими щелочами М. спирт образует соединения 5NaOH.6СН 3 ОН; 3KOH.5СН 3 OH (Геттиг). При действии металлических калия и натрия легко дает алкоголяты, присоединяющие к себе кристаллизационный М. спирт и иногда воду. При пропускании паров М. спирта через докрасна накаленную трубку получается C 2H2 и др. продукты (Бертело). При пропускании паров М. спирта над накаленным цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров М. спирта при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН 3 ОН+О 2 =2НСНО+2Н 2 О. При действии хлористого цинка и высокой температуры М. спирт дает воду и углеводороды формулы С n Н 2n+2, а также небольшие количества гексаметилбензола (Лебедь и Грин). М. спирт, нагретый с нашатырем в запаянной трубке до 300°, дает моно-, ди- и триметиламины (Бертело). С белильной известью не дает хлороформа (Гольдберг). При пропускании паров М. спирта над едким кали при высокой температуре выделяется водород и образуются последовательно муравьинокислый, щавелевокислый и, наконец, углекислый калий; концентрированная серная кислота дает метилсерную кислоту CH 3HSO4, которая при дальнейшем нагревании с М. спиртом дает метиловый эфир (см.). При перегонке М. спирта с избытком серной кислоты в отгон переходит диметилсерная кислота (CH 3)2SO4. При действии серного ангидрида SO 3 получается CH(OH)(SO 3H)2 и CH 2(SO3H)2 (см. Метилен). М. спирт при действии соляной кислоты, пятихлористого фосфора и хлористой серы дает хлористый метил СН 3 Cl. Действием HBr и H 2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, М. спирт дает СО 2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН 2 (ОСН 3)2 (Ренар). При нагревании М. спирта с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и др. искусственных пигментов.
Здравоохранение
Метанол — яд, действующий на нервную и сосудистую системы. Токсическое действие метанола обусловлено так называемым «летальным синтезом» — метаболическим окислением в организме до очень ядовитого формальдегида. Приём внутрь 5—10 мл метанола приводит к тяжёлому отравлению (одно из последствий — слепота), а 30 мл и более — к смерти.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи употребления метанола внутрь.
Как указано в электронном справочном руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. [3] Полезный эффект в этом случае обеспечивается отвлечением АДГ I на окисление экзогенного этанола. [4]
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно. [3]
Интересные факты
Изабелла американский сорт винограда. В последнее время, под предлогом о повышенном содержаниии метанола в винах, получаемых из данного сорта, запрещен к использованию в коммерческом виноделии в США и странах Евросоюза. Вероятная причина запрета — очень дешевые в производстве вина по сравнению с винами из винограда столовых сортов.
См. также
Железо- Комплексы железа, встречаются, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Примечания
- ↑ Рябчиков (1953 г.), «Общая химия», стр.253
- ↑ Waganer K. Mariculture on land. — Biomass, 1981
- ↑ 12Острые отравления — Электронное справочное руководство для врача скорой медицинской помощи. Глава 15
- ↑[1]
Ссылки
- Метанол убивает человека и природу (статья на сайте экологический правозащитного центра «Беллона»)
- ГОСТ 2222-95 «Метанол технический» (взамен ГОСТ 2222-78)
Примечания
| Порох | 3.8·10 6 [2] |
| Торф | 8.1·10 6 [1], 15·10 6 [4] |
| Дрова (березовые, сосновые) | 10.2·10 6 [1] |
| Бурый уголь | 15·10 6 [1], 14,7·10 6 [4] |
| Бытовой газ | 13.25·10 6 [3] |
| Каменный уголь | 22·10 6 [1], 29,3·10 6 [4] |
| Спирт этиловый | 25·10 6 [4] |
| Метанол | 22.7·10 6 [4] |
| Условное топливо | 29.308·10 6 (7000 ккал/кг) [1] |
| Древесный уголь | 31·10 6 [4] |
| Метан | 50.1·10 6 [3] |
| Мазут | 39.2·10 6 [1] |
| Дизельное топливо | 42.7·10 6 [4] |
| Нефть | 41·10 6 [4] |
| Бензин | 44·10 6 [1], 42·10 6 [4] |
| Керосин | 40,8·10 6 [4] |
| Этилен | 48.0·10 6 [3] |
| Пропан | 47.54·10 6 [3] |
| Водород | 120.9·10 6 [3] |
Спирты
Этанол · Пропанол · Бутиловый спирт/Изобутанол · Пентанол · Гексанол · Гептанол
Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16)
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Метиловый спирт» в других словарях:
МЕТИЛОВЫЙ СПИРТ — МЕТИЛОВЫЙ СПИРТ, метанол (alcohol methy licus, carbinol, methanol, CHsOH), открыт Тейлором (Ph. Taylor, 1812) в продуктах сухой перегонки дерева; ближе изучен Дюма и Пелиго (Dumas, Peligot; 1831). В небольших количествах находится в незрелых… … Большая медицинская энциклопедия
МЕТИЛОВЫЙ СПИРТ — То же, что древесный спирт. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МЕТИЛОВЫЙ СПИРТ древесный с т, получавшийся при сухой перегонке дерева с некоторыми веществами одновременно. Полный словарь иностранных… … Словарь иностранных слов русского языка
метиловый спирт — технический спирт, спирт Словарь русских синонимов. метиловый спирт сущ., кол во синонимов: 2 • спирт (101) • … Словарь синонимов
МЕТИЛОВЫЙ СПИРТ — (метанол, древесный спирт), CH3OH, бесцветная горючая жидкость со слабым спиртовым запахом, tкип 64,5шC. Сырье в производстве формальдегида, сложных эфиров и др. продуктов; растворитель. Яд, действующий на нервную и сосудистую системы, прием… … Современная энциклопедия
МЕТИЛОВЫЙ СПИРТ — (метанол древесный спирт), CH3OH, бесцветная жидкость со слабым спиртовым запахом, tкип 64,5 .С. Сырье в производстве формальдегида, сложных эфиров, напр. диметилтерефталата, и др. продуктов; растворитель. Яд, действующий на нервную и сосудистую… … Большой Энциклопедический словарь
МЕТИЛОВЫЙ СПИРТ — (метанол, древесный спирт, формула СН3ОН) бесцветная жидкость с характерным запахом, смешивается с водой в любых соотношениях; t = 64,5 °С, плотность КИП 792 кг/м3, горит бледным пламенем; хороший растворитель многих органических веществ. М. с.… … Большая политехническая энциклопедия
МЕТИЛОВЫЙ СПИРТ — МЕТИЛОВЫЙ СПИРТ, см. МЕТАНОЛ … Научно-технический энциклопедический словарь
метиловый спирт — метиловый спирт. См. метанол. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
метиловый спирт — (СН4ОН) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN methylated spiritmethyl alcoholwood naphtha … Справочник технического переводчика
метиловый спирт — (метанол, древесный спирт), СН3ОН, бесцветная жидкость со слабым спиртовым запахом, tкип 64,5°C. Сырьё в производстве формальдегида, сложных эфиров, например диметилтерефталата, и других продуктов; растворитель. Яд, действующий на нервную и… … Энциклопедический словарь
Источник