- Методы определения сероводорода воде
- Сероводород в воде: способы определения и очистки
- Детальнее о причинах появления запаха тухлых яиц
- Как определить количественный состав сернистого водорода в жидкости?
- Как эффективно очистить воду от сероводорода?
- 1. Назначение и область применения методики
- 3. Метод измерений
- 4. Средства измерений, вспомогательные устройства, реактивы, материалы
- 5. Отбор, предварительная обработка и хранение проб
- 6. Подготовка к выполнению измерений
- 7. Выполнение измерений
- 8. Вычисление результатов измерений
- 9. Контроль погрешности измерений
- 10. Требования безопасности
- 11. Требования к квалификации оператора
- 12. Затраты времени на проведение анализа
Методы определения сероводорода воде
Занятие 9 ОПРЕДЕЛЕНИЕ СЕРОВОДОРОДА В ВОДЕ
Цель занятия. Изучить методы определения сероводорода в воде.
Материалы и оборудование. Качественный метод; фильтровальная бумага, пропитанная уксуснокислым свинцом. Йодометрический метод: колба на 250 мл; пробирки; бюретки; пипетка на 5 мл; 0,01 н. раствор перманганата калия; 0,01 н. раствор гипосульфита натрия; 10%-ный раствор йодида калия; серная кислота (1:3); 1 %-ный раствор крахмала. Приближенный метод: реактив Каро (1 г парамидометилаланина растворяют в 300 мл соляной кислоты плотностью 1,19 г/см3, а затем к 100 мл этого раствора добавляют 100 мл 1 %-ного раствора сернокислого железа и хранят в темной склянке с притертой пробкой).
Общие сведения. Сероводород образуется в воде при разложении органических серосодержащих веществ. Особенно высокая концентрация сероводорода наблюда-ется в сточных водах в результате разложения белковых веществ.
Содержание занятия. П о д г о т о в к а воды к анализу. Пробы воды для определения сероводорода берут с теми же предосторожностями, что и пробы для определения кислорода, и исследуют сразу после отбора.
Если исследуемая вода имеет запах сероводорода, то для того чтобы убедиться, что этот запах вызван присутствием сероводорода, необходимо бросить в нее кристаллик сернокислой меди. Запах сероводорода после этого должен исчезнуть. Если запах сохраняется — значит, сероводорода в воде нет.
Качественный метод. Бутыль на 1 л на 3/4 наполняют исследуемой водой, взятой из водоема, и между горлышком и пробкой бутыли зажимают полоску фильтровальной бумаги, пропитанной уксуснокислым свинцом. Бумагу держат в бутыли в таком положении 3—5 ч. При наличии сероводорода бумага приобретает окраску от светло-коричневой до темно-коричневой.
Йодометрический метод. Он основан на окислении сероводорода йодом, выделяющимся из йодида калия при воздействии на него перманганата калия. По количеству йода, израсходованного на окисление сероводорода, судят о содержании его во взятом объеме воды.
В коническую колбу на 250 мл наливают 100 мл исследуемой воды, подкисляют несколькими каплями раствора серной кислоты, прибавляют 1 мл раствора йодида калия, взбалтывают и титруют раствором перманганата калия для получения отчетливо выраженного желтого окрашивания. Избыток йода титруют раствором гипосульфита натрия в присутствии раствора крахмала. Разность между количеством добавленного раствора перманганата калия и количеством раствора гипосульфита натрия, пошедших на титрование, будет соответствовать количеству 0,01 н. раствора йода, израсходованного на окисление сероводорода в 100 мл.исследуемой воды.
1 мл 0,01 н. раствора йода соответствует 0,71 мг сероводорода. Следовательно, для вычисления количества сероводорода, содержащегося в 100 мл исследуемой воды, следует количество 0,01 н. раствора йода умножить на 0,71 и сделать пересчет на 1 л исследуемой воды.
Приближенный метод. В одну пробирку наливают 10 мл исследуемой воды, в другую — 10 мл дистиллированной воды и в каждую по 3 мл реактива Каро. По изменению окраски раствора в пробирке определяют содержание сероводорода (табл. 19).
Источник
Сероводород в воде: способы определения и очистки
Неприятно и резко пахнущая вода из скважины или колодца в 97% случаев загрязнена сероводородом. Это газообразное вещество не имеет цвета. Ему присущ сладковатый привкус и невероятная летучесть, поэтому загрязненная им жидкость не только источает мерзкий запах, но и режет глаза. Объяснить, почему вода пахнет сероводородом, очень просто. Образование газа связано с заражением субстанции серобактериями и гниением белковых веществ. Пить и употреблять в технических целях такую жидкость нельзя. Она крайне токсична, способна вызывать сильнейшие отравления организма. Опасно и само вдыхание паров, которые источает поднятая из скважины жидкость.
Газообразное летучее вещество необычайно коварно. Оно блокирует рецепторы через 45-60 секунд вдыхания сероводорода. Человек перестает ощущать его противный запах, полными легкими вдыхая яд. Попадая в организм сероводород, растворенный в воде, вызывает рвоту и тошноту, головокружения, судороги и нервный паралич. Зафиксированы случаи отека легких. Опасен газ и для сантехнического оборудования, трубопроводов. Он обладает повышенной коррозийной активностью. Металл после контакта с ним разрушается в 3 раза быстрее. Выяснив, вреден ли сероводород в воде, раскроем и способы его удаления.
Детальнее о причинах появления запаха тухлых яиц
Большинство видов серобактерий предпочитают среду без кислорода — артезианские скважины, ильные отложения и детриты. Но есть и такие бактерии, которые отлично чувствуют себя и кислородосодержащей среде — колодце. В процессе их жизнедеятельности всевозможные соединения серы (растворенные сульфаты, сульфиды), присутствующие в субстанции, восстанавливаются до сероводорода. Чем больше бактерий, тем резче и сильнее вода пахнет сероводородом, режет глаза.
Источать неприятный аромат может не только колодезная и скважинная вода. Нередко жильцы многоквартирных домов жалуются на неприятный запах горячей субстанции, которая проходит подогрев в бойлере. Причина — образование на стенках оборудования отложений, где размножаются термотолерантные бактерии. Поскольку сероводород растворим в воде, то он в течение нескольких минут загрязняет воду, попавшую в бак.
В какой воде обязательно будет присутствовать сернистый водород?
- после существенных паводков, обильного таяния снегов, ливней в скважинах и колодцах;
- на участках расположенных вблизи промышленных регионов вода из скважины пахнет сероводородом и имеет осадок;
- в колодцах и скважинах вырытых в районе залежей руды (только сульфидного происхождения);
- в колодцах с негерметичными стыками между кольцами.
Жизнь на природе в собственном доме может таить и опасность. Если поднятая из скважины или колодца вода пахнет сероводородом, выясните, что можно сделать для эффективной очистки субстанции. Даже едва уловимый запах тухлых яиц указывает на непригодность жидкости для питья и готовки пищи. Помните: кипячение не решит проблему токсичности.
Обратите внимание на нормы качества питьевой субстанции. Согласно таблице, содержание сероводорода в воде должно равняться 0, иначе жидкость непригодна даже для стирки или полива растений. Нормы СанПин и ГН допускают концентрацию токсичного вещества в жидкости в пределах не более 0.003 мг/л.
Как определить количественный состав сернистого водорода в жидкости?
При большой концентрации раствора сероводорода в воде его наличие можно определить самостоятельно, поскольку ее органолептические свойства легко распознаются. Но если содержание токсина не высоко — 0.01 до 0.014 мг/л, тогда есть риск употребления или использования отравленной жидкости. Если есть сомнения, то определение сероводорода в воде можно заказать в лаборатории. Исследования субстанции проводят с помощью ионоселективного электрода, реактивов и пр. Лабораторный анализ воды на сероводород — наиболее точный способ обезопасить себя.
Как эффективно очистить воду от сероводорода?
Рассчитывать на эффективное удаление сероводорода из воды можно лишь в том случае, если знать его точную концентрацию в субстанции. Этот показатель позволит подобрать оптимальный метод очистки. Их существует несколько:
- При помощи аэрации.
Физическим метод позволяет удалить аммоний, марганец, железо и сероводород в воде за счет ее насыщения кислородом. Он окисляет растворенные металлы и летучие, органические загрязнители, а также убивает бактерии, которые не способны жить в кислородной среде. Но аэрация поможет избавиться лишь от молекулярного газа по принципу его «выдувания». В остальном жидкость останется загрязненной. При этом очистка воды от сероводорода посредством ее насыщения кислородом — очень длительный процесс, который выполняется в несколько этапов. Поэтому для подготовки питьевой воды не подходит.
- Безнапорная аэрация.
Принцип удаления газа аналогичен, только потребует использования громоздкой накопительной емкости. В нее устанавливаются форсунки, безнапорный эжектор и система производительного воздушного душирования. Но поскольку физическое взаимодействие сероводорода с водой невозможно (жидкость лишь растворяет газ), то технология предусматривает лишь ускорение процесса окисления металлов и газа.
- Напорная аэрация.
Применяется специальная колонна и миксер. Технология разработана для интенсивного окисления и удаления газов, воздуха после процедуры. Но очистка воды от железа и сероводорода неэффективна. Причина — нет доочистки субстанции, в помещения, где используются установки, поступает едкий газ и запах. Поэтому разработаны более эффективные методики:
- Химический метод.
Применяются установки, которые вводят в загрязненную жидкость дозировано окислители — перекись водорода, озон, хлор и др. Насыщенная сероводородом вода вступает в реакцию как по уравнению с введенным веществом, в результате чего образуется осадок. Затем субстанция дочищается фильтрами с активированным углем или марганцево-глауконитовым песком.
- Сорбционные методики.
Считаются сегодня наиболее эффективными и производительными. Применяются специальные фильтры для воды, очищающие ее от железа и сероводорода. В них используется засыпка, позволяющая удалить из субстанции все вредные вещества. Чаще активированный древесный уголь, нередко совместно с окислителями. Но сорбционная методика не подходит для жидкостей, в которых содержится свыше 3 мг/л токсичного газа. Потребуется последующая доочистка.
Для обезвреживания скважинной и колодезной субстанции больше подходят фильтрационные установки. После выполненного анализа жидкости не составит труда подобрать эффективную и производительную систему очистки воды от сероводорода и примесей. Рынок сегодня предлагает широчайший выбор оборудования для фильтрации. Главное, грамотно сделать выбор и установить.
Источник
1. Назначение и область применения методики
Настоящий руководящий документ устанавливает фотометрическую методику выполнения измерений массовой концентрации сероводорода и растворимых в воде или в кислоте сульфидов в сумме (в пересчете на сероводород) в пробах природных и очищенных сточных вод любой минерализации в диапазоне 2 — 4000 мкг/дм 3 . При анализе проб воды с массовой концентрацией сероводорода и сульфидов, превышающей 4000 мкг/дм 3 , необходимо соответствующее разбавление пробы дистиллированной водой.
2. Нормы погрешности и значения характеристик погрешности измерения
В соответствии с ГОСТ 27384 нормы погрешности при выполнении измерений сероводорода и сульфидов в природных водах в диапазоне массовых концентраций 25 — 50 мкг/дм 3 составляют 50 %, свыше 50 — 100 мкг/дм 3 — ± 25 %, свыше 100 мкг/дм 3 — ± 10 %. При выполнении измерений в сточных водах нормы погрешности составляют ± 25 % в диапазоне массовых концентраций 50 — 500 мкг/дм 3 и ± 10 % свыше 500 мкг/дм 3 .
Установленные для настоящей методики значения характеристик погрешности и ее составляющих приведены в таблице 2.
Таблица 2 — Значения характеристик погрешности и ее составляющих (P = 0,95)
Характеристика случайной составляющей погрешности 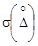
Характеристика погрешности, D , мкг/дм 3
При выполнении измерений сероводорода и сульфидов в пробах с массовой концентрацией свыше 4000 мкг/дм 3 после соответствующего разбавления погрешность измерения не превышает величины D · n , где D — погрешность измерения концентрации сульфидов в разбавленной пробе; n — степень разбавления.
3. Метод измерений
Определение основано на способности сероводорода и сульфидов образовывать в кислой среде с продуктами окисления N,N-диметил-п-фенилендиамина солью железа (III) метиленовую синь, интенсивность окраски которой пропорциональна содержанию сульфидов и сероводорода.
При содержании сульфидов более 50 мкг/дм 3 проводят измерение интенсивности окраски в водном растворе, при меньшей концентрации проводят экстракционное концентрирование окрашенного соединения хлороформом в присутствии лаурилсульфата натрия. Измерение интенсивности окраски проводят на фотоэлектроколориметре или спектрофотометре (λ max в водном растворе 667 нм, в экстракте 656 нм).
Определению сероводорода и сульфидов с N,N-диметил-п-фенилендиамином мешают взвешенные вещества. Их устраняют соосаждением с гидроксидом алюминия, при этом, однако, теряется и часть сульфидов, нерастворимых в воде, но растворимых в сильнокислой среде.
Мешающее влияние на определение сероводорода могут оказывать сульфиты и гипосульфиты при концентрации более 10 мг/дм 3 практически не встречающейся в природных и очищенных сточных водах.
В присутствии значительного количества сульфида метиленовая синь не образуется, а выпадает белый осадок, представляющий собой элементарную серу. В этом случае пробу разбавляют в 10 и более раз.
4. Средства измерений, вспомогательные устройства, реактивы, материалы
4.1.1. Фотоэлектроколориметр типа КФК-2, КФК-2мп (КФК-3) по ТУ 3.3.1766, ТУ 3.3.1860 или спектрофотометр типа СФ-46 (СФ-26).
4.1.2. Весы аналитические 2 класса точности по ГОСТ 24104.
4.1.3. Весы технические лабораторные 4 класса точности по ГОСТ 24104 с пределом взвешивания 200 г.
4.1.4. Колбы мерные не ниже 2 класса точности по ГОСТ 1770 вместимостью:
4.1.5. Бюретка не ниже 2 класса точности по ГОСТ 29251 вместимостью 25 см 3 — 1
4.1.6. Пипетки градуированные не ниже 2 класса точности по ГОСТ 29227 вместимостью: 1 см 3 — 2
4.1.7. Пипетки с одной отметкой не ниже 2 класса точности по ГОСТ 29169 вместимостью: 5 см 3 — 1
4.1.8. Пробирки градуированные с притертой пробкой по ГОСТ 1770 вместимостью
4.1.9. Цилиндры мерные по ГОСТ 1770 вместимостью: 10 см 3 — 1
4.1.10. Воронки делительные по ГОСТ 25336 вместимостью 0,75 — 1 дм 3 — 4
4.1.11. Воронки лабораторные по ГОСТ 25336 диаметром 3 см — 7
4.1.12. Колбы конические по ГОСТ 25336 вместимостью 250 см 3 — 2
4.1.13. Стаканы термостойкие по ГОСТ 25336 вместимостью: 100 см 3 — 1
4.1.14. Стаканчики для взвешивания (бюксы) по ГОСТ 25336 — 2
4.1.15. Чашка кристаллизационная по ГОСТ 25336 диаметром не менее 150 мм — 1
4.1.16. Палочка стеклянная — 1
4.1.17. Шпатель — 1
4.1.18. Склянки реактивные с притертыми или завинчивающимися пробками с плотным полиэтиленовым вкладышем вместимостью около 500 см 3 , калиброванные с точностью ± 5 см 3 (см. 6.5).
4.1.19. Склянки реактивные с притертыми или завинчивающимися пробками с плотным полиэтиленовым вкладышем вместимостью 1 дм 3 .
Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
4.2.1. Сульфид натрия, нонагидрат по ГОСТ 2053. ч.д.а. (допускается квалификация ч.).
4.2.2. Гидроксид натрия по ГОСТ 4328, ч.д.а.
4.2.3. Серная кислота по ГОСТ 4204, ч.д.а.
4.2.4. Соляная кислота по ГОСТ 3118, ч.д.а.
4.2.5. Хлорид железа (III), гексагидрат по ГОСТ 4147, ч.д.а.
4.2.6. Хлорид алюминия, гексагидрат по ГОСТ 3759, ч.д.а. или сульфат алюминия, октадекагидрат по ГОСТ 3758, ч.д.а.
4.2.7. Ацетат кадмия, дигидрат по ГОСТ 5824, ч.д.а.
4.2.8. Дихромат калия (калий двухромовокислый) по ГОСТ 4220, х.ч. или калий двухромовокислый, стандарт-титр 0,1 моль/дм 3 эквивалента по ТУ 6-09-2540.
4.2.9. Йодид калия по ГОСТ 4232, ч.д.а.
4.2.10. Тиосульфат натрия (натрий серноватистокислый), пентагидрат по ГОСТ 27068, ч.д.а. или натрий серноватистокислый, стандарт-титр 0,1 моль/дм 3 эквивалента по ТУ 6-09-2540.
4.2.11. Йод кристаллический по ГОСТ 4159, ч.д.а. или йод, стандарт-титр 0,01 моль/дм 3 эквивалента по ТУ 6-09-2540.
4.2.12. N,N-диметил-п-фенилендиамин сульфат по ТУ 6-09-07-614 или дигидрохлорид по ТУ 6-09-1903 (ДМДФА), ч.д.а.
4.2.13. Лаурилсульфат натрия (додецилсерной кислоты натриевая соль) по ТУ 6-09-10-1405. ч.
4.2.14. Хлороформ по ГОСТ 20015, очищенный.
4.2.15. Глицерин по ГОСТ 6259, ч.д.а. (допустимо ч.)
4.2.16. Крахмал растворимый по ГОСТ 10163, ч.
4.2.17. Вода дистиллированная по ГОСТ 6709.
4.2.18. Универсальная индикаторная бумага pH 1 — 10 по ТУ 6-09-1181.
4.2.19. Фильтры бумажные обеззоленные «белая лента» или «красная лента» по ТУ 6-09-1678 или вата хлопковая по ГОСТ 5556.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
5. Отбор, предварительная обработка и хранение проб
Отбор проб производится в соответствии с ГОСТ 17.1.5.05. Вследствие неустойчивости сероводорода отбор аликвоты водной пробы для его определения производят на водном объекте, сразу после отбора пробы для определения кислорода, и немедленно проводят предварительную обработку пробы.
Если в анализируемой воде визуально заметно присутствие взвешенных веществ, то объем пробы должен быть не менее 1 дм 3 . В склянку с притертой пробкой вместимостью 1 дм 3 на месте отбора пробы наливают анализируемую воду посредством сифона, опущенного до дна склянки так, чтобы первая порция воды вылилась из склянки. Добавляют 5 см 3 20 % раствора хлорида (или сульфата) алюминия и 3 см 3 раствора гидроксида натрия с концентрацией 4 моль/дм 3 . Склянку закрывают пробкой, встряхивают и дают отстояться в течение 20 — 30 мин. Затем с помощью сифона отбирают из середины склянки прозрачную воду в калиброванную склянку вместимостью 500 см 3 с притертой пробкой или завинчивающейся пробкой с плотным полиэтиленовым вкладышем. Далее проводят фиксацию или консервацию пробы как описано ниже.
Если анализируемая вода визуально прозрачна, ее помещают непосредственно в калиброванную склянку с помощью сифона. Склянку заполняют водой доверху и дают возможность первым порциям воды вылиться из склянки, поднимая при этом трубку сифона. Пробу немедленно закрывают пробкой.
Для предотвращения окисления сероводорода и сульфидов сразу после отбора пробы или после осаждения взвешенных веществ проводят их фиксацию, добавляя в склянку 5 см 3 раствора ДМФДА и 5 см 3 раствора хлорида железа (III). Дальнейшая обработка пробы и определение сероводорода и сульфидов могут быть выполнены в лаборатории не позднее, чем через 3 сут. Пробы с зафиксированным сероводородом хранят в темноте.
При необходимости более длительного хранения (до 14 сут.) пробу консервируют. Для этого в склянку с анализируемой водой добавляют 0,3 см 3 раствора гидроксида натрия с концентрацией 4 моль/дм 3 и доводят pH до 9 — 10 по универсальной индикаторной бумаге, добавляя по каплям этот же раствор, а затем приливают 5 см 3 10 % раствора ацетата кадмия.
Если проводится фиксация проб растворами ДМФДА и хлорида железа, то одновременно следует зафиксировать холостой опыт. Для этого в склянку вместимостью 500 см 3 наливают дистиллированную воду и обрабатывают ее так же, как и анализируемую воду.
При добавлении всех реактивов в пробы пипетку с раствором опускают до середины склянки и поднимают по мере вытекания раствора.
6. Подготовка к выполнению измерений
6.1. Приготовление растворов и реактивов
6.1.1. Раствор серной кислоты 1:1
500 см 3 концентрированной серной кислоты осторожно приливают к 500 см 3 дистиллированной воды в термостойком стакане, непрерывно перемешивая смесь. После охлаждения раствор переносят в толстостенную склянку. Раствор устойчив.
6.1.2. Раствор ДМФДА, 5 г/дм 3
5 г ДМФДА растворяют в 1 дм 3 серной кислоты (1:1) (под тягой). Раствор устойчив при хранении в темной склянке в защищенном от света месте.
6.1.3. Раствор хлорида железа (III), 5 %
5 г FeCl 3 · 6H 2 O растворяют в 95 см 3 дистиллированной воды. Хранят раствор в течение месяца.
6.1.4. Раствор лаурилсульфата натрия, 0,1 %
0,1 г лаурилсульфата натрия растворяют в 100 см 3 дистиллированной воды. Раствор хранят не более 3 мес.
6.1.5. Раствор ацетата кадмия, 10 %
10 г ацетата кадмия (CH 3 COO)2Cd · 2Н2O растворяют в 90 см 3 дистиллированной воды. Раствор устойчив.
6.1.6. Раствор хлорида алюминия, 20 %
25 г хлорида алюминия АlСl 3 · 6Н2O (или 35 г сульфата алюминия Al 2 (SO 4 )3 · 18Н2O) растворяют в 100 см 3 дистиллированной воды. Раствор устойчив.
6.1.7. Раствор гидроксида натрия, 4 моль/дм 3
80 г NaOH растворяют в 500 см 3 дистиллированной воды. Раствор хранят в полиэтиленовой посуде. Раствор устойчив .
6.1.8. Раствор соляной кислоты (2:1)
340 см 3 концентрированной соляной кислоты добавляют к 170 см 3 дистиллированной воды и перемешивают. Раствор устойчив.
6.1.9. Раствор тиосульфата натрия, 0,02 моль/дм 3 эквивалента
При использовании стандарт-титра последний растворяют в дистиллированной воде, предварительно прокипяченной в течение 1,5 ч и охлажденной, в мерной колбе вместимостью 500 см 3 , затем отбирают пипеткой 50 см 3 полученного раствора, переносят в мерную колбу вместимостью 500 см 3 и доводят объем дистиллированной водой до метки.
При приготовлении раствора из навески 5 г Na 2 S 2 O 3 · 5H 2 O растворяют в 1 дм 3 дистиллированной воды, которую предварительно кипятят в течение 1,5 ч и охлаждают до комнатной температуры. Для консервации добавляют 2 см 3 хлороформа. Раствор используют не ранее, чем через 5 дней после приготовления. Точную концентрацию тиосульфата натрия определяют, как описано в 6.2.1, не реже 1 раза в месяц. Хранят раствор в темной склянке несколько месяцев.
6.1.10. Раствор дихромата калия, 0,0200 моль/дм 3 эквивалента
При использовании стандарт-титра последний растворяют в дистиллированной воде в мерной колбе вместимостью 500 см 3 , затем отбирают пипеткой 50 см 3 полученного раствора, переносят в мерную колбу вместимостью 500 см 3 и доводят объем дистиллированной водой до метки.
При приготовлении раствора из навески 0,4904 г точно отвешенного K 2 Cr 2 O 7 , предварительно высушенного при 105 ° С, растворяют в дистиллированной воде в мерной колбе вместимостью 500 см 3 , доводят до метки и перемешивают. Хранят в плотно закрытой темной склянке не более 6 мес.
6.1.11. Раствор йода, 0,02 моль/дм 3 эквивалента
При использовании стандарт-титра (0,01 моль/дм 3 эквивалента) последний растворяют в дистиллированной воде в мерной колбе вместимостью 500 см 3 .
При приготовлении раствора из навески 4 — 5 г КI растворяют в небольшом количестве (20 — 25 см 3 ) дистиллированной воды, добавляют 1,3 г кристаллического йода: после его растворения приливают еще 480 см 3 дистиллированной воды и перемешивают. Точную концентрацию раствора йода устанавливают, как описано в 6.2.2. Раствор хранят в склянке из темного стекла. Концентрацию раствора проверяют не реже 1 раза в месяц.
6.1.12. Раствор крахмала, 0,5 %
0,25 г растворимого (рисового, пшеничного) крахмала перемешивают с 50 см 3 дистиллированной воды и нагревают до кипения. Раствор хранят не более 5 дней.
В склянку или колбу наливают дистиллированную воду, добавляют раствор гидроксида натрия с концентрацией 4 моль/дм 3 (из расчета около 0,6 см 3 на 1 дм 3 воды), перемешивают, проверяют величину pH индикаторной бумагой и при необходимости доводят до pH 9 — 10 щелочью.
В дальнейшем приготовление всех растворов сульфида натрия и разбавление незафиксированных проб проводят, используя воду с pH 9 — 10.
При приготовлении растворов сульфида с концентрацией менее 80 мкг/дм 3 следует применять свежепрокипяченную и быстро охлажденную дистиллированную воду.
6.2. Определение точной концентрации растворов тиосульфата натрия и йода
6.2.1. Раствор тиосульфата натрия
В коническую колбу вместимостью 250 см 3 наливают 70 — 80 см 3 дистиллированной воды, добавляют пипеткой 10 см 3 раствора дихромата калия с концентрацией 0,0200 моль/дм 3 эквивалента, всыпают 1 г сухого KI и добавляют 10 см 3 соляной кислоты (2:1). Колбу закрывают пробкой и ставят в темное место.
Через 5 мин титруют выделившийся йод раствором тиосульфата натрия до бледно-желтой окраски. Затем добавляют 1 см 3 раствора крахмала и продолжают титрование по каплям до обесцвечивания раствора. Определение повторяют и при отсутствии расхождения в объемах титранта более 0,05 см 3 за результат определения берут РД 52.24.450-95 среднее арифметическое. Концентрацию раствора тиосульфата определяют по формуле
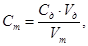
где C т — концентрация раствора тиосульфата натрия, моль/дм 3 эквивалента;
V т — объем раствора тиосульфата натрия, пошедшего на титрование, см 3 ;
C д — концентрация раствора дихромата калия, моль/дм 3 эквивалента;
V д — объем раствора дихромата калия, см 3 .
В коническую колбу вместимостью 250 см 3 наливают 70 — 80 см 3 дистиллированной воды, добавляют пипеткой 10 см 3 раствора йода, 10 см 3 раствора соляной кислоты (2:1) и титруют тиосульфатом натрия до бледно-желтой окраски. Затем добавляют 1 см 3 раствора крахмала и титруют по каплям до обесцвечивания раствора.
Титрование повторяют еще 1 — 2 раза и из полученных отсчетов, различающихся не более чем на 0,05 см 3 , берут среднее. Концентрацию раствора йода определяют по формуле
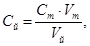
где C й — концентрация раствора йода, моль/дм 3 эквивалента;
V й — объем раствора йода, см 3 ;
C т — концентрация paствора тиосульфата натрия, моль/дм 3 эквивалента;
V т — объем раствора тиосульфата натрия, пошедшего на титрование, см 3 .
6.3. Приготовление градуировочных растворов
Градуировочные растворы, аттестованные по процедуре приготовления, готовят из сульфида натрия в соответствии с 6.3.1 — 6.3.3.
Для всех градуировочных растворов погрешности, обусловленные процедурой приготовления, не превышают 2,5 % относительно приписанного значения массовой концентрации сероводорода.
0,1 — 0,2 г Na 2 S · 9H 2 O, предварительно ополоснутого водой для удаления следов сульфатов с поверхности кристаллов и отжатого фильтровальной бумагой, растворяют в 25 см 3 дистиллированной воды, в которую добавлена щелочь до pH 9 — 10 (6.1.13), добавляют 25 см 3 глицерина и тщательно перемешивают. Точную концентрацию сульфида в полученном растворе определяют йодометрически. Для этого в колбу с притертой пробкой вместимостью 250 см 3 наливают 60 — 70 см 3 воды, добавляют пипеткой 25 см 3 раствора йода, 10 см 3 соляной кислоты (2:1) и 5 см 3 основного раствора сульфида натрия. Колбу закрывают пробкой, перемешивают и помещают в темное место. Через 5 мин оттитровывают избыток йода раствором тиосульфата натрия до бледно-желтой окраски. Затем добавляют 1 см 3 раствора крахмала и продолжают титрование по каплям до обесцвечивания раствора. Если после добавления основного раствора сульфида натрия йод обесцветился, следует повторить определение с меньшим количеством раствора сульфида.
Массовую концентрацию сульфида в пересчете на сероводород находят по формуле
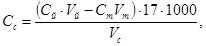
где C с — массовая концентрация сульфида натрия в пересчете на H 2 S, мкг/см 3 ;
C й — концентрация раствора йода, моль/дм 3 эквивалента;
V й — объем добавленного раствора йода, см 3 ;
C т — концентрация раствора тиосульфата натрия, моль/дм 3 эквивалента;
V т — объем раствора тиосульфата натрия, израсходованного на титрование избытка раствора, йода, см 3 ;
V с — объем раствора сульфида натрия, cм 3 .
Хранят раствор в холодильнике не более 3 дней.
6.3.2. Рабочий раствор сульфида натрия с концентрацией по сероводороду 100 мкг/см 3
Рассчитывают объем основного раствора сульфида натрия, который необходимо разбавить до 100 см 3 , чтобы получить раствор с концентрацией 100 мкг/см 3 по формуле

где V с — объем основного раствора, см 3 ;
C с — концентрация основного раствора, мкг/см 3 .
В мерную колбу вместимостью 100 см 3 наливают 50 — 70 см 3 дистиллированной воды с pH 9 — 10, приливают рассчитанный объем основного раствора сульфида натрия, опуская пипетку до уровня воды в колбе, доводят объем раствора в колбе до метки и перемешивают. Рабочий раствор сульфида натрия следует готовить непосредственно перед использованием: раствор устойчив не более 3 ч.
Рассчитывают объем основного раствора сульфида натрия, который необходимо разбавить до 100 см 3 , чтобы получить раствор с концентрацией 10 мкг/см 3 по формуле
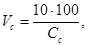
где V с — объем основного раствора, см 3 ;
C с — концентрация основного раствора, мкг/см 3 .
В мерную колбу вместимостью 100 см 3 наливают 50 — 70 см 3 дистиллированной воды с pH 9 — 10, приливают рассчитанный объем основного раствора сульфида натрия, опуская пипетку до уровня воды в колбе, доводят объем раствора в мерной колбе до 100 см 3 и перемешивают.
Раствор готовят непосредственно перед использованием: он устойчив не более 1 ч.
6.4. Установление градуировочных зависимостей
В мерные колбы с притертыми пробками вместимостью 500 см 3 наливают приблизительно 400 см 3 дистиллированной воды с pH 9 — 10, затем поочередно пипетками вводят 0; 0,25; 0,50; 0,75; 1,0; 1,5; 2,0; 2,5; 3,0; 4,0 см 3 рабочего раствора сульфида натрия с концентрацией 10 мкг/см 3 и 0,4; 0,8; 1,2; 1,6; 2,0; 3,0; 4,0; 6,0; 8,0 см 3 рабочего раствора сульфида натрия с концентрацией 100 мкг/см 3 . При этом пипетки опускают до уровня воды в колбе (но не погружая в нее). Щелочной дистиллированной водой доводят объем растворов до метки, закрывают пробкой и перемешивают, несколько раз переворачивая колбу вверх — вниз (не встряхивая). Концентрация сероводорода в пробах составит соответственно 0; 5; 10; 15; 20; 30; 40; 50; 60; 80; 80; 160; 240; 320; 400; 600; 800; 1200; 1600 мкг дм 3 .
В каждую колбу сразу после добавления сульфида, доведения объема раствора до метки и перемешивания вводят 5 см 3 раствора ДМФДА и 5 см 3 раствора хлорида железа (III), погружая пипетки в раствор сульфида и поднимая вверх по мере вытекания растворов. Затем колбу закрывают пробкой, тщательно перемешивают, помещают в темноту и приступают к приготовлению следующего раствора.
Растворы с концентрацией сероводорода 0 — 80 мкг/дм 3 не ранее, чем через 30 мин после добавления реактивов переносят в делительные воронки вместимостью 0,75 — 1,0 дм 3 и далее проводят определение, как описано в 7.2.
Оптическую плотность растворов с концентрацией сероводорода 5 — 30 мкг/дм 3 измеряют в кюветах с толщиной слоя 2 см 3 , оптическую плотность растворов с концентрацией 20 — 80 мкг/дм 3 — в кюветах с толщиной 1 см. Оптическую плотность холостого раствора измеряют в обеих кюветах.
Оптическую плотность водных растворов с концентрацией сероводорода 80 — 400 мкг/дм 3 не ранее чем через 30 мин после добавления реактивов измеряют в кюветах с толщиной слоя 5 см. Оптическую плотность растворов с концентрацией 400 — 1600 мкг/дм 3 измеряют в кюветах толщиной слоя 1 см. Оптическую плотность холостого измеряют в обеих кюветах.
Градуировочные зависимости строят в координатах: концентрация сероводорода, мкг/дм 3 — оптическая плотность графически или рассчитывают методом наименьших квадратов.
Проверку градуировочных зависимостей проводят не реже одного раза в 3 мес. и обязательно при приготовлении нового раствора ДМФДА. Для каждого прибора устанавливают свою градуировочную зависимость.
Подбирают реактивные склянки вместимостью около 500 см 3 , объемы которых отличаются не более чем на 50 см 3 . Затем каждую склянку наполняют водой под пробку без пузырьков воздуха, количественно переливают воду в сухой мерный цилиндр и измеряют объем. Повторяют процедуру 2 раза и среднее из полученных значений принимают за объем склянки.
7. Выполнение измерений
7.1. Подготовка законсервированных проб к выполнению измерений сероводорода и сульфидов
Если на месте отбора пробы проведено консервирование сероводорода ацетатом кадмия, то в лаборатории в пробу вводят 5 см 3 ДМФДА и 5 см 3 раствора хлорида железа, погружая пипетки до половины склянки и поднимая их вверх по мере вытекания растворов. После введения реактивов склянку закрывают пробкой, тщательно перемешивают и помещают в темное место. Через 30 мин проводят определение сероводорода. Одновременно выполняют холостой опыт, используя 500 см 3 дистиллированной воды.
Если анализируемая вода после фиксирования сероводорода растворами ДМФДА и хлорида железа визуально не окрашена, содержимое склянки переносят в делительную воронку вместимостью 0,7 — 1,0 дм 3 добавляют 3 см 3 0,1 % раствора лаурилсульфата, встряхивают 10 раз и оставляют стоять 10 мин. Затем добавляют 7 см 3 хлороформа и экстрагируют метиленовую синь в течение 2 мин. После расслоения фаз экстракт фильтруют через бумажный фильтр (или комочек ваты), смоченный хлороформом, в градуированную пробирку вместимостью 10 см 3 . Затем проводят повторную экстракцию 5 см 3 хлороформа в течение 2 мин. Объединенный экстракт разбавляют хлороформом до 10 см 3 и измеряют оптическую плотность на фотоэлектроколориметре или спектрофотометре (λ = 656 нм) в кюветах с толщиной слоя 2 или 1 см в зависимости от интенсивности окраски не позднее, чем через 1 ч.
Если анализируемая вода с зафиксированным сероводородом имеет голубую окраску, то проводят прямое фотометрическое определение сероводорода, измеряя оптическую плотность водного раствора на фотоэлектроколориметре или спектрофотометре (λ = 667 нм) в кюветах с толщиной слоя 5 или 1 см в зависимости от интенсивности окраски. Оптическую плотность холостого опыта вычитают из оптической плотности проб.
Если в кюветах с толщиной слоя 5 см оптическая плотность водных растворов с зафиксированным сероводородом меньше оптической плотности, соответствующей концентрации сероводорода 80 мкг/дм 3 , то пробу полностью следует перенести в делительную воронку и провести экстракционно-фотометрическое определение сероводорода, как описано выше.
В том случае, когда оптическая плотность водного раствора, измеренная в кюветах с толщиной слоя 1 см, выходит за пределы градуировочной зависимости, следует разбавить окрашенный раствор и повторить измерение. Для этого отбирают 20 см 3 раствора, помещают его в мерную колбу вместимостью 100 см 3 , доводят до метки дистиллированной водой и перемешивают. Аналогично разбавляют холостую пробу.
Если и после этого оптическая плотность пробы выходит за пределы зависимости, либо когда при добавлении реактивов образуется не синяя, а синевато-фиолетовая (фиолетовая) окраска, или появляется желтовато-белый осадок (муть) серы, при наличии анализируемой воды следует провести повторное определение, предварительно разбавив исходную пробу. Для этого в мерную колбу вместимостью 100 см 3 вносят 60 — 70 см 3 воды с pH 9 — 10, пипеткой добавляют 1 — 10 см 3 анализируемой воды, доводят объем раствора в колбе до метки и перемешивают, переворачивая колбу вверх — вниз. Затем добавляют по 1 см 3 растворов ДМПФА и хлорида железа и вновь перемешивают. Через 30 мин измеряют оптическую плотность водного раствора.
8. Вычисление результатов измерений
Если проводилось измерение оптической плотности водного раствора, то массовую концентрацию сероводорода и сульфидов в анализируемой пробе воды находят по соответствующей градуировочной зависимости. При разбавлении пробы вводят соответствующую поправку.
При использовании экстракционного варианта массовую концентрацию сероводорода и сульфидов рассчитывают по формуле

где Cx — массовая концентрация сероводорода и сульфидов в анализируемой пробе воды, мкг/дм 3 ;
C — концентрация сероводорода и сульфидов, найденная по градуировочной зависимости, мкг/дм 3 ;
V — вместимость калиброванной склянки, см 3 .
Результат измерения сероводорода и сульфидов в документах, предусматривающих его использование, представляют в виде:
где D — характеристика погрешности измерения для данной массовой концентрации сероводорода и сульфидов (таблица 2).
Численные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности.
9. Контроль погрешности измерений
Оперативный контроль погрешности проводят по воспроизводимости определения сульфидов в повторных рабочих пробах воды. Периодичность контроля — не менее одной контрольной на 15 — 20 рабочих проб за период, в течение которого условия проведения анализа принимают соответствующими условиям проведения контрольных измерений.
Для проведения контроля отбирают основную и две контрольные пробы и одновременно на месте отбора фиксируют или консервируют их. В лаборатории выполняют определение сероводорода и сульфидов в основной и одной из контрольных проб. Интервал между анализом основной и контрольной пробы должен составлять 1 сут., если срок хранения зафиксированной пробы менее 2 сут., законсервированной — менее 13 сут. В противном случае анализ основной и контрольной пробы проводят одновременно.
Результат контроля признают удовлетворительным, если расхождение результатов основного ( Cx 1 ) и контрольного ( Cx 2 ) измерения не превышает норматива контроля (Кв):
Норматив контроля рассчитывают по формуле
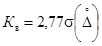
где: 
При превышении норматива повторяют измерение с использованием второй контрольной пробы. При повторном превышении норматива выясняют причины, приводящие к неудовлетворительным результатам и устраняют их.
10. Требования безопасности
10.1. При выполнении измерений массовой концентрации сероводорода и сульфидов в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в «Правилах по технике безопасности при производстве наблюдений и работ на сети Госкомгидромета». Л.. Гидрометеоиздат, 1983, или в «Типовой инструкции по технике безопасности для гидрохимических лабораторий служб Роскомвода». М., 1995.
10.2. По степени воздействия на организм вредные вещества, используемые при выполнении определений, относятся ко 2, 3 классам опасности по ГОСТ 12.1.007.
10.3. Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
10.4. Приготовление растворов сульфида и анализ с применением экстракции следует проводить при наличии вытяжной вентиляции.
11. Требования к квалификации оператора
К выполнению измерений и обработке их результатов допускаются лица со средним профессиональным образованием, освоившие методику анализа.
12. Затраты времени на проведение анализа
12.1. Затраты времени на экстракционно-фотометрическое определение.
На приготовление растворов и реактивов в расчете на 100 определений — 4,0 чел.-ч.
На установление градуировочной зависимости — 5,0 чел.-ч.
На определение сероводорода и сульфидов в единичной пробе — 1,6 чел.-ч.
На определение сероводорода и сульфидов в серии из 10 проб — 6,0 чел.-ч.
12.2. Затраты времени на фотометрическое определение.
На приготовление растворов и реактивов в расчете на 100 определений — 3,5 чел.-ч.
На установление градуировочной зависимости — 3,0 чел.-ч.
На определение сероводорода и сульфидов в единичной пробе — 0,7 чел.-ч.
На определение сероводорода и сульфидов в серии из 10 проб — 3,0 чел.-ч.
12.3. Затраты времени на осаждение взвешенных веществ в одной пробе — 0,2 чел.-ч.
Затраты времени на подготовку посуды включены в затраты времени на проведение анализа.
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО ГИДРОМЕТЕОРОЛОГИИ И МОНИТОРИНГУ ОКРУЖАЮЩЕЙ СРЕДЫ
СВИДЕТЕЛЬСТВО № 104
об аттестации МВИ
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ массовой концентрации сероводорода и сульфидов в водах фотометрическим методом с N,N-диметил-п-фенилендиамином.
ОСНОВАНА на способности сероводорода и сульфидов в кислой среде образовывать с продуктами окисления N,N-диметил-п-фенилендиамина солью железа (III) метиленовую синь, интенсивность окраски которой пропорциональна содержанию сульфидов и сероводорода. При концентрации сульфидов 50 мкг/дм 3 и более измеряют интенсивности окраски водного раствора, при концентрации 2 — 80 мкг/дм 3 проводят экстракционное концентрирование окрашенного соединения хлороформом в присутствии лаурилсульфата натрия. Измеряют оптическую плотность на фотоэлектроколориметре или спектрофотометре (λ max водного раствора 667 нм, экстракта — 656 нм).
РАЗРАБОТАНА Гидрохимическим институтом, МНПП «Акватест».
РЕГЛАМЕНТИРОВАНА в РД 52.24.450-95.
АТТЕСТОВАНА в соответствии с ГОСТ Р 8.563 (ГОСТ 8.010).
АТТЕСТАЦИЯ проведена Гидрохимическим институтом на основании результатов экспериментальных исследований в 1990 г. и метрологической экспертизы материалов в 1994 г.
В результате аттестации МВИ установлено:
1. МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками:
Значения характеристик погрешности и ее составляющих (P = 0,95)
Диапазон измеряемых концентраций сероводорода и сульфидов C, мкг/дм 3
Характеристика случайной составляющей погрешности 
Источник











