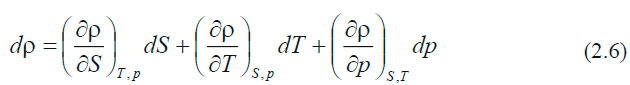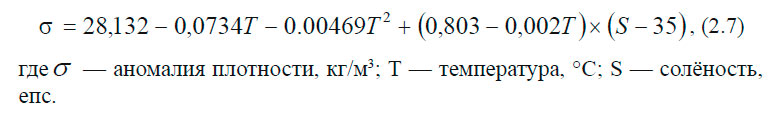- Морская вода
- Морская вода.
- Морская вода и ее свойства: соленость, температура замерзания, pH, плотность, скорость звука, теплопроводность:
- Сравнение характеристик пресной (чистой воды) воды и морской воды:
- Химический состав морской воды:
- Основные химические и физические свойства морской воды
- Содержание
- Солёность
- Плотность. Удельный объём
- Давление. Уравнение гидростатики
- Температура морской воды
- Уравнение состояния морской воды
- Литература
Морская вода
Морская вода.
Морская вода – вода морей и океанов. Ее соленость составляет в среднем 3,47 % (34,7 ‰) и колеблется от 3,4 до 3,6 % (34-36 ‰).
Морская вода и ее свойства: соленость, температура замерзания, pH, плотность, скорость звука, теплопроводность:
Морская вода – вода морей и океанов.
Солёность морской воды в Мировом океане составляет в среднем 3,47 % (34,7 ‰) и колеблется от 3,4 до 3,6 % (34-36 ‰). Это означает, что в каждом литре морской воды растворено около 35 граммов солей (в основном хлорида натрия NaCl) или 0,6 моль/литр (если предположить, что вся соль представлена NaCl).
В океанах солёность воды почти повсеместно близка к 3,5 %. Однако в морях вода имеет неравномерно распределённую солёность. Наименее солёной является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее солёной является вода Красного моря и восточная часть Средиземного моря.
В устьях рек, вблизи тающих ледников или вследствие больших количеств осадков (например, муссонов) морская вода может быть существенно менее соленой.
Соленость в изолированных водоемах может быть еще значительно больше – примерно в десять раз выше, как например имеет место в Мертвом море (хотя Метвое море морем в прямом понимании не является, а является бессточным солёным озером). Солёность Мертвого моря составляет 300-310 ‰, а в некоторые годы доходила до 350 ‰.
Морская вода непригодна для питья из-за высокого содержания солей и минеральных веществ, для выведения которых из организма требуется воды больше, чем её выпитое количество. Однако после опреснения такую воду можно пить.
Температура замерзания морской воды уменьшается с увеличением концентрации соли. При обычной солености она замерзает примерно при -2,0 °C . Самая низкая температура, при которой замерзала морская вода составляла -2,0 °C, была зарегистрирована в 2010 году под антарктическим ледником.
При охлаждении морская вода превращается в «морской лёд».
Морская вода слабощелочная. pH варьируется в пределах от 7,5 до 8,4. Однако общепринятой эталонной шкалы рН для морской воды не существует. Наиболее высоко значение pH у поверхности моря, с глубиной оно несколько снижается. В опреснённых участках (у устья рек и пр.) величина pH может снижаться до нейтральной и даже слабокислой.
Плотность морской воды колеблется в пределах от 1020 до 1030 кг/м³ и зависит от ее температуры и солености. При температуре 25 °С, солености 3,5 % и давлении 1 атм плотность морской воды составляет 1023,6 кг/м 3 . Глубоко в океане под высоким давлением плотность морской воды может достигать 1050 кг/м 3 или более. При охлаждении морская вода всегда сжимается, вследствие чего ее плотность растет.
Скорость звука в морской воде составляет около 1500 м/с и изменяется в зависимости от температуры воды, ее солености и давления. Для сравнения: скорость звука обычно составляет около 330 м/с в воздухе при давлении 1 атм.
Теплопроводность морской воды составляет 0,6 Вт/мК при 25 °С и солености 3,5 %. Теплопроводность уменьшается с увеличением солености и увеличивается с увеличением температуры.
Сравнение характеристик пресной (чистой воды) воды и морской воды:
| Наименование показателя | Морская вода с солёностью 35 ‰ | Чистая вода |
| Плотность при 25 °C, г/см 3 | 1,02412 | 0,9971 |
| Вязкость при 25 °C, миллипуаз | 9,02 | 8,90 |
| Давление пара при 20 °C, мм. рт. ст. | 17,35 | 17,54 |
| Температура максимальной плотности, °C | -3,52 (переохлаждённая жидкость) | +3,98 |
| Точка замерзания, °C | -1,91 | 0,00 |
| Поверхностное натяжение при 25 °C, дин/см | 72,74 | 71,97 |
| Скорость звука при 0 °C, м/с | 1450 | 1407 |
| Удельная теплоёмкость при 7,5 °C, Дж/(г·°C) | 3,898 | 4,182 |
Химический состав морской воды:
В морской воде в виде солей растворены практически все химические элементы из таблицы Д.И. Менделеева. Из 118 известных химических элементов 70 найдено в океанских и морских водах. По сути, морская вода содержит неисчерпаемые запасы нужных и важных для человека химических элементов, правда, в малых концентрациях.
Ниже в таблице № 1 приводится элементный состав морской воды с соленостью 3,5 %. В ней приведены химические элементы, имеющие значительную концентрацию в морской воде. В таблице № 2 приводятся химические элементы, имеющие малые концентрации.
Источник
Основные химические и физические свойства морской воды
Содержание
Солёность
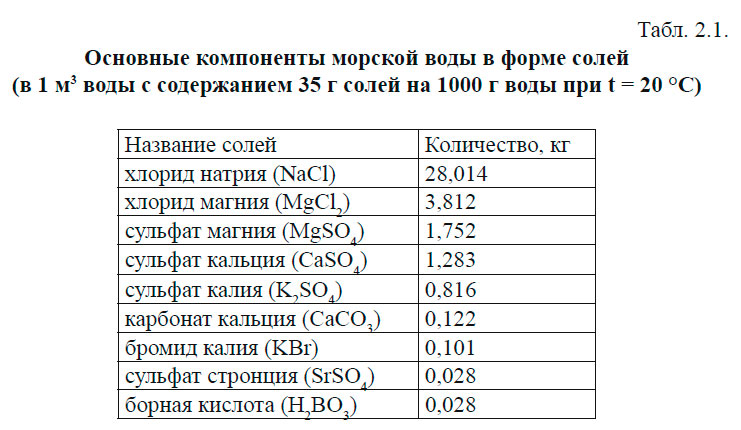
Мировой океан содержит 96,5 % всей воды нашей планеты, и в его воде растворены практически все элементы, встречающиеся на Земле. Их общая масса составляет 48 × 10 18 кг. Достаточно подробно солевой состав морской воды был исследован английским химиком Дитмаром, который имел в своем распоряжении 77 проб воды, собранных в различных частях Мирового океана и с различных глубин во время плавания «Челленджера» в 1872–1876 гг. Было установлено, что 99,9 % всех растворённых веществ приходится на первые 20 элементов таблицы Менделеева. Основные компоненты морской воды представлены в табл. 2.1 в форме солей.
В открытых частях Мирового океана процентное отношение основных компонентов солевого состава приблизительно постоянно (закон Дитмара), т. е. соотношения Na/Cl, К/Cl, SO4/Cl и Br/Cl являются константами. Это позволяет определять общую солёность по измерению одного из компонентов. Им является ион хлора Cl- , так как он составляет 55,3 % от общего количества и легко определяется.
Определение солёности. Истинная солёность должна быть определена как «отношение массы растворённого твёрдого вещества в морской воде к её массе». Однако это определение не используется, так как невозможно определить точное количество растворённых веществ. При выпаривании воды до сухого остатка требуется длительное нагревание, и на его последней стадии происходит разложение карбонатов и солей магния. Метод, дающий воспроизводимые результаты, был предложен группой исследователей, в которую входили М. Кнудсен, К. Соренсен, С. Форх [2]. Обезвоживание до постоянного веса производилось в среде хлора при температуре 480 °С. При этой процедуре органическая часть разлагается, карбонаты переходят в окислы, а бромистые и йодистые соединения — в хлориды.
Применение этого метода привело к следующему условному определению солёности: солёностью считается количество твёрдого вещества в граммах, содержащееся в 1 кг морской воды, когда карбонаты перешли в окислы, бромиды и йодиды заменены их хлористыми эквивалентами и органическая часть окислена. Использовать этот метод на практике для массовых определений солёности невозможно в виду его сложности. В настоящее время для определения солёности используются два метода: метод Мора — Кнудсена и определение солёности по электропроводности воды.
Метод Мора — Кнудсена основан на постоянстве солевого состава морской воды. В нем солёность определяется по содержанию иона хлора, которое легко найти осаждением галогенов из пробы морской воды азотнокислым серебром. Солёность обозначается символом S и измеряется в г/кг или промилле ( 0 /00) по формуле:
где Cl — хлорозность (масса серебра, потребная для полного осаждения галогенов в 0,3285234 кг морской воды).
Попытки определять солёность по электропроводности предпринимались ещё в 1930-е гг. Однако многочисленные технические трудности удалось преодолеть только к 1970-м гг. Были созданы приборы (солемеры), позволяющие измерять электропроводность не только в лаборатории, но и in Situ (на месте в воде), что в настоящее время широко используется в практике экспедиционных исследований с использованием зондирующих комплексов, в частности СТД-зондов (солёность, температура, давление).
В 1978 г. для определения солёности по электропроводности была разработана Шкала практической солёности (ШПС–78).Она основана на эмпирической зависимости электропроводности растворов стандартной морской воды. Эталоном в этом методе является водный раствор хлористого калия (КCl) при температуре 15 °С и давлении в одну стандартную атмосферу (101325 Па). Солёность, измеренная по электропроводности, была названа практической солёностью. При написании практической солёности знак промилле ( 0 /00) опускается. В отечественной литературе используется аббревиатура «eпc» (единицы практической солёности), в англоязычной — «psu» (practical salinity units) или «PSS–78» (practical salinity scale). Численные значения практической солёности совпадают с численными значениями солёности, выраженной в промилле.
Солёность большинства океанских вод заключена в пределах от 33 до 37 епс. Исключением являются воды приустьевых участков рек, бассейнов опреснения (Балтийское и Чёрное моря), где солёность значительно меньше, и бассейны осолонения (Средиземное и Красное моря), где солёность превышает 38 епс. В открытых районах Балтийского моря солёность около 10 епс, в Невской губе — 2–3 епс. В Чёрном море солёность вод 17,5–18 епс. Средняя солёность Мирового океана равна 34,72 епс. Наименьшая солёность поверхностных океанских вод 34,43 епс наблюдается между 5 и 10 градусами широты, как Северном, так и в Южном полушариях. С удалением к северу в Северном полушарии солёность увеличивается и достигает максимума на пространстве между 25 и 30 градусами северной широты. В Южном полушарии максимальная солёность наблюдается между 20 и 25 градусами южной широты. Это так называемые субтропические максимумы солёности со значением 35,8 0 /00. С удалением к полюсам солёность уменьшается.
Плотность. Удельный объём
В океанографии параметр состояния «масса» при использовании заменяется параметром «плотность», а объём — удельным объёмом. Физическое понятие плотности — это масса единицы объёма. В случае однородного тела его плотность одинакова по всему объёму и может быть определена по формуле:
Так как в океанографии эти параметры используются во многих практических расчётах, то вместо абсолютных значений плотности и удельного объёма используются:
- условная плотность (аномалия плотности);
- условный удельный объём (аномалия условного удельного объёма).
Эта замена не имеет физического смысла и используется только для того, чтобы сократить число знаков при проведении вычислений. Рассмотрим это на примере: средняя плотность морской воды при атмосферном давлении, температуре 17 °С и солёности 34,5 eпc ( 0 /00) равна: ρ (34.5; 17; 0) = 1025,15 кг∙м -3 .
Условная плотность (аномалия плотности) обозначается обычно буквой σ и будет равна:
В толще воды существуют поверхности одинаковой плотности — изопикнические и поверхности одинакового удельного объёма — изостерические.
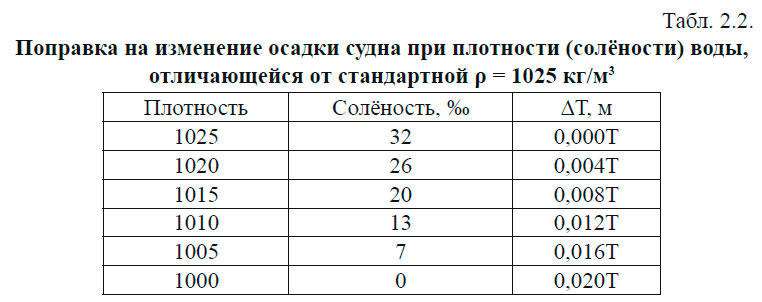
В зависимости от плотности воды изменяется осадка судна. Величина изменения дана в табл. 2.2.
Давление. Уравнение гидростатики
Давлением называется отношение силы, действующей по нормали к поверхности тела, к площади этой поверхности.
Если вода находится в состоянии равновесия, то давление — величина скалярная, т. е. оно одинаково во всех направлениях и не зависит от ориентации площадки ΔZ, на которую действует.
В толще воды океана, находящегося в состоянии покоя, давление на двух разных горизонтах будет отличаться на величину, равную ρgΔz, где ρ — плотность воды, g — ускорение силы тяжести, Δz — расстояние между горизонтами.
Таким образом, давление на глубине z будет равно:
Это выражение называется уравнением гидростатики.
Поверхности равного давления называются изобарическими.
В Международной системе единиц СИ за единицу давления принят паскаль (Па): 1 Па = 1 кг∙м -1 ∙с -2 = 1 н/м 2
В океанологии долгое время применялись внесистемные единицы, которые применяются и поныне: 1 бар = 10 5 Па; 1 дбар = 10 4 Па.
Последняя единица очень удобна для применения, так как при изменении глубины на 1 м, давление изменяется на 1 дбар.
Поэтому очень часто в океанологии вместо глубины в метрах, глубину дают в величинах давления. Например: глубина в 1000 дбар ≈ 1000 м.
В единицах СИ:
1000 м = 10 000 000 Па = 10 000 кПа= 10 МПа,
где кПа — килопаскали; МПа — мегапаскали.
Температура морской воды
Измерение температуры производится косвенным путём, то есть измеряются физические свойства тел или материалов, которые зависят от температуры. В качестве начала отсчёта шкалы температуры и единицы её измерения применяются температуры перехода чистой воды из одного агрегатного состояния в другое, т. е. температура плавления льда (Т0) и кипения воды (Тк) при нормальном атмосферном давлении.
В океанографии температура измеряется в градусах шкалы Цельсия. Различают температуру in Situ, т. е. температуру, измеренную на определенной глубине, и потенциальную температуру — это температура частицы воды, адиабатически приведённая от давления в точке измерения к заданному давлению (например, поднятой на поверхность). Кроме градусов Цельсия применяется температура в единицах абсолютной шкалы Кельвина (°К). Шкала Кельвина начинается от абсолютного нуля, равного −273,15 0С, т. е.
Температура воды в океане изменяется в пределах от
+30 °С. Нижний предел зависит от температуры замерзания, которая является функцией солёности морской воды. Вода солёностью 35 епс начнёт замерзать, когда её температура понизится приблизительно до −2 °С. Верхний предел зависит от теплообмена между океаном и атмосферой. В прибрежной мелководной зоне, в замкнутых морях температура может быть и больше 30 °С. Самая высокая среднегодовая температура воды наблюдается на пространстве между 5 и 10° с. ш. и равняется 27,4 °С (термический экватор). С удалением к северу и югу температура понижается и проходит через 0 °С (т. е. в область отрицательных температур) в Северном полушарии между 70 и 75° с. ш., а в южном — 60–65° ю. ш.
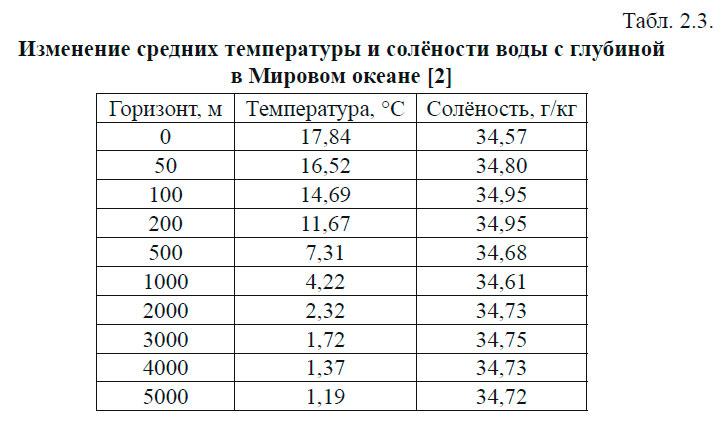
С глубиной температура воды убывает. В верхних слоях примерно до 1500 м характер убывания неодинаков и зависит от географической зоны. Однако, начиная с 1500 м, температура воды во всех океанах медленно понижается от 4–5 °С на верхней границе до 2–0 °С у дна. Исключение составляют полярные районы, которые имеют чётко выраженный промежуточный максимум в слое 300–500 м (1,75–1,83 °С) и подповерхностный минимум в слое 50–100 м (0,99–0,55 °С). На глубине 1500 м температура равна 1,14 °С. Изменение средних температур и солёностей воды с глубиной представлены в табл. 2.3.
Уравнение состояния морской воды
Зависимость, связывающая между собой плотность, температуру, солёность и давление, называется уравнением состояния морской воды.
В общем виде его можно записать так:
Это полный дифференциал плотности морской воды.
В настоящее время из-за сложности этой зависимости уравнение состояния морской воды не может быть найдено теоретически. Поэтому в практике расчётов используются эмпирические формулы. Однако эмпирические формулы также очень громоздки, что препятствует их непосредственному применению в теоретических моделях, которые применяются для изучения океанских течений. Поэтому часто используются более простые зависимости:
Литература
Гидрометеорологическое Обеспечение Мореплавания — Глухов В.Г., Гордиенко А.И., Шаронов А.Ю., Шматков В.А. [2014]
Источник