- Водорода оксид: получение и свойства
- Водород и его соединения
- Химические свойства водорода
- Вода — оксид водорода
- Строение молекулы воды
- Физические свойства оксида водорода
- Водорода оксид: химические свойства
- Распространение в природе
- Способы получения
- Биологическая роль
- Оксид водорода
- Содержание
- Физические и химические свойства
- Физические свойства
- Агрегатные состояния
- Изотопные модификации воды
- Химические свойства
- Вода в природе
- Атмосферные осадки
- Виды воды
- Характеристики вод
- Исследования воды
- Гидрология
- Биологическая роль
- Применение
- Земледелие
- Питьё и приготовление пищи
- Растворитель
- Теплоноситель
- Пожаротушение
- Спорт
- Инструмент
Водорода оксид: получение и свойства
Самое важное и распространенное на нашей планете вещество, безусловно, вода. Что может сравниться с ней по значимости? Известно, что жизнь на Земле стала возможна только с появлением жидкости. Что же собой представляет вода (оксид водорода) с химической точки зрения? Из чего состоит и какими свойствами обладает? Попробуем разобраться в данной статье.
Водород и его соединения
Самый легкий атом во всей периодической системе — водород. Он же занимает двойственное положение, располагаясь как в подгруппе галогенов, так и и первой группе щелочных металлов. Чем объясняются такие особенности? Электронным строением оболочки его атома. У него всего один электрон, который свободно может как уходить, так и присоединять себе еще один, формируя пару и завершая внешний уровень.
Именно поэтому основные и единственные степени окисления данного элемента +1 и -1. Он легко вступает во взаимодействие с металлами, образуя гидриды — твердые нелетучие солеподобные соединения белого цвета.
Однако также легко водород формирует и летучие молекулы веществ, взаимодействуя с неметаллами. Например:
В целом соединений водород формирует достаточно много. Однако самым важным веществом, в состав которого он входит, является оксид водорода, формула которого Н2О. Это самое известное соединение, которое узнает по формуле даже ученик начальных классов, еще не знакомый с химией. Ведь вода (а это и есть высший оксид водорода) — не только распространенное вещество, но и источник жизни на нашей планете.
Само название элемента отражает его главную сущность — водород, то есть «рождающий воду». Как и любой другой оксид, данный также является бинарным соединением, обладающим рядом физических, химических свойств. Кроме того, имеются и особые характеристики, отличающие воду от всех других соединений.
Также важным классом соединений, которые образует водород, являются кислоты, как органические, так и минеральные.
Химические свойства водорода
С точки зрения химической активности, водород — достаточно сильный восстановитель. Во многих реакциях он проявляет именно такие свойства. Однако при взаимодействии с еще более сильными металлами, он становится окислителем.
Очень важным в промышленности является взаимодействие водорода с оксидами металлов. Ведь это один из способов получения последних в чистом виде. Водородотермия — это металлургический метод синтеза чистых металлов из их оксидов путем восстановления водородом.
Реакция водорода с оксидом имеет следующий общий вид: MexOy + H2 = H2O + Me.
Конечно, это далеко не единственный способ синтеза чистых металлов. Существуют и другие. Однако восстановление оксидов водородом — энергетически достаточно выгодный и несложный производственный процесс, нашедший себе широкое применение.
Также интересна та особенность, что при смешении с воздухом газ водород способен образовывать сильно взрывчатую смесь. Ее название гремучий газ. Для этого смешивание следует производить из расчета два объема водорода на один кислорода.
Вода — оксид водорода
То, что данный оксид очень важный, мы уже несколько раз упомянули. Теперь давайте охарактеризуем его с точки зрения химии. Действительно ли данное соединение относится именно к этому классу неорганических веществ?
Для этого попробует немного иначе записать формулу: H2O = НОН. Суть та же, количество атомов прежнее, однако, теперь очевидно, что перед нами гидроксид. Какими свойствами должен он обладать? Рассмотрим диссоциацию соединения:
Следовательно, свойства кислотные, так как в растворе присутствуют катионы водорода. К тому же основными они быть не могут, ведь щелочи формируют только металлы.
Поэтому еще одно название, которое имеет водорода оксид — кислородсодержащая кислота самого простого состава. Раз такие сложные переплетения характерны для данной молекулы, следовательно, и свойства ее будут особенными. А свойства отталкиваются от строения молекулы, поэтому его и разберем.
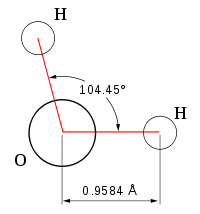
Строение молекулы воды
Впервые о данной модели задумался Нильс Бор, ему и принадлежит первенство и авторство в этом вопросе. Им были установлены следующие особенности.
- Молекула воды — диполь, так как элементы, входящие в ее состав сильно отличаются по значению электроотрицательности.
- Форма ее треугольная, в основании — водороды, а в вершине — кислород.
- Благодаря такому строению, данное вещество способно формировать водородные связи, как между одноименными молекулами, так и с другими соединениями, имеющими в составе сильно электроотрицательный элемент.
Посмотреть, как схематически выглядит рассматриваемый водорода оксид, можно на фото ниже.
Физические свойства оксида водорода
Можно обозначить несколько основных характеристических черт.
- Агрегатное состояние: газообразное — пар, жидкое, твердое — снег, лед.
- Температура кипения — 100 0 С (99,974).
- Температура плавления — 0 0 С.
- Вода способна сжиматься при нагревании в интервале температур от 0-4 0 С. Этим объясняется образование льда на поверхности, который имеет меньшую плотность и сохранение жизни под толщей оксида водорода.
- Высокое значение теплоемкости, однако очень низкая теплопроводность.
- В жидком состоянии водорода оксид проявляет вязкость.
- Особенным свойством можно назвать поверхностное натяжение и формирование отрицательного электропотенциала на поверхности воды.
Как мы отмечали выше, особенности свойств зависят от строения. Так и здесь. Способность формировать водородные связи привела к подобным чертам данного соединения.
Водорода оксид: химические свойства
С точки зрения химии, активность воды достаточно высока. Особенно если речь идет о реакциях, сопровождаемых нагреванием. С чем способен вступать во взаимодействие оксид водорода?
- С металлами, которые в ряду напряжений стоят до водорода. При этом с самыми активными (до алюминия) не нужны особые условия, а обладающие более низкой восстановительной способностью реагируют только с паром. Те же, что стоят после водорода, вообще не способны вступать в подобные взаимодействия.
- С неметаллами. Не со всеми, однако с большинством. Например, в атмосфере фтора вода сгорает фиолетовым пламенем. Также реакция возможна с хлором, углеродом, кремнием и другими атомами.
- С оксидами металлов (основными) и кислотными (неметаллов). Образуются, соответственно, щелочи и кислоты. Среди металлов к таким реакциям способны представители первых двух групп главных подгрупп, кроме магния и бериллия. Неметаллы, образующие кислотные оксиды, взаимодействуют с водой все. Исключением является речной песок — SiO2.
Уравнение реакций оксида водорода в качестве примера можно привести следующее: SO3 + H2O = H2SO4.
Распространение в природе
Мы уже выяснили, что данное вещество — самое распространенное в мире. Обозначим процентное содержание в объектах.
- Около 70% от массы тела человека и млекопитающих животных. Некоторые представители фауны состоят из оксида водорода примерно на 98% (медузы).
- 71% Земли покрыт водой.
- Наибольшая масса составляет воды Мирового океана.
- Около 2% содержится в ледниках.
- 0,63% сосредоточено под землей.
- 0,001% приходится на атмосферу (туман).
- Тело растений состоит на 50% из воды, некоторых видов даже больше.
- Многие соединения встречаются в виде кристаллогидратов, содержащих связанную воду.
Продолжать данный список можно долго, ведь сложно вспомнить хоть что-нибудь, в состав чего не входит вода или когда-то не входила. Либо образовалось без участия этого оксида.
Способы получения
Получение оксида водорода промышленного значения не имеет. Ведь проще использовать готовые источники — реки, озера и прочие водоемы, чем затрачивать огромное количество энергии и реактивов. Поэтому в лаборатории уместно лишь получение дистиллированной, особо чистой воды.
Для этих целей используют определенные аппараты, такие как перегонные кубы. Такая вода необходима для проведения многих химических взаимодействий, так как неочищенная содержит большое количество посторонних примесей, солей, ионов.
Биологическая роль
Сказать, что вода используется везде, не сказать ничего. Немыслимо представить свою жизнь без этого соединения. С самого утра и до самой ночи человек постоянно использует его как в бытовых, так и промышленных целях.
Свойства оксида водорода подразумевают использование его как универсального растворителя. Причем не только в лаборатории. Но и в живых существах, где ежесекундно происходят тысячи биохимических реакций.
Также вода сама является участником многих синтезов, она же служит побочным продуктом, образующимся в результате них. Каждый человек на Земле за 60 лет пропускает через себя около 50 тонн этого удивительного вещества!
Оксид водорода используется:
- во всех отраслях промышленности;
- медицине;
- химических синтезах;
- во всех видах производств;
- бытовых нуждах;
- сельском хозяйстве.
Сложно определить область жизни, в которой можно обойтись без воды. Единственными живыми существами, не имеющими оксид водорода в своем составе и живущими без него, являются вирусы. Именно поэтому человеку сложно бороться с этими организмами.
Источник
Оксид водорода
Оксид водорода
| Вода | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Физические свойства | |
| Плотность вещества | 0,9982 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с (при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Содержание
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
- При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
- При нагревании от 0 °C до 4 °C (3,98 °C — точно) вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода, как менее плотная, остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
- Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [1] ), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Высокая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O + ) и гидроксильных ионов HO — составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде. Роль воды в клетке — см. статью
Атмосферные осадки
Осадки согласно направлению
| «Вертикальные» осадки | «Горизонтальные» осадки | Свободно-парящие структуры |
|---|---|---|
| Дождь | Роса | Облака |
| Дождь со снегом | Иней | Туман |
| Изморось | Атмосферное оледенение | Морская пена |
| Переохлаждённая морось | Гололёд | |
| Снег | ||
| Снежная крупа | ||
| Снежные зерна | ||
| Ледяная крупа | ||
| Ледяной дождь | ||
| Град | ||
| Ледяные кристаллы |
Осадки согласно состоянию
| Жидкие осадки | Твёрдые осадки |
|---|---|
| Дождь | Снег |
| Дождь со снегом | Снежная крупа |
| Изморось | Снежные зерна |
| Переохлаждённая морось | Ледяная крупа |
| Роса | Ледяной дождь |
| Град | |
| Ледяные кристаллы | |
| Иней | |
| Атмосферное оледенение | |
| Гололёд |
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90% в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55% до 78% воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
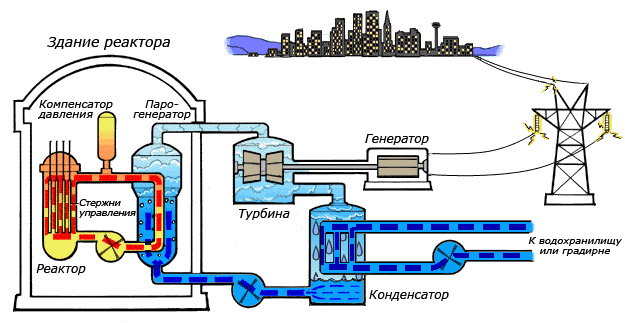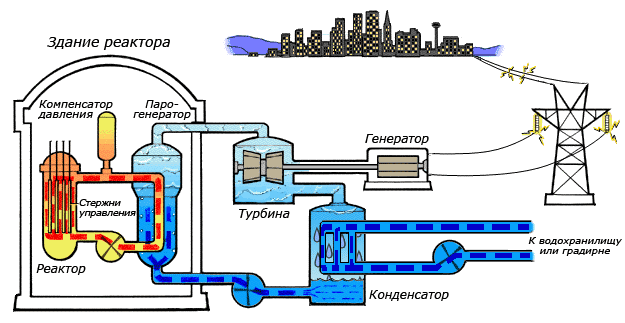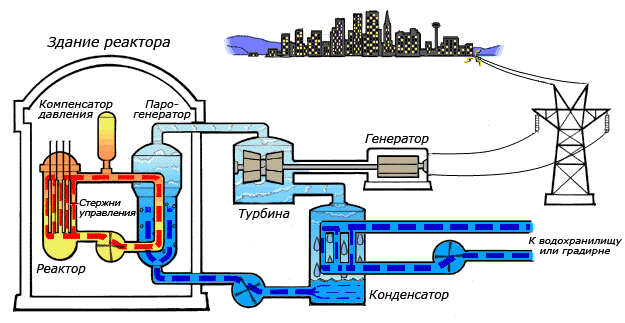
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
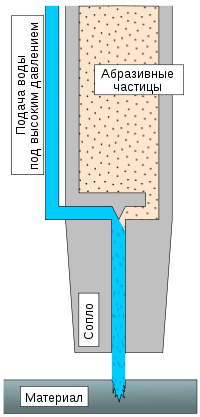
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Источник