- Наибольшую относительную молекулярную массу имеет :а) хлороводородб) фтороводородв) водаг) сероводород?
- Молекулярная формула углеводорода с относительной молекулярной массой 56 : А?
- Вещества, молекулы которых образованы только ковалентной неполярной связью, это : а) хлор и хлороводород ; б)водород и сероводород ; в)водород и азот ; г)хлороводород и сероводород?
- Наибольшая относительная молекулярная масса у вещества с формулой?
- Не производя расчетов, а только на основании значений относительных атомных масс (найдите их по таблице Д?
- Рассчитайте относительную молекулярную и молярную массы хлороводорода?
- Наибольшую молекулярную массу имеет : А) C3H7OH ; Б) C4H8 ; В) HCOOH ; Г) CH4?
- Восстановительные свойства в наибольшей степени выражены у : 1) ФТОРОВОДОРОДА 2) ХЛОРОВОДОРОДА 3) БРОМОВОДОРОДА 4) ИОДОВОДОРОДА?
- Чему равна относительная молекулярная масса воды?
- Определить относительную молекулярную массу хлороводорода если его относительная плотность по водороду равна 18, 25?
- Наименьшую относительную молекулярную массу имеет просто вещество А?
- Молекулы. Химические формулы. Молекулярные массы
- 6. Наибольшую относительную молекулярную массу имеет : 1) вода(Н2О) ; 2) углекислый газ (СО2) ; 3) хлороводород (НС1) ; 4) сероводород (H2S)?
- Наибольшую относительную молекулярную массу имеет вещество 1?
- Какое Из Следующих Чисел соответствует относительной молекулярной массе углекислого газа (CO2) a22 b44 v 66 g88?
- При сгорании 18, 4г гомолога бензола образуется 1, 4 моль углекислого газа?
- Во сколько раз относительная молекулярная масса углекислого газа больше относительной атомной массы кислорода 2?
- Относительная молекулярная масса CO2(углекислый газ) равна?
- Рассчитайте относительную молекулярную и молярную массы хлороводорода?
- Рассчитать молекулярную массу углекислого газа?
- Молекула углекислого газа состоит из атома углерода и двух атомов кислорода?
- 3. К чистым веществам (в отличии от смесей) относятся : 1)чернила 2)дистиллированная вода 3)железо 4) железная руда 5?
- Почему молекулярная масса H2O меньше чем молекулярная масса H2S хотя вода жидкость а сероводород газ?
Наибольшую относительную молекулярную массу имеет :а) хлороводородб) фтороводородв) водаг) сероводород?
Химия | 5 — 9 классы
Наибольшую относительную молекулярную массу имеет :
Хлороводород, у него относительная молекулярная масса 36, 5.
Молекулярная формула углеводорода с относительной молекулярной массой 56 : А?
Молекулярная формула углеводорода с относительной молекулярной массой 56 : А.
Вещества, молекулы которых образованы только ковалентной неполярной связью, это : а) хлор и хлороводород ; б)водород и сероводород ; в)водород и азот ; г)хлороводород и сероводород?
Вещества, молекулы которых образованы только ковалентной неполярной связью, это : а) хлор и хлороводород ; б)водород и сероводород ; в)водород и азот ; г)хлороводород и сероводород.
Составьте из электронные схемы.
Наибольшая относительная молекулярная масса у вещества с формулой?
Наибольшая относительная молекулярная масса у вещества с формулой.
Al2O3 Fe2O3 BaO.
Не производя расчетов, а только на основании значений относительных атомных масс (найдите их по таблице Д?
Не производя расчетов, а только на основании значений относительных атомных масс (найдите их по таблице Д.
И. Менделеева) определите, у какого из веществ, формулы которых приведены ниже, наибольшая и наименьшая относительные молекулярные массы : а) селеноводорода H2Se ; б) воды Н2О ;
в) теллуроводорода H2Te ; г) сероводорода H2S.
Рассчитайте относительную молекулярную и молярную массы хлороводорода?
Рассчитайте относительную молекулярную и молярную массы хлороводорода.
Наибольшую молекулярную массу имеет : А) C3H7OH ; Б) C4H8 ; В) HCOOH ; Г) CH4?
Наибольшую молекулярную массу имеет : А) C3H7OH ; Б) C4H8 ; В) HCOOH ; Г) CH4.
Восстановительные свойства в наибольшей степени выражены у : 1) ФТОРОВОДОРОДА 2) ХЛОРОВОДОРОДА 3) БРОМОВОДОРОДА 4) ИОДОВОДОРОДА?
Восстановительные свойства в наибольшей степени выражены у : 1) ФТОРОВОДОРОДА 2) ХЛОРОВОДОРОДА 3) БРОМОВОДОРОДА 4) ИОДОВОДОРОДА.
Чему равна относительная молекулярная масса воды?
Чему равна относительная молекулярная масса воды?
А) 30 б) 18 в) 16 г) 90 д) 20.
Определить относительную молекулярную массу хлороводорода если его относительная плотность по водороду равна 18, 25?
Определить относительную молекулярную массу хлороводорода если его относительная плотность по водороду равна 18, 25.
Наименьшую относительную молекулярную массу имеет просто вещество А?
Наименьшую относительную молекулярную массу имеет просто вещество А.
Вы зашли на страницу вопроса Наибольшую относительную молекулярную массу имеет :а) хлороводородб) фтороводородв) водаг) сероводород?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
Наилучший под горячей водой и моющим средством наихудший под холодной водой.
24 г Х г CuSO4 + 2NaOH — > Cu(OH)2 + Na2SO4 n = 2 моль n = 1 моль М = 40 г / моль М = 97, 5 г / моль m = 80 г m = 97, 5 г 24 г NaOH — Х г Cu(OH)2 80 г NaOH — 97, 5 г Cu(OH)2 m(Cu(OH)2) = 24 * 97, 5 / 80 = 29, 25 г.
Au — золото Ag — серебро.
MgCl2 + 2AgNO3 = Mg(NO3)2 + 2AgCl↓ n(MgCl2) = m / M = 19 г / 95 г / моль = 0, 2 моль n(AgCl) = 2n(MgCl2) = 0. 4 моль m(AgCl) = n * M = 0. 4 моль * 143 г / моль = 57, 2 моль.
Я загуглил и нашёл решение твоей задачи.
С2H2 + H2O — > CH3 — С = О получится ацетальдегид(уксусный альдегид) ⊥ Н — катализатор соли ртути (HgSO4 или HgCl2).
Решение задачи находится на фото.
4. 2)Ca(OH)2 = CaO + H20 3) 2Fe(OH)3 = Fe2O + 3H2O 4)Zn(OH)2 = ZnO + H2O 5)Mg(OH)2 = MgO + H2O 6) 2AL(OH)3 = AL2O3 + 3H2O 7)KOH = K2O + H2O 9)Cu(OH)2 = CuO + H2O.
C% = (гр(соли) / гр(раствор) ) * 100% раствор = гр(вода) + гр (соль) р / р = 245, 7 + 1000 = 1245, 7 С% = (245, 7 / 1245, 7) * 100% = 19, 72% Cm = (С% * р * 10) / Мр Мр = 39(K) + 35. 5(Cl) = 74. 5 Cm = (19. 72 * 1. 131 * 10) / 74. 5 = 3.
Фосфат Натрия — Na₃PO₄. Оксид свинца || — PbO Сульфид Цинка — ZnSO4 Кремниевые Кислоты — nSiO₂•mH₂O. Сульфат серебра — Ag2SO4 Карбонат Магния — MgCO3 Нитрит Калия — NaNO2 Гидрокарбонат бария — NaHCO Сульфид железа ||| — Fe2S3 Оксид алюминия — Al2O3..
Источник
Молекулы. Химические формулы. Молекулярные массы
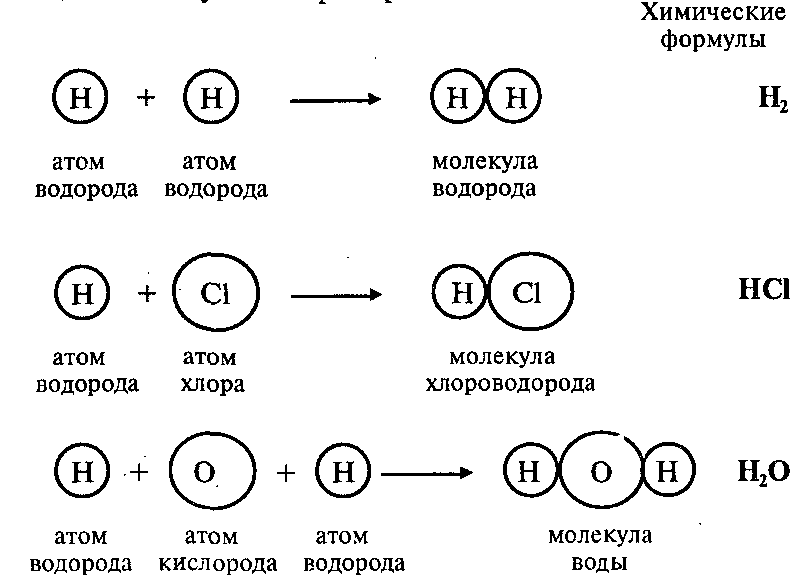
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НCl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2O. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молекула серной кислоты состоит из двух атомов водорода Н, одного атома серы S и четырех атомов кислорода О. Значит, формула молекулы серной кислоты — H2SO4.
Существуют молекулы, в состав которых входит несколько одинаковых групп атомов. В формулах таких молекул эти группы атомов заключают в скобки, а индекс за скобками показывает число этих групп в молекуле. Например, формула Cu(NO3)2 показывает, что эта молекула состоит из одного атома меди и двух групп атомов NО3, т. е. двух атомов азота и шести атомов кислорода.
Таким образом, химические формулы доказывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.): Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так как вещество состоит из одинаковых молекул, то состав молекулы определяет состав всего вещества. Различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
Молекула — это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Например, относительная молекулярная масса воды Н2O равна:
Mr(H2О) = Ar(H) + Аr(Н) + Аr(О) = 2Аr(Н) + Аr(О) =2∙1+16=18;
относительная молекулярная масса сульфата железа (III) Fe2(SO4)3 равна: Mr[Fe2(SO4)3] = 2Ar(Fe) + 3Ar(S) + 12Ar(O) = 2∙56+3∙32+12∙16=400;
Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например, относительная молекулярная масса воды Mr(H2О) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
где ω(Х) — массовая доля элемента Х; Ar(X) — относительная атомная масса элемента Х; n — число атомов элемента Х в молекуле вещества; Мr — относительная молекулярная масса вещества.
Источник
6. Наибольшую относительную молекулярную массу имеет : 1) вода(Н2О) ; 2) углекислый газ (СО2) ; 3) хлороводород (НС1) ; 4) сероводород (H2S)?
Химия | 5 — 9 классы
6. Наибольшую относительную молекулярную массу имеет : 1) вода(Н2О) ; 2) углекислый газ (СО2) ; 3) хлороводород (НС1) ; 4) сероводород (H2S).
Наибольшую относительную молекулярную массу имеет углекислый га, т.
К 12 + (16 * 2) = 44
вода(Н2О) = 18 ; хлороводород (НСl) = 36, 5 ; сероводород (H2S) = 34.
Наибольшую относительную молекулярную массу имеет вещество 1?
Наибольшую относительную молекулярную массу имеет вещество 1.
Какое Из Следующих Чисел соответствует относительной молекулярной массе углекислого газа (CO2) a22 b44 v 66 g88?
Какое Из Следующих Чисел соответствует относительной молекулярной массе углекислого газа (CO2) a22 b44 v 66 g88.
При сгорании 18, 4г гомолога бензола образуется 1, 4 моль углекислого газа?
При сгорании 18, 4г гомолога бензола образуется 1, 4 моль углекислого газа.
Укажите относительную молекулярную массу гомолога.
Во сколько раз относительная молекулярная масса углекислого газа больше относительной атомной массы кислорода 2?
Во сколько раз относительная молекулярная масса углекислого газа больше относительной атомной массы кислорода 2.
Относительная молекулярная масса CO2(углекислый газ) равна?
Относительная молекулярная масса CO2(углекислый газ) равна.
Рассчитайте относительную молекулярную и молярную массы хлороводорода?
Рассчитайте относительную молекулярную и молярную массы хлороводорода.
Рассчитать молекулярную массу углекислого газа?
Рассчитать молекулярную массу углекислого газа.
Молекула углекислого газа состоит из атома углерода и двух атомов кислорода?
Молекула углекислого газа состоит из атома углерода и двух атомов кислорода.
Напишите её формулу и рассчитайте относительную молекулярную массу.
3. К чистым веществам (в отличии от смесей) относятся : 1)чернила 2)дистиллированная вода 3)железо 4) железная руда 5?
3. К чистым веществам (в отличии от смесей) относятся : 1)чернила 2)дистиллированная вода 3)железо 4) железная руда 5.
Наибольшую относительную атомную массу имеет : 1)углерод 2)азот 3)литий 4)водород 6.
Наибольшую относительную молекулярную массу имеет : 1)сероводород(H2S) 3)хлороводород(HCI) 2)бромоводород(HBr) 4)фтороводород(HF).
Почему молекулярная масса H2O меньше чем молекулярная масса H2S хотя вода жидкость а сероводород газ?
Почему молекулярная масса H2O меньше чем молекулярная масса H2S хотя вода жидкость а сероводород газ?
На этой странице находится ответ на вопрос 6. Наибольшую относительную молекулярную массу имеет : 1) вода(Н2О) ; 2) углекислый газ (СО2) ; 3) хлороводород (НС1) ; 4) сероводород (H2S)?, из категории Химия, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
Наилучший под горячей водой и моющим средством наихудший под холодной водой.
24 г Х г CuSO4 + 2NaOH — > Cu(OH)2 + Na2SO4 n = 2 моль n = 1 моль М = 40 г / моль М = 97, 5 г / моль m = 80 г m = 97, 5 г 24 г NaOH — Х г Cu(OH)2 80 г NaOH — 97, 5 г Cu(OH)2 m(Cu(OH)2) = 24 * 97, 5 / 80 = 29, 25 г.
Au — золото Ag — серебро.
MgCl2 + 2AgNO3 = Mg(NO3)2 + 2AgCl↓ n(MgCl2) = m / M = 19 г / 95 г / моль = 0, 2 моль n(AgCl) = 2n(MgCl2) = 0. 4 моль m(AgCl) = n * M = 0. 4 моль * 143 г / моль = 57, 2 моль.
Я загуглил и нашёл решение твоей задачи.
С2H2 + H2O — > CH3 — С = О получится ацетальдегид(уксусный альдегид) ⊥ Н — катализатор соли ртути (HgSO4 или HgCl2).
Решение задачи находится на фото.
4. 2)Ca(OH)2 = CaO + H20 3) 2Fe(OH)3 = Fe2O + 3H2O 4)Zn(OH)2 = ZnO + H2O 5)Mg(OH)2 = MgO + H2O 6) 2AL(OH)3 = AL2O3 + 3H2O 7)KOH = K2O + H2O 9)Cu(OH)2 = CuO + H2O.
C% = (гр(соли) / гр(раствор) ) * 100% раствор = гр(вода) + гр (соль) р / р = 245, 7 + 1000 = 1245, 7 С% = (245, 7 / 1245, 7) * 100% = 19, 72% Cm = (С% * р * 10) / Мр Мр = 39(K) + 35. 5(Cl) = 74. 5 Cm = (19. 72 * 1. 131 * 10) / 74. 5 = 3.
Фосфат Натрия — Na₃PO₄. Оксид свинца || — PbO Сульфид Цинка — ZnSO4 Кремниевые Кислоты — nSiO₂•mH₂O. Сульфат серебра — Ag2SO4 Карбонат Магния — MgCO3 Нитрит Калия — NaNO2 Гидрокарбонат бария — NaHCO Сульфид железа ||| — Fe2S3 Оксид алюминия — Al2O3..
Источник