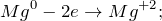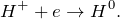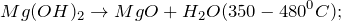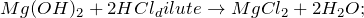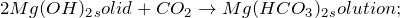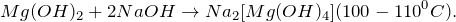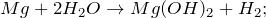- Магний: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Реакция магния с водой
- Реакция взаимодействия магния с водой.
- Уравнение реакции взаимодействия магния с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Mg + H2O = ? уравнение реакции
- Магний, уравнение реакции его горения
- Физические свойства магния
- Химические свойства магния
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Источник
Реакция магния с водой
Реакция взаимодействия магния с водой.
Уравнение реакции взаимодействия магния с водой:
Реакция магния с водой протекает при обычных условиях.
Для проведения реакции используется горячая вода . В иных случаях реакция протекает медленно.
В результате реакции магния с водой образуются гидроксид магния и водород .
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 481)
- Экономика Второй индустриализации России (102 474)
- Программа искусственного интеллекта ЭЛИС (27 488)
- Метан, получение, свойства, химические реакции (23 725)
- Этилен (этен), получение, свойства, химические реакции (22 777)
- Природный газ, свойства, химический состав, добыча и применение (21 158)
- Крахмал, свойства, получение и применение (20 568)
- Целлюлоза, свойства, получение и применение (19 411)
- Пропилен (пропен), получение, свойства, химические реакции (19 080)
- Прямоугольный треугольник, свойства, признаки и формулы (18 724)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Mg + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме Mg + H2O = ? Охарактеризуйте полученное нерастворимое в воде соединение: приведите его основные физические и химические свойства. Каким образом, кроме вышеуказанного, его можно получить в лаборатории?
В результате взаимодействия магния с водой (Mg + H2O = ?) происходит образование гидроксида магния и выделение газа водорода. Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы магния и водород изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Гидроксид магния представляет собой вещество белого цвета, кристаллы которого при нагревании разлагаются. Не растворяется в воде. Проявляет основные свойства, реагирует с кислотами, кислотными оксидами. В жестких условиях образует гидроксокомплексы. Поглощает углекислый газ из воздуха. Переводится в раствор солями аммония.
Кроме вышеописанного способа гидроксид магния получают растворением металла в воде:
а также по любой реакции, удовлетворяющей сокращенному-ионному уравнению
Источник
Магний, уравнение реакции его горения
Какие химические процессы протекают при горении магния
Из этой статьи вы узнаете, что такое магний, и увидите настоящее химическое чудо — горение магния в воде!
В XVII веке в английском городке Эпсом из минерального источника было выделено горьковатое вещество, которое обладало слабительным действием. Этим веществом оказался кристаллогидрат сульфата магния или MgSO₄∙7H₂O. Из-за специфического вкуса аптекари окрестили это соединение «горькой солью». В 1808 году английский химик Гемфри Дэви с помощью магнезии и ртути получил амальгаму двенадцатого элемента. Одиннадцать лет спустя французский химик Антуан Бюсси получил рассматриваемое вещество с помощью хлорида магния и калия, восстановив магний.
Магний — один из самых распространенных элементов в земной коре. Больше всего соединений магния находится в морской воде. Этот элемент играет важную роль в жизни человека, животных и растений.
Как металл, магний не используют в чистом виде — только в сплавах (например, с титаном). Магний позволяет создавать сверхлегкие сплавы.
Физические свойства магния
Магний представляет собой легкий и пластичный металл серебристо-светлого цвета c характерным металлическим блеском.
Магний окисляется воздухом, на его поверхности образуется достаточно прочная пленка MgO, которая защищает металл от коррозии.
Температура плавления серебристого метала составляет 650 °C, а кипения — 1091 °C.
Химические свойства магния
Этот металл покрыт защитной оксидной пленкой. Если ее разрушить, магний быстро окислится на воздухе. Под температурным воздействием металл активно взаимодействует с галогенами и многими неметаллами. Магний реагирует с горячей водой, образуя гидроксид магния в виде осадка:
Mg + 2H₂O = Mg(OH)₂ + H₂
Если на газовой горелке в специальной химической ложке поджечь порошок магния, а затем опустить его в воду, порошок начнет гореть интенсивнее.
Вот как это происходит:
Из-за интенсивно-выделяющегося водорода горение будет сопровождаться ослепительными вспышками. При этом образуется оксид магния, а затем его гидроксид.
Магний относится к активным металлам, а потому бурно взаимодействует с кислотами. Однако это происходит не так бурно, как в случае с щелочным металлом калием, то есть реакция проходит без воспламенения. Зато с характерным шипением активно выделяются пузырьки водорода. И хотя пузырьки водорода поднимают металл, он не настолько легкий, чтобы оставаться на плаву.
Уравнение реакции магния и соляной кислоты:
Mg + 2HCl = MgCl₂ +H₂
При температуре выше 600 °C магний воспламеняется на воздухе, испуская при этом крайне яркий свет практически во всем спектре, подобно Солнцу.
Внимание! Не пытайтесь повторить эти опыты самостоятельно!
Такая ослепительная вспышка может травмировать глаза: можно получить ожог сетчатки, а в худшем случае — потерять зрение. Поэтому подобный опыт относится не только к самым красивым, но и к самым опасным. Не рекомендуется проводить этот опыт без специальных защитных темных очков. Здесь вы найдте эксперимент с горением магния, который можно безопасно проводить дома.
В процессе реакции образуются белый порошок оксида магния (его еще называют магнезией), а также нитрид магния. Уравнения горения:
Магний продолжает гореть как в воде, так и в атмосфере углекислого газа, поэтому потушить такой огонь довольно сложно. Тушение водой только усугубляет ситуацию, так как начинает выделяться водород, который также воспламеняется.
12-й элемент очень похож на щелочной металл литий. Например, он также взаимодействует с азотом, образуя нитрид:
Также, подобно литию, нитрид магния можно легко разложить с помощью воды:
Источник