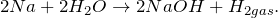- Натрий: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Натрий
- Эксперимент «Натрий на воде»
- Меры предосторожности
- Реагенты и оборудование:
- Пошаговая инструкция
- Пояснение процессов
- Уравнение реакции натрия с водой
- Секреты реакции металлического натрия с водой
- Свойства натрия
- Исследования реакции учеными из Чехии
- Как провести эксперимент
- Это опасно
- Свойства металлического натрия: Видео
Натрий: способы получения и химические свойства
Натрий — это щелочной металл, серебристо-белого цвета. Легкий, очень мягкий, низкая температура плавления.
Относительная молекулярная масса Mr = 22,990; относительная плотность по твердому состоянию d = 0,968; относительная плотность по жидкому состоянию d = 0, 27; tпл = 97,83º C; tкип = 886º C.
Способ получения
1. Натрий получают в промышленности электролизом расплава гидроксида натрия, в результате образуется натрий, кислород и вода:
4NaOH → 4Na + O2↑ + 2H2O
Качественная реакция
Качественная реакция на натрий — окрашивание пламени солями натрия в желтый цвет .
Химические свойства
Натрий — активный металл; на воздухе реагирует с кислородом и покрывается оксидной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Натрий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Натрий легко реагирует с галогенами с образованием галогенидов:
2Na + I2 = 2NaI
1.2. Натрий реагирует с серой с образованием сульфида натрия:
2Na + S = Na2S
1.3. Натрий активно реагирует с фосфором и водородом . При этом образуются бинарные соединения — фосфид натрия и гидрид натрия:
3Na + P = Na3P
2Na + H2 = 2NaH
1.4. С азотом натрий реагирует при температуре 100º С и электрическом разряде с образованием нитрида:
1.5. Натрий реагирует с углеродом с образованием карбида:
1.6. При взаимодействии с кислородом при температуре 250–400º C натрий образует пероксид натрия:
2. Натрий активно взаимодействует со сложными веществами:
2.1. Натрий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и водорода:
2Na 0 + 2 H2 O = 2 Na + OH + H2 0
2.2. Натрий взаимодействует с кислотами . При этом образуются соль и водород.
Например , натрий реагирует с разбавленной соляной кислотой :
2Na + 2HCl = 2NaCl + H2 ↑
2.3. Натрий может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Н атрий может взаимодействовать с гидроксидами:
Например , натрий взаимодействует с гидроксидом натрия при температуре 600º С:
2Na + 2NaOH = 2Na2O + H2
Источник
Натрий
Натрий — элемент 3-го периода и IA-группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s 1 , степени окисления +1 и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе — пятый по химической распространенности элемент (второй среди
металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет (качественное обнаружение).
Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °С), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + CI2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо-эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2^ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот НС1 и H2SO4 вытесняет водород (за счет Н20 и Н ).
Получение натрия в промышленности:
(см. также ниже получение NaOH).
Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный — используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия Na2O. Основный оксид. Белый, имеет ионное строение (Na + )2O 2- . Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:
Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2:
2Na + 2NaOH = 2NaаO + H2 (600 °C)
2Na + Na2O2 = 2NaаO (130-200 °C)
Пероксид натрия Na2O2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na + )2O2 2- . При нагревании разлагается, плавится под избыточным давлением О2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение О2 при кипячении — качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СО2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na + )(OH — ). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCО3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо-эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
Раствор NaOH разъедает стекло (образуется NaSiО3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2).
Получение NaOH в промышленности:
а) электролиз раствора NaCl на инертном катоде
б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):
(освобождающуюся ртуть возвращают в электролизер).
Едкий натр — важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
Источник
Эксперимент «Натрий на воде»
Почему металл не тонет, а бегает по воде?
Можно ли заставить металл бегать по воде? Давайте проверим!
Меры предосторожности
Проводите опыт в защитных перчатках, очках и маске. Соблюдайте технику безопасности при работе с огнем и горючими предметами, а также активными металлами (литий, натрий, калий, рубидий, цезий).
Внимание! Не проводите этот опыт самостоятельно — только в присутствии профессионала!
Реагенты и оборудование:
- металлический натрий;
- 1%-й р-р фенолфталеина;
- 1%-й р-р индигокармина;
- 1%-й р-р тимолового синего;
- вода;
- кристаллизатор (3 шт.).
Пошаговая инструкция
В кристаллизаторы наливаем воду и добавляем растворы индикаторов: в первый кристаллизатор капаем фенолфталеин, во второй — индигокармин, а в третий — тимоловый синий. Добавляем по кусочку металлического натрия. Наблюдаем изменение окраски во всех трех кристаллизаторах.
Пояснение процессов
Натрий — очень активный металл, он способен вытеснять водород из воды. Реакция натрия и воды нередко сопровождается взрывом. Если маленький кусочек натрия бросить в кристаллизатор с водой и кислотно-основным индикатором, натрий будет быстро бегать по поверхности жидкости. При этом он будет плавиться, превращаясь в красивую «бусину», которая может даже загореться!
Почему натрий бегает
При взаимодействии с водой выделяется водород, который подталкивает натрий к «бегству».
Почему натрий плавится и загорается
Реакция натрия с водой сопровождается выделением огромного количества тепла — из-за этого металл плавится. Этой энергии реакции достаточно, чтобы поджечь выделяющейся водород!
Почему изменяется цвет растворов
Фенолфталеин, индигокармин и тимоловый синий являются кислотно-основными индикаторами, то есть веществами, которые изменяют свой цвет в зависимости от водородного показателя среды. При взаимодействии натрия с водой образуется гидроксид натрия, который является очень сильным основанием — так среда становится щелочной. Фенолфталеин меняет цвет от бесцветного к малиновому, индигокармин — от синего к зеленому, а тимоловый синий — от желтого к синему.
Источник
Уравнение реакции натрия с водой
Запишите уравнение реакции натрия с водой; дайте название продукту взаимодействия. Какую химическую связь называют ковалентной. Расскажите о процессе образования ковалентной связи с позиции метода валентных связей
Уравнение реакции натрия с водой, в результате которой образуется гидроксид натрия и выделяется водород, имеет вид:
Для описания ковалентной связи существуют два основных метода: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО). Согласно первому из них связь осуществляется за счет пары электронов, находящихся на орбитали, образовавшейся за счет перекрывания двух атомных орбиталей.
Суть метода ММО заключается в следующем: в молекуле образуется собственная система молекулярных орбиталей, на которых находятся все электроны данной молекулы.
МВС можно рассматривать как современное развитие теории Льюиса, в соответствии с которой два атома совместно владеют одной или несколькими парами электронов. Известны два механизма образования такой связи: либо оба атома предоставляют в общее пользование по одному электрону, либо один атом (донор) предоставляет пару электронов, а другой (акцептор) — пустую орбиталь (донорно-акцепторный механизм). Результат один и тот же: две орбитали перекрываются, и на них находятся два электрона. Например, в ионе аммония три связи Н-N образованы перекрыванием одноэлектронных облаков, а четвертая — по донорно-акцепторному механизму. В результате все четыре связи неразличимы и равноценны.
В МВС ковалентная связь характеризуется насыщаемостью, поляризуемостью и направленностью.
Источник
Секреты реакции металлического натрия с водой
Самой интересной на школьных уроках химии была тема о свойствах активных металлов. Нам не только подавали теоретический материал, но и демонстрировали интересные эксперименты. Наверное, все помнят, как учитель бросал в воду маленький кусочек металла, а он метался по поверхности жидкости и воспламенялся. В этой статье мы разберемся, как происходит реакция натрия и воды, почему металл взрывается.
Свойства натрия
Металлический натрий – это серебристое вещество, по плотности напоминающее мыло или парафин. Натрий характеризуется хорошей тепло- и электропроводностью. Именно поэтому его используют в промышленности, в частности для изготовления аккумуляторов.
Натрий обладает высокой химической активностью. Часто реакции проходят с выделением большого количества тепла. Иногда это сопровождается воспламенением или взрывом. Работа с активными металлами требует хорошей информационной подготовки и опыта. Хранить натрий можно только в хорошо закрытых тарах под слоем масла, так как на воздухе металл быстро окисляется.
Самой популярной реакцией натрия является его взаимодействие с водой. В ходе реакции натрий плюс вода образуется щелочь и водород:
2Na + 2H2O = 2NaOH + H2 ↑
Водород окисляется кислородом из воздуха и взрывается, что мы и наблюдали в ходе школьного эксперимента.
Исследования реакции учеными из Чехии
Реакция натрия с водой очень проста для понимания: взаимодействие веществ приводит к образованию газа H2, который, в свою очередь, окисляется с помощью О2, находящегося в воздухе, и воспламеняется. Кажется, все просто. Но профессор Павел Юнгвирт из Академии наук Чехии так не считал.
Дело в том, что в процессе реакции образуется не только водород, но и пары воды, так как выделяется большое количество энергии, вода нагревается и испаряется. Так как натрий имеет низкую плотность, паровая подушка должна выталкивать его вверх, изолируя от воды. Реакция должна затухать, но этого не происходит.
Юнгвирт решил подробно изучить этот процесс и снял эксперимент на высокоскоростную камеру. Процесс снимался со скоростью 10 тыс. кадров в секунду и просматривался с 400-кратным замедлением. Ученые заметили, что металл, попадая в жидкость, начинает выпускать отростки в виде шипов. Объясняется это следующим образом:
- Щелочные металлы, попав в воду, начинают выступать в роли донора электронов и отдают негативно заряженные частицы.
- Кусочек металла обретает положительный заряд.
- Положительно заряженные протоны начинают отталкиваться друг от друга, образуя металлический отростки.
- Отростки-шипы прокалывают паровую подушку, поверхность контакта реагирующих веществ увеличивается, и реакция усиливается.
Как провести эксперимент
Кроме водорода, в ходе реакции воды и натрия образуется щелочь. Чтобы это проверить, можно использовать любой индикатор: лакмус, фенолфталеин или метилоранж. Легче всего будет работать с фенолфталеином, так как он бесцветный в нейтральной среде и реакцию будет легче наблюдать.
Чтобы провести эксперимент нужно:
- Налить в кристаллизатор дистиллированную воду, чтобы она занимала больше половины объема посудины.
- Добавить в жидкость несколько капель индикатора.
- Отрезать кусочек натрия, размером с полгорошины. Для этого используют скальпель или тонкий нож. Резать металл нужно в таре, не винимая натрий из масла, чтобы избежать окисления.
- Достать кусочек натрия из банки пинцетом и промокнуть фильтровальной бумагой, чтобы очистить от масла.
- Бросить натрий в воду и наблюдать за процессом с безопасного расстояния.
Все инструменты, используемые в эксперименте, должны быть чистыми и сухими.
Вы увидите, что натрий не погружается в воду, а остается на поверхности, что объясняется плотностью веществ. Натрий начнет реагировать с водой, выделяя тепло. От этого металл расплавится и превратится в капельку. Эта капелька начнет активно двигаться по воде, издавая характерное шипение. Если кусочек натрия был не слишком маленьким, он загорится желтым пламенем. Если кусочек был слишком большим, может произойти взрыв.
Также вода поменяет свой цвет. Это объясняется выделением щелочи в воду и окрашиванием растворенного в ней индикатора. Фенолфталеин станет розовым, лакмус синим, а метилоранж – желтым.
Это опасно
Взаимодействие натрия с водой очень опасно. В ходе эксперимента можно получить серьезные травмы. Гидроксид, пероксид и оксид натрия, которые образуются в ходе реакции, могут разъедать кожу. Щелочь, разбрызгиваясь, может попасть в глаза и привести к серьезным ожогам и даже слепоте.
Поэтому мы не рекомендуем вам самостоятельно проводить исследование.
Манипуляции с активными металлами должны проводиться в химических лабораториях под наблюдением лаборанта, который имеет опыт работы с щелочными металлами.
Также нужно придерживаться следующих рекомендаций:
- Работать исключительно в защитных очках.
- Ни в коем случае не наклоняться над посудиной, когда металл находится на воде.
- Отходить от кристаллизатора на несколько метров сразу после того, как металл будет брошен в воду.
- Быть всегда наготове, так как взрыв может произойти в любой момент.
- Не подходить к катализатору, пока не убедитесь, что реакция закончилась.
Свойства металлического натрия: Видео
Источник