Неорганические вещества вода соли конспект кратко
ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Тема 1. Неорганические вещества
Неорганические вещества: вода и минеральные соли
Молекула воды (Н20) полярная. Ее разные полюса имеют частично положительные и отрицательные заряды. В целом электронейтральная молекула воды.
Соседние молекулы воды могут притягиваться друг к другу за счет сил электростатического взаимодействия между отрицательным зарядом на атоме Кислорода одной молекулы и положительным зарядом на атоме Водорода другой. Такой тип связи называется водородным. Водородная связь обусловливает относительно высокие температуры кипения, плавления и испарения.
1. Вода — универсальный растворитель. По растворимостью в воде вещества делятся на гидрофильные (хорошо растворимые) и гидрофобные (нерастворимые)
2. Вода определяет некоторые физические свойства клеток — их объем, внутреннее давление (тургор)
Вода — среда для физиологических и биологических процессов. Расщепление многих веществ происходит за счет их взаимодействия с водой, катализируемая ферментами. Такие реакции называются реакциями гидролиза
Вода — терморегулятор. Она имеет большую теплоемкость, то есть способна поглощать тепло без значительных изменений своей температуры
Вода — основная среда передвижения веществ в организме и клетке
К неорганическим веществам клетки относятся минеральные соединения — соли Натрия, Калия, Кальция и др. В организме соли находятся или в ионном состоянии, или в виде твердых соединений.
Источник
Неорганические вещества клетки. Вода, соли, их роль в жизнедеятельности клетки.
Большинство химических соединений, которые входят в состав клетки, встречаются только в живой природе. Почти все молекулы за небольшим исключением, встречающиеся в клетке, относятся к соединениям углерода и рассматриваются в курсе органической химии. Однако вода встречается и в живой, и в неживой природе. В среднем почти 70% от массы живых организмов составляет вода. Но содержание воды в клетке может колебаться в зависимости, например, от ее конкретного вида или возраста. Помимо воды в клетках в значительных количествах встречаются некоторые соли, которые важны для осуществления функций живых организмов.
Вода (H2O) представляет собой вещество, которое в физическом и химическом отношении существенно отличается от других растворителей. Жизнь возникла в первичном океане, и в процессе дальнейшего развития природа использовала уникальные свойства воды.
У воды в отличии от других жидкостей необычайно высокие температуры кипения и плавления и высокая удельная теплоемкость. Также отличительными особенностями воды являются большая удельная теплота испарения, плавления и высокое поверхностное натяжение. Вода имеет все эти свойства благодаря тому, что ее молекулы более прочно связаны друг с другом в отличии от молекул других растворителей.
Эти уникальные свойства воды оказывают большое влияние на жизнедеятельность клеток. Например, высокая теплоемкость воды, т.е. способность поглощать тепло при незначительном изменении своей собственной температуры, предохраняет клетки от резких изменений температуры. Высокую теплоту испарения воды живые организмы используют для предохранения от перегрева. Вспомним, что испарение жидкости животными и растениями — это защитная реакция на повышение температуры. Благодаря высокой теплопроводности воды обеспечивается равномерное распределение теплоты по всему организму, а благодаря тому, что вода плохо сжимается, клетки обладают упругостью и могут поддерживать свою форму.
Свои уникальные физические и химические свойства вода получила благодаря особенностям структуры своей молекулы, а точнее, благодаря тому, как именно в молекуле воды располагаются электроны в атомах кислорода и водорода. Два электрона, располагающиеся на внешней электронной орбите атома кислорода в молекуле воды, объединяются с двумя электронами, принадлежащими атомам водорода (у атома водорода на внешней орбите только один электрон). Благодаря этому в молекуле воды образуются две ковалентные связи (между атомом кислорода и двумя атомами водорода). Электроотрицательность * атома кислорода выше, чем у атомов водорода, благодаря чему, электроны притягиваются к нему сильнее. В результате этого на атоме кислорода появляется частично отрицательный заряд, а на атомах водорода — частично положительный. Между более отрицательно заряженными атомами кислорода одних молекул воды и более положительно заряженными атомами водорода других молекул воды образуются так называемые водородные связи, и молекулы воды оказываются связанными между собой.
* Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Относится к фунадментальным свойствам атома и выражается в количественных характеристиках.
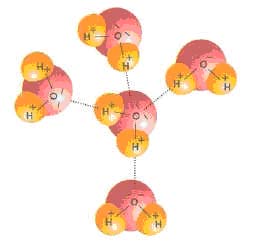
5 молекул воды с водородными связями между ними
На рисунке изображены молекулы воды. Ковалентные связи связывают атомы кислорода и водорода внутри каждой молекулы (сплошные линии), а водородные связи образуются между соседними молекулами (пунктирные линии).
Водородные связи примерно в 20 раз более слабые, чем ковалентные. Поэтому они легко образуются и разрываются. Даже при температуре кипения (100°С) взамодействие между молекулами воды остается достаточно сильным. Именно водородные связи обеспечивают структурированность воды и объясняют такие ее свойства, как высокие температуры кипения и плавления, а также высокую теплоемкость.
Другое важное свойство молекулы воды — ее дипольность. В молекуле воды, как отмечалось ранее, атомы кислорода имеют небольшой отрицательный заряд, а атомы водорода — положительный. Т.к. угол между связями H-O-H составляет 104.5°, получается, что отрицательный заряд в молекуле воды сосредотачивается на одной стороне, а положительный — на другой. Благодаря дипольности молекулы воды имеют способность к ориентации в электрическом поле. Это свойство объясняет, что вода является уникальным растворителем. Если в молекулах веществ присутствуют заряженные группы атомов, они, вступая в электростатическое взаимодействие с молекулами воды, растворяются в ней. Такие вещества с заряженными или полярными группами, растворяющиеся в воде, называются гидрофильными.
Растворение NaCl в воде.
Способность воды растворять кристалл NaCl зависит от электростатического притяжения между полярными молекулами воды и заряженными ионами натрия и хлора.
К гидрофильным соединениям, которые в большом количестве есть в клетках, относятся соли, некоторые низкомолекулярные органические соединения (органические кислоты, аминокислоты, простые сахара), а также полимеры: некоторые полисахариды, белки, нуклеиновые кислоты. Однако существует ряд веществ, почти не имеющих заряженных атомов, и, поэтому, не растворяющихся в воде. Такие вещества называются гидрофобными. К ним, например, относятся липиды (жиры). Гидрофобные вещества не взаимодействуют с водой, но могут взаимодействовать друг с другом. Поэтому они хорошо растворяются в некоторых органических растворителях, как, например, хлороформ. Липиды, относящиеся к гидрофобным соединениям, формируют двумерные структуры (биологические мембраны), практически непроницаемые для воды.
По сравнению с другими растворителями вода может растворить больше химических веществ, благодаря своей полярности. Жизнедеятельность клетки невозможна без многочисленных химических реакций, которые осуществляются в ее водной среде, где растворены различные химические вещества. Также вода растворяет и продукты реакций. Затем в растворенном виде они выводятся из клеток и многоклеточных организмов. За счет перемещения воды в организмах животных и растений осуществляется обмен различными веществами между тканями. Еще одним важным свойством воды является то, что, как химическое соединение, вода вступает во многие химические реакции, которые протекают в клетке. Такие реакции называют реакциями гидролиза. В свою очередь, молекулы воды сами образуются в результате многих реакций в клетках живых организмов.
Т.к. масса атома водорода мала, а атом кислорода в молекуле воды удерживает его единственный электрон, протон (ядро атома водорода, лишенное электрона) способен отрываться от молекулы воды. В результате этого из молекулы воды образуются гидроксильный ион (ОН — ) и протон (Н + ).
H2O H + + OH —
Данный процесс называют диссоциацией воды. Гидроксильные ионы и протоны, которые образуются при диссоциации воды, являются, в свою очередь, участниками многих важных реакций в живых организмах.
В жизнедеятельности клетки также очень важны соли, растворенные в воде. Главным образом соли представлены катионами калия (К + ), натрия (Na + ), магния (Mg 2+ ), кальция (Ca 2+ ) и других металлов, а также анионами соляной (Cl — ), угольной (НСО3 — ) и фосфорных кислот (Н2РО4 — , НРО4 2- ).
Многие катионы характеризуются неравномерным распределением между клеткой и окружающей ее средой. Например, для цитоплазмы характерна более высокая концентрация К + , чем для окружающей клетку среды, между тем, в той же цитоплазме концентрация Na + и Са 2+ будет ниже, чем снаружи клетки. В качестве внешней среды по по отношению к клетке может выступать не только природная среда, например, океан, но и жидкости внутри живого организма, такие как кровь или тканевая жидкость, близкие по своему ионному составу к морской воде. В процессе жизнедеятельности неравномерное распределение катионов между клетками и окружающей их средой постоянно поддерживается, на это затрачивается значительная часть энергии в клетках. Такая неравномерная концентрация ионов между клетками и окружающей их средой необходима для многих процессов жизнедеятельности, к примеру, для передачи возбуждения по нервным и мышечным клеткам или сокращения мышц. Когда клетка умирает, концентрация катионов внутри нее и снаружи быстро становится одинаковой.
Кислотность цитоплазмы клетки в процессе жизнедеятельности практически нейтральная (т.е. значение концентрации ионов водорода (рН) в цитоплазме находится в диапазоне 6,5-7,5). Это происходит несмотря на то, что в процессе жизнедеятельности в клетке образуются и щелочи, и кислоты. Важную роль в поддержании нейтральной кислотности играют анионы слабых кислот (НСО3 — , НРО4 2- ), содержащиеся в клетке. Анионы слабых кислот нейтрализуют внутриклеточную среду, связывая протоны кислот и гидроксильные ионы щелочей.
Необходимо отметить, что анионы слабых кислот вступают в химические реакции, происходящие в клетке. Например, для синтеза АТФ, одного из важных соединений для клетки, необходимы анионы фосфорной кислоты. О синтезе АТФ я расскажу более подробно позднее. Неорганические вещества в живых организмах содержатся не только в растворенном, но и в твердом состоянии. В качестве примера можно привести кости, где преобладает фосфат кальция и в меньшем количестве фосфат магния. В раковинах моллюсков преобладает карбонат кальция.
Источник
Неорганические и органические вещества клетки
Задумайтесь! Мы с вами состоит из миллиардов атомов. Все атомы находятся в круговороте, и все атомы, которыми мы обладаем, в ком-то и где-то находились те 4,5 млрд. лет, которые существует Земля. Они были частями животных, растений, грибов и бактерий — а сейчас принадлежат нам на короткое время.
С химической точки зрения ответ на вопрос «Жив ли изучаемый объект?» — не представляется возможным. Понятию «жизнь» дано колоссальное количество определений. Жизнь — это самовоспроизведение с изменением, способ существования белковых тел, постоянный обмен веществ с внешней средой.
Мы приступаем к изучению неорганических и органических веществ клетки. Начнем с неотъемлемого компонента клетки, благодаря которому жизнь на Земле в принципе стала возможна — вода.
Составляет 60-80% массы клетки. Молекула воды обладает уникальным свойством — полярностью, которое возникает из-за разницы в электроотрицательности (ЭО) между атомами кислорода и водорода (у кислорода ЭО больше).
Поскольку молекула воды полярна, ее называют диполь. Между молекулами воды возникают непрочные водородные связи: водородная связь начинается от отрицательно заряженного атома кислорода (2δ — ) одной молекулы воды и тянется до положительно заряженного атома водорода другой молекулы воды (δ + )
По отношению к воде все вещества можно подразделить на два типа:
- Гидрофильные (греч. hydro — вода и philéo — люблю) — вещества, которые хорошо растворяются в воде. Гидрофильными веществами являются сахара, соли, альдегиды, спирты, аминокислоты.
- Гидрофобные (греч. hydro — вода и phobos — страх) — вещества, которые не растворяются в воде. Гидрофобными веществами являются жиры.
Роль воды в клетке трудно переоценить. Ее функции и свойства крайне важны:
- Вода — универсальный растворитель
Большинство реакций, которые протекают в клетке, идут в растворе (водной среде). Полярность молекулы воды позволяет ей быть отличным растворителем для других гидрофильных (полярных) веществ.
Вода может поглощать теплоту при минимальном изменении температуры. Это настоящее «спасение» для клеток: чуть только температура меняется, вода начинает поглощать избыток тепла, защищая клетку от перегревания. Выделяясь на поверхность кожи с потом, вода испаряется, поверхность кожи при этом охлаждается.
Она не только создает среду для реакций в клетке, но и сама активно участвует во многих из них. Расщепление питательных веществ, попавших в клетку, происходит за счет реакции гидролиза (греч. hydro — вода и lysis — расщепление).
Питательные вещества, газы перемещаются по организму с током крови. Вода составляет 90-92% плазмы крови, является ее основным компонентом. С помощью воды происходит не только доставка веществ к клеткам, но и удаление из организма побочных продуктов обмена веществ.
Вода придает тканям тургор (лат. turgor — наполнение) — внутреннее осмотическое давление в живой клетке, создающее напряжение оболочек клеток. Вода составляет от 60 до 95% цитоплазмы, придает клеткам форму. Изменение тургора клеток растений приводит к перемещениям их частей, раскрытию устьиц, цветков.
Осмотическое давление — избыточное гидростатическое давление на раствор, отделенный от чистого растворителя с помощью полупроницаемой мембраны.
Главное — понимать суть: если мы поместим живую клетку в гипертонический раствор, то вода (растворитель) устремится из клетки в раствор (в сторону большей концентрации соли) — это приведет к сморщиванию клеток.
Если же клетка окажется в гипотоническом растворе, то вода извне устремится внутрь клетки (опять-таки в сторону большей концентрации солей), приводя при этом к разбуханию (и возможному разрыву) клетки.
Элементы
Живая клетка — кладезь элементов таблицы Менделеева. Процент содержания различных элементов отличается, в связи с чем все они делятся на 3 группы:
- Биогенные (основные) — C, H, O, N. Входят в состав органических соединений, составляют основную часть клетки
- Макроэлементы (греч. makrós — большой) — составляют десятые и сотые доли в клетке: K, Na, Ca, Mg, Cl, P, S
- Микроэлементы (греч. mikrós — маленький) — составляют тысячные доли в клетке: Zn, Cu, I, Co, Mn, Fe
Процентное содержание элемента не коррелирует с его важностью и биологической значимостью. Так, к примеру, микроэлемент I играет важную роль в синтезе гормонов щитовидной железы: тироксина, трийодтиронина. За нормальные рост и развитие организмов отвечают Zn, Mn, Cu.
Благоприятно влияют на сперматозоиды Zn, Ca, Mg, защищая их от оксидативного стресса (окисления). Невозможным становится нормальное образование эритроцитов без должного уровня Fe и Cu.
В водной среде клетки соли диссоциируют (распадаются) на положительно заряженные ионы — катионы (Na + , K + , Ca 2+ , Mg 2+ ) и отрицательно заряженные — анионы (Cl — , SO4 2- , HPO4 2- , H2PO4 — ).
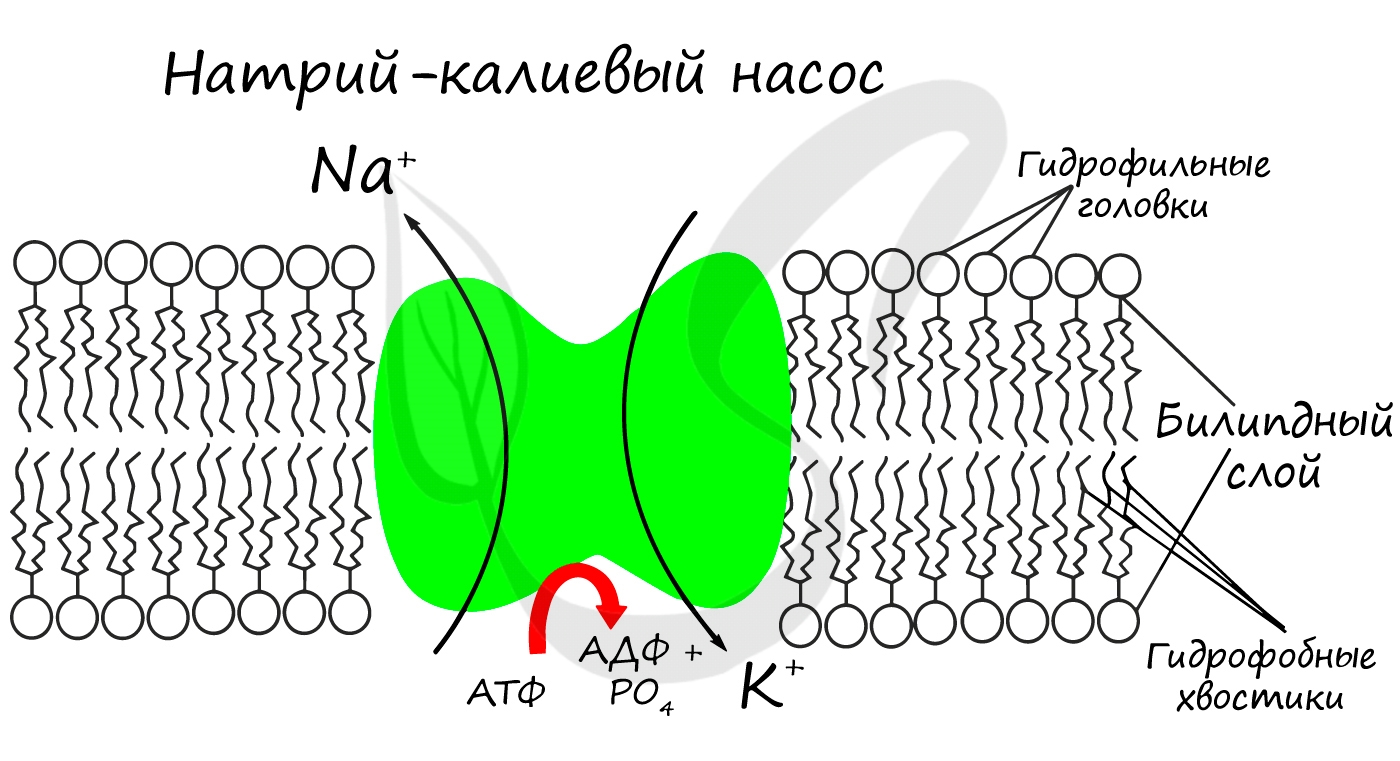
Для процессов возбуждения клетки (нейрона, миоцита — мышечной клетки) внутри клетки должна поддерживаться низкая концентрация ионов Na + и высокая концентрация ионов K + . В окружающей клетку среде все наоборот: много Na и мало K. В мембране существует специальный натрий-калиевый насос, который поддерживает необходимое равновесие. Если это соотношение нарушится, то нейрон не сможет сгенерировать нервный импульс, а клетка мышцы — сократиться.
Соли в клетке и организме выполняют ряд важных функций:
- Участвуют в активации ферментов
- Создают буферные системы (бикарбонтаную, фосфатную, белковую)
- Поддерживают кислотно-щелочное состояние (КЩС)
- Создают осмотическое давление клетки
- Создают мембранный потенциал клеток (натрий-калиевый насос)
- Являются основным минеральным составляющим скелета внутреннего и наружного (у моллюсков)
Мы переходим к органическим компонентам клетки, к которым относятся: жиры, углеводы, белки и нуклеиновые кислоты.
Белки, или пептиды (греч. πεπτος — питательный)
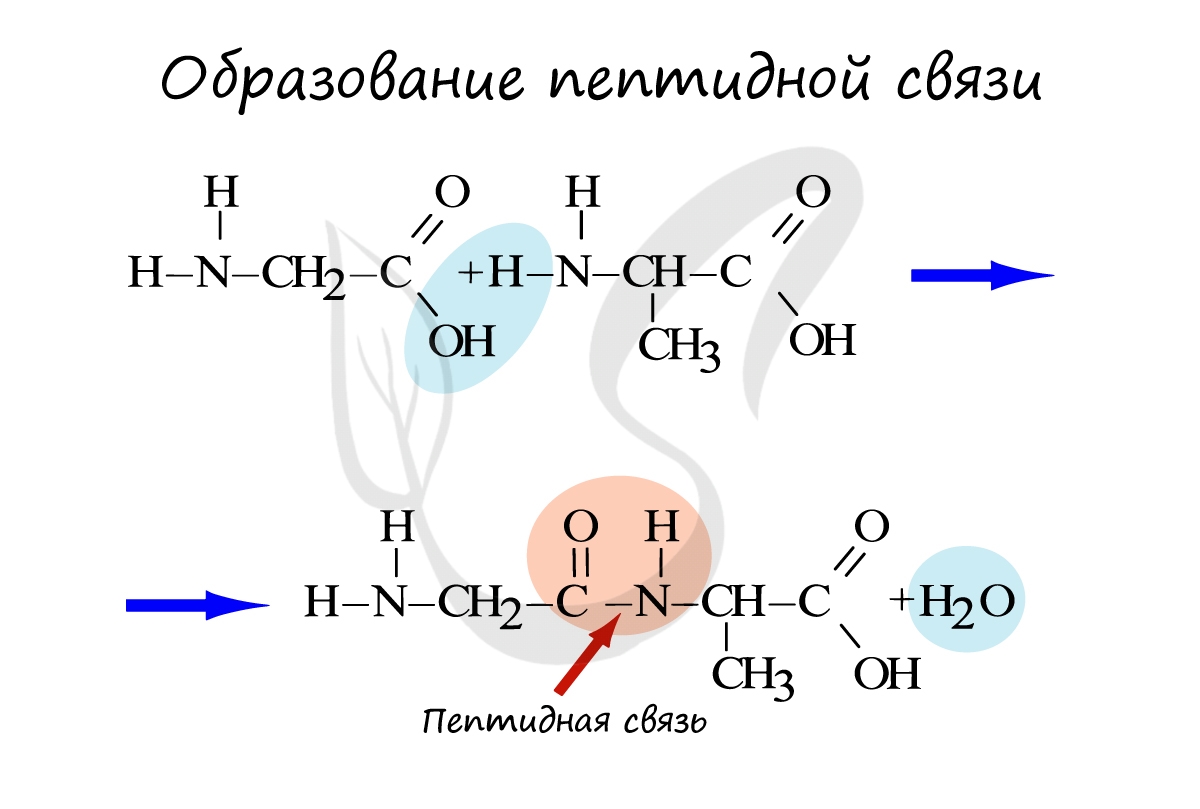
Белки — полимеры, мономерами которых являются аминокислоты. Белки представляют линейную структуру, образованную из длинной цепи аминокислот, между которыми возникают пептидные связи. Пептидная связь образуется между карбоксильной группой (COOH) одной аминокислоты и аминогруппой другой аминокислоты (NH2).
Между понятиями пептиды и белки существует определенная разница. Белки состоят из сотен тысяч аминокислот. Пептидами называют небольшие белки, содержащие до 10 аминокислот. Ими являются некоторые гормоны: окситоцин, вазопрессин, тиреолиберин — эти пептиды выполняют регуляторную функцию.
Выделяется несколько уровней пространственной организации белка:
- Первичная — полипептидная цепь, в которой аминокислоты расположены линейно
- Вторичная — полипептидная цепь закручивается в спираль, формируется α или β структура
- Третичная — спирали скручиваются в глобулу (лат. globulus — шарик)
- Четвертичная — образуется у сложных белков путем соединения нескольких глобул
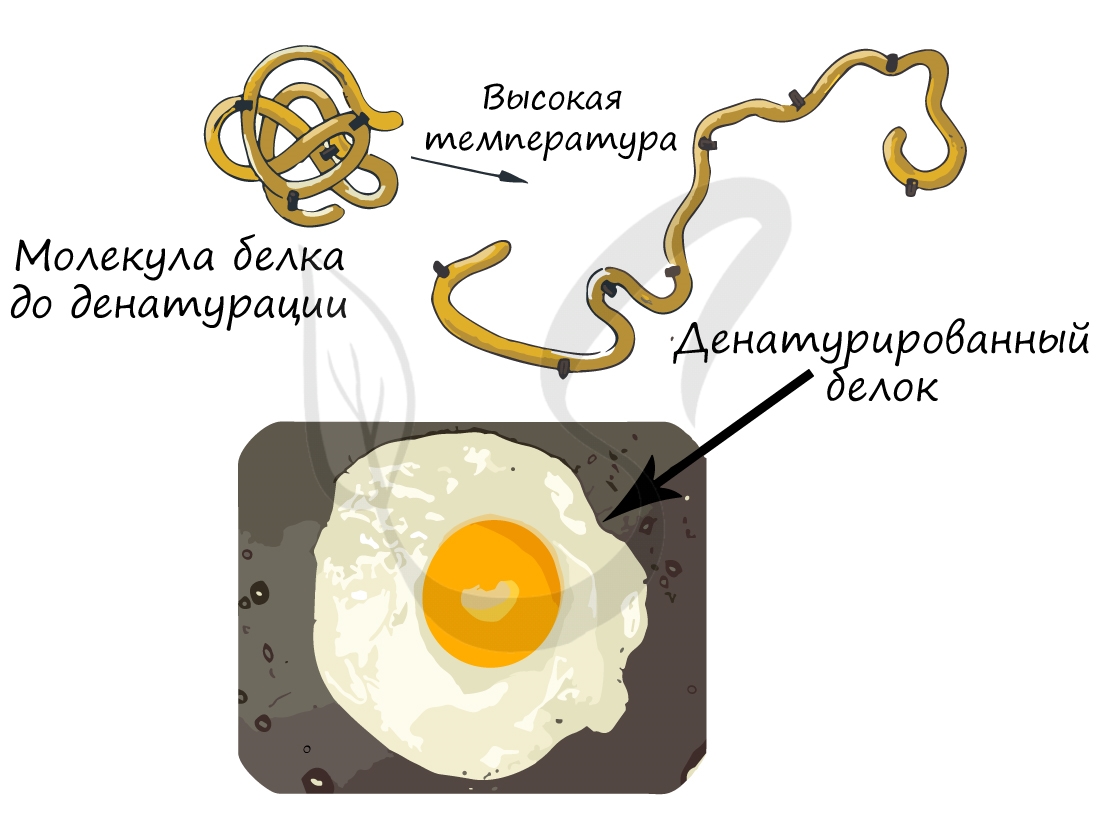
При резком изменении оптимальных для белка условий он подвергается денатурации: при этом происходит переход от высших структур организации к низшим, или «раскручивание белка». Важно заметить, что аминокислотная последовательность (первичная структура белка) при этом не меняется, однако свойства белка меняются кардинально (теряется его гидрофильность).
Осмелюсь сделать заявление: вы часто начинаете свой день с денатурации белка. Простейший способ провести такой эксперимент — пожарить яичницу. Заметьте, что изначально яичный белок прозрачный и текучий, но по итогу жарки эти свойства утрачиваются: он становится непрозрачным и вязким.
Завершаем тему о белках изучением их функций:
- Каталитическая (греч. katalysis — разрушение)
Белки — природные катализаторы, ускоряющие реакции в организме в десятки и сотни тысяч раз. Эту роль главным образом выполняют белки-ферменты (энзимы).
Иногда в состав белков входят так называемые ко-факторы — небелковые соединения, которые необходимы ферменту для его биологической активности (в роли ко-факторов могут выступать Zn 2+ , Mg 2+ ).
Белки входят в состав клеточных мембран. Сложные белки: коллаген, эластин — входят в состав соединительных тканей организма, придавая им некоторую прочность и эластичность.
Некоторые гормоны, регулирующие обменные процессы в организме, имеют белковое происхождение: инсулин, глюкагон, адренокортикотропный гормон (АКТГ).
Говоря об этой функции, прежде всего, стоит вспомнить об антителах — иммуноглобулинах, которые синтезируют B-лимфоциты. Антитела нейтрализуют чужеродные организму антигены (разрушают бактерии).
Помимо антител, защитную функцию выполняют также белки свертывающей системы крови (тромбин и фибриноген): они предохраняют организм от кровопотери.
При недостаточном питании в организме начинают окисляться молекулы белков. При расщеплении 1 г белков выделяется 17,6 кДж энергии.
Некоторые белки крови способны присоединять к себе и переносить различные молекулы. Альбумины участвуют в транспорте жирных кислот, глобулины — гормонов и некоторых ионов (Fe, Cu). Основной белок эритроцитов — гемоглобин — способен переносить кислород, углекислый и угарный газы (угарный конечно нежелательно ему переносить, будет отравление)
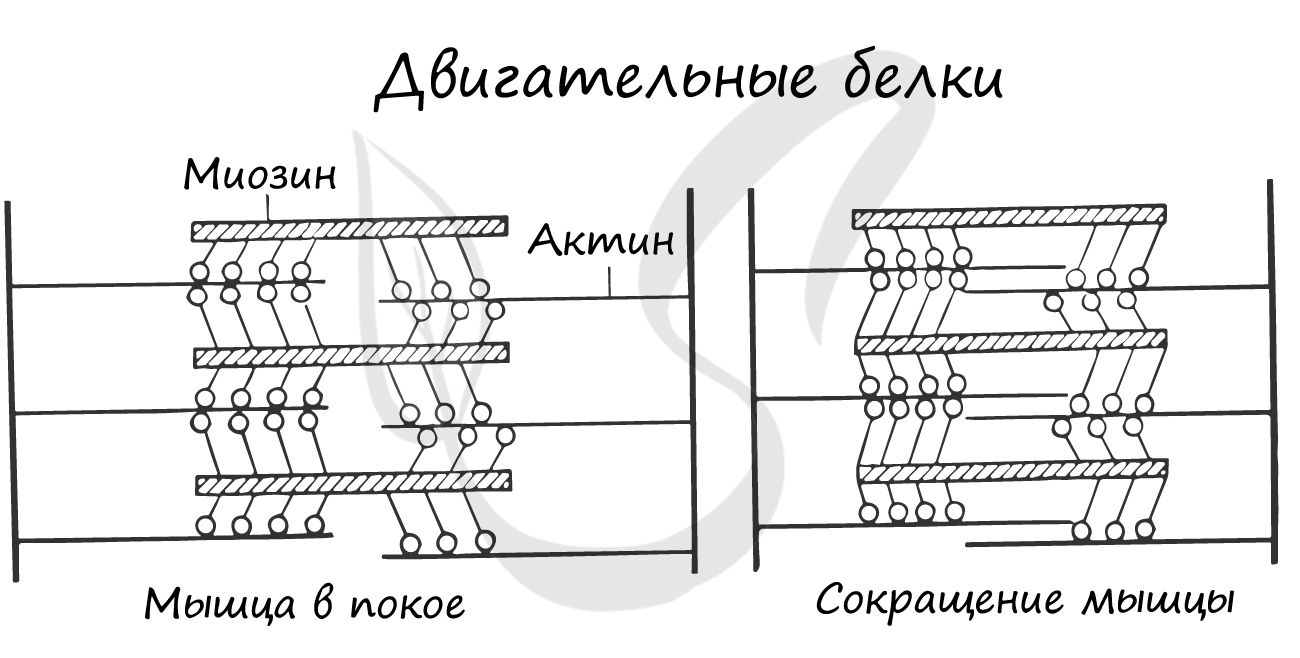
Двигательные белки, актин и миозин, на уровне саркомера обеспечивают сокращение мышц. При возбуждении мышечной ткани тонкие нити актина начинают тереться о толстые нити миозина, приводя к сокращению.
На поверхности мембраны белки образуют многочисленные рецепторы, которые, соединяясь с гормонами, приводят к изменению обмена веществ в клетке. Таким образом, гормоны реализуют воздействие на клетки органов-мишеней.
Жиры, или липиды (греч. lipos — жир)
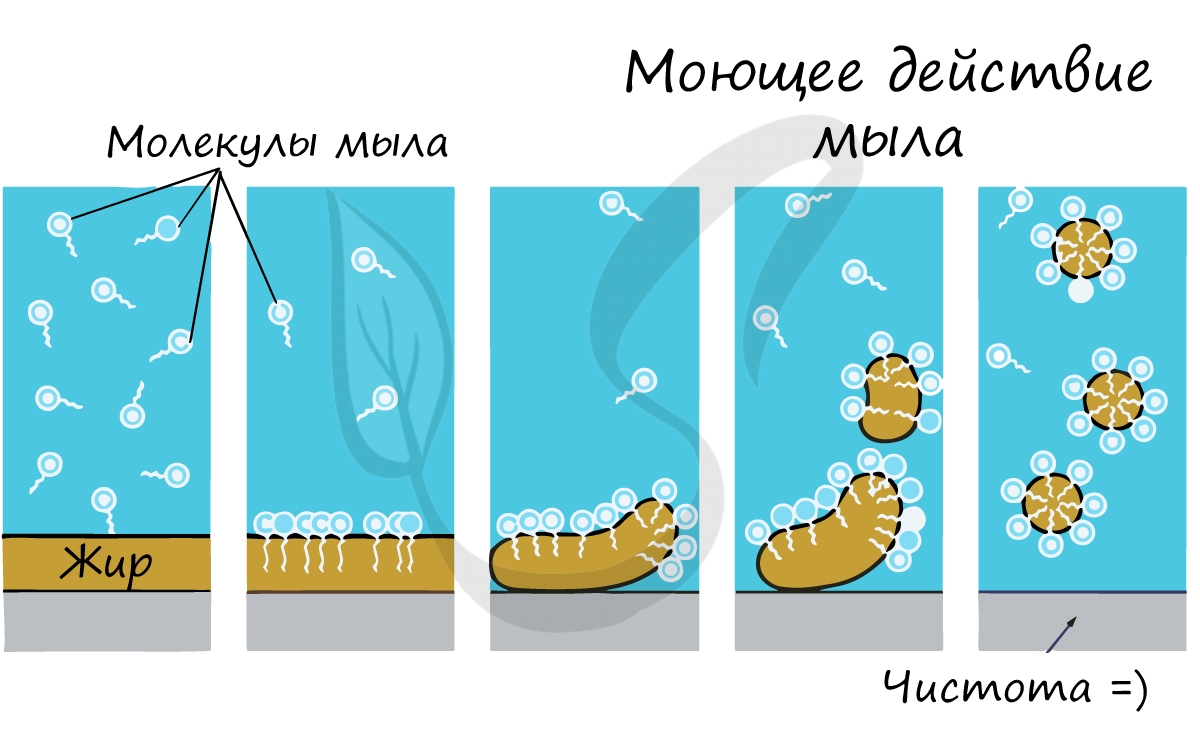
С химической точки зрения жиры являются сложными эфирами, образованными трехатомным спиртом глицерином и высшими карбоновыми кислотами (жирными кислотами). Среди их свойств надо выделить то, что они практически нерастворимы в воде. Вспомните, как тяжело смыть жир с рук водой.
Почему именно мыло смывает жир с рук? Дело в том, что молекула мыла повторяет свойства жира: одна часть ее гидрофобна, а другая гидрофильна. Мыло соединяется с молекулой жира гидрофобной частью, и вместе они легко смываются водой.
Приступим к изучению функций жиров:
- Энергетическая
При окислении жиров выделяется много энергии: 1 г — 38,9 кДж. Это вдвое больше выделяющейся энергии при расщеплении 1г углеводов.
Жиры имеют способность накапливаться в клетках, расположенных в подкожно-жировой клетчатке, внутренних органах. Эти запасы являются резервом организма на случай голодания или при недостаточном питании.
В жирах также запасается вода: в 100 г жира содержится 107 мл воды. Многим пустынным животным (верблюдам) жировые запасы помогают длительное время обходиться без воды.
Жиры входят в состав биологических мембран клеток человека вместе с белками. Из фосфолипидов построены мембраны всех клеток органов и тканей!
Так, к примеру, холестерин — обязательный компонент мембраны, придает ей определенную жесткость и совершенно необходим для нормальной жизнедеятельности (заболевания возникают только при нарушении липидного обмена).
Жиры обладают плохой теплопроводностью. Располагаясь в подкожно-жировой клетчатке, они образуют термоизолирующий слой. Особенно хорошо он развит у ластоногих (моржи и тюлени), китов, защищает их от переохлаждения.
Некоторые гормоны по строению относятся к жирам: половые (андрогены — мужские и эстрогены — женские), гормон беременности (прогестерон), кортикостероиды.
Участие в обмене веществ (метаболизме)
Производное жира — витамин D — принимает важное участие в обмене кальция и фосфора в организме. Он образуется в коже под действием ультрафиолетового излучения (солнечного света). При недостатке витамина D возникает заболевание — рахит.
Углеводы
Представляют собой органические соединения, состоящие из одной или нескольких молекул простых сахаров. Выделяется три основных класса углеводов:
- Моносахариды (греч. monos — единственный)
Простые сахара, легко растворяющиеся в воде и имеющие сладкий вкус. Моносахариды подразделяются на гексозы (имеют 6 атомов углерода) — глюкоза, фруктоза, и пентозы (имеют 5 атомов углерода) — рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот.
Олигосахариды (греч. ὀλίγος — немногий)
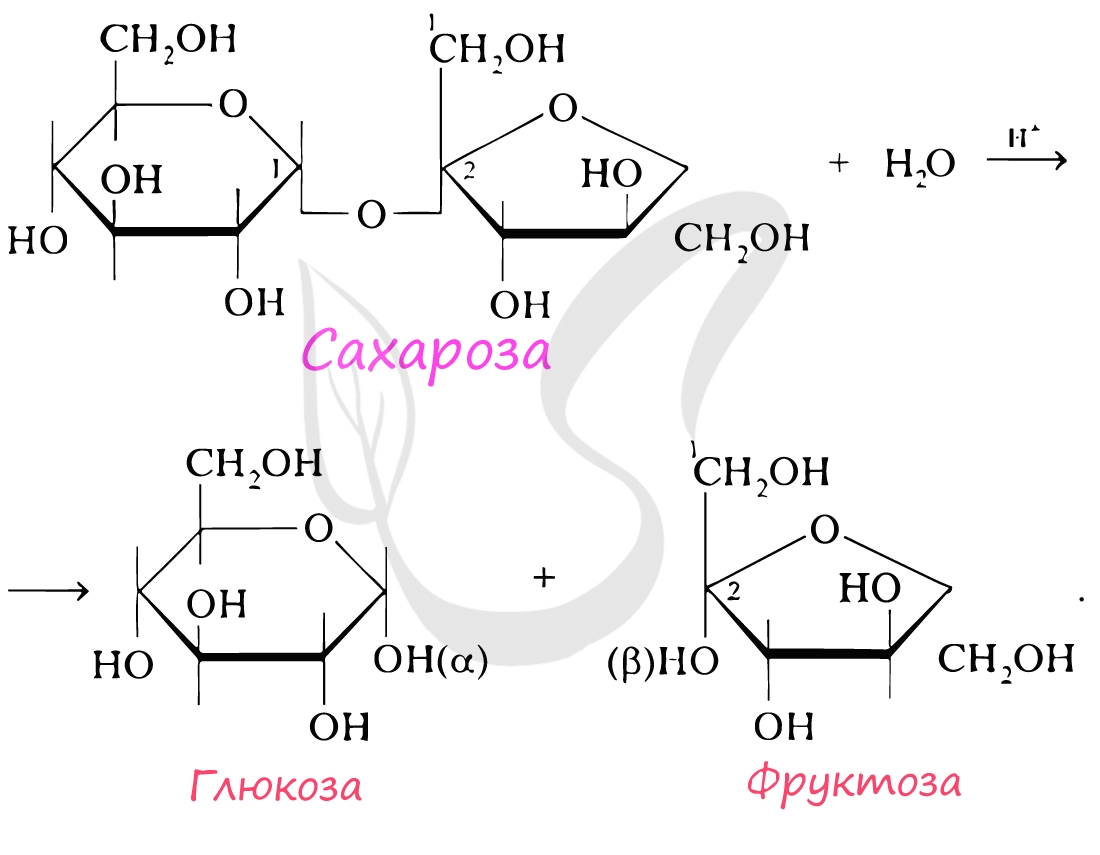
При гидролизе олигосахариды распадаются на моносахариды. В состав олигосахаридов может входить от 2 до 10 моносахаридных остатков. Если в состав олигосахарида входят 2 остатка моносахарида, то его называют дисахарид. К дисахаридам относятся сахароза, лактоза, мальтоза. При гидролизе сахароза распадается на глюкозу и фруктозу.
Это биополимеры, в состав которых входят сотни тысяч моносахаридов. Они обладают высокой молекулярной массой, нерастворимы в воде, на вкус несладкие.
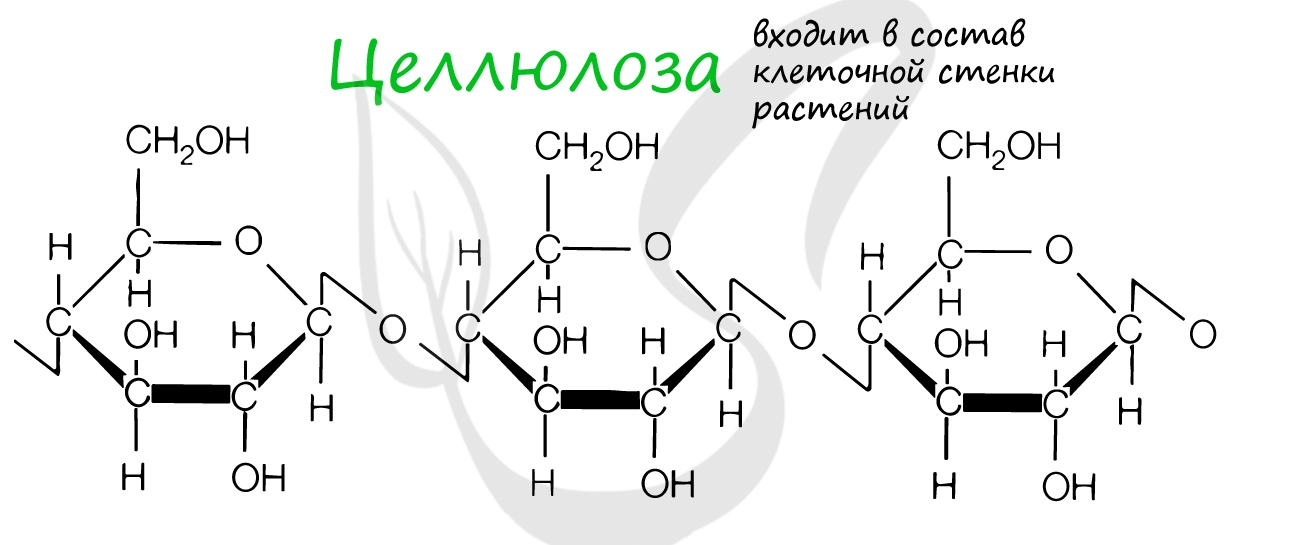
Крахмал, целлюлоза, гликоген, хитин и муреин — все это биополимеры. Давайте вспомним, где они находятся.
Клеточная стенка образована: у растений — целлюлозой, у грибов — хитином, у бактерий — муреином. Запасным питательным веществом растений является крахмал, животных — гликоген.
Перечислим функции, которые выполняют углеводы:
- Энергетическая
В результате расщепления 1 г углеводов высвобождается 17,6 кДж энергии.
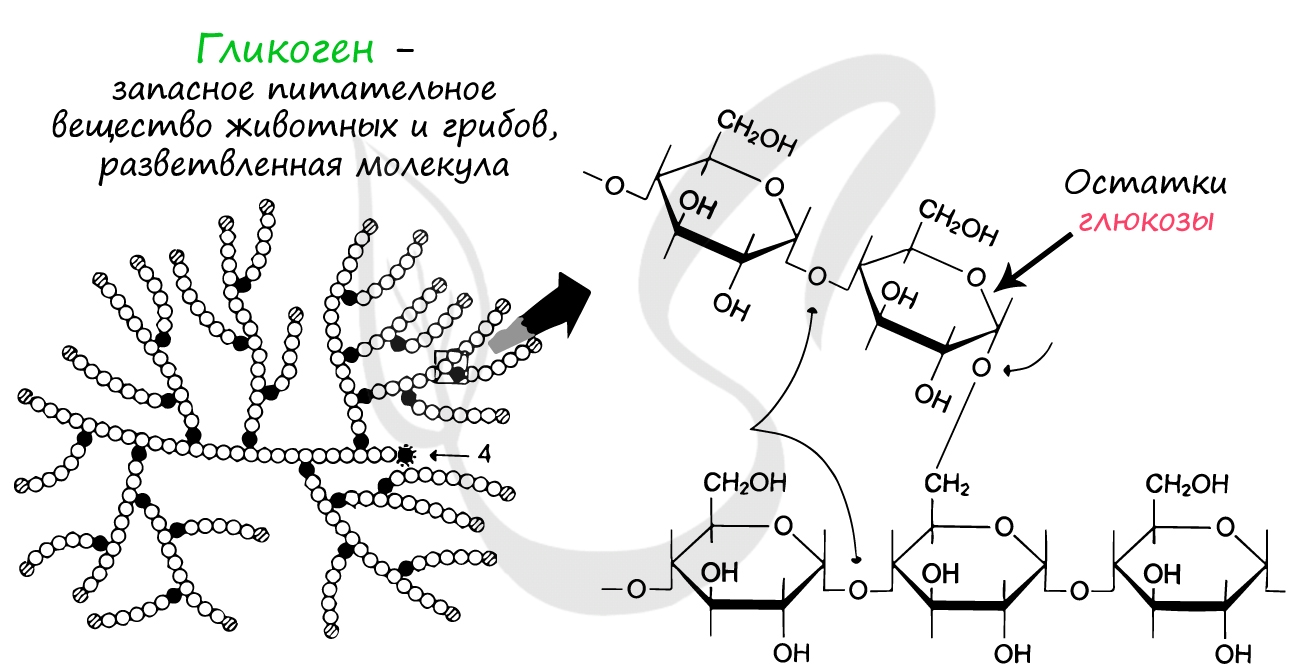
Запасным питательным веществом растений и животных соответственно являются крахмал и гликоген. Расщепление гликогена позволяет нам оставаться в сознании и быть активными между приемами пищи.
Гликоген представляет собой разветвленную молекулу, состоящую из остатков глюкозы. За счет больших размеров такая молекула хорошо удерживается в клетке, а ее разветвленность позволяет ферментам быстро отщеплять множество молекул глюкозы одновременно.
Существуют заболевания, при которых распад гликогена нарушается: в результате нейроны не получают глюкозы (источника энергии, соответственно не синтезируются и молекулы АТФ). Из-за этого становятся возможны частые потери сознания.
Целлюлоза входит в состав клеточных стенок растений, придавая им необходимую твердость. Хитин образует клеточную стенку грибов и наружный скелет членистоногих.
Нуклеиновые кислоты (от лат. nucleus — ядро)
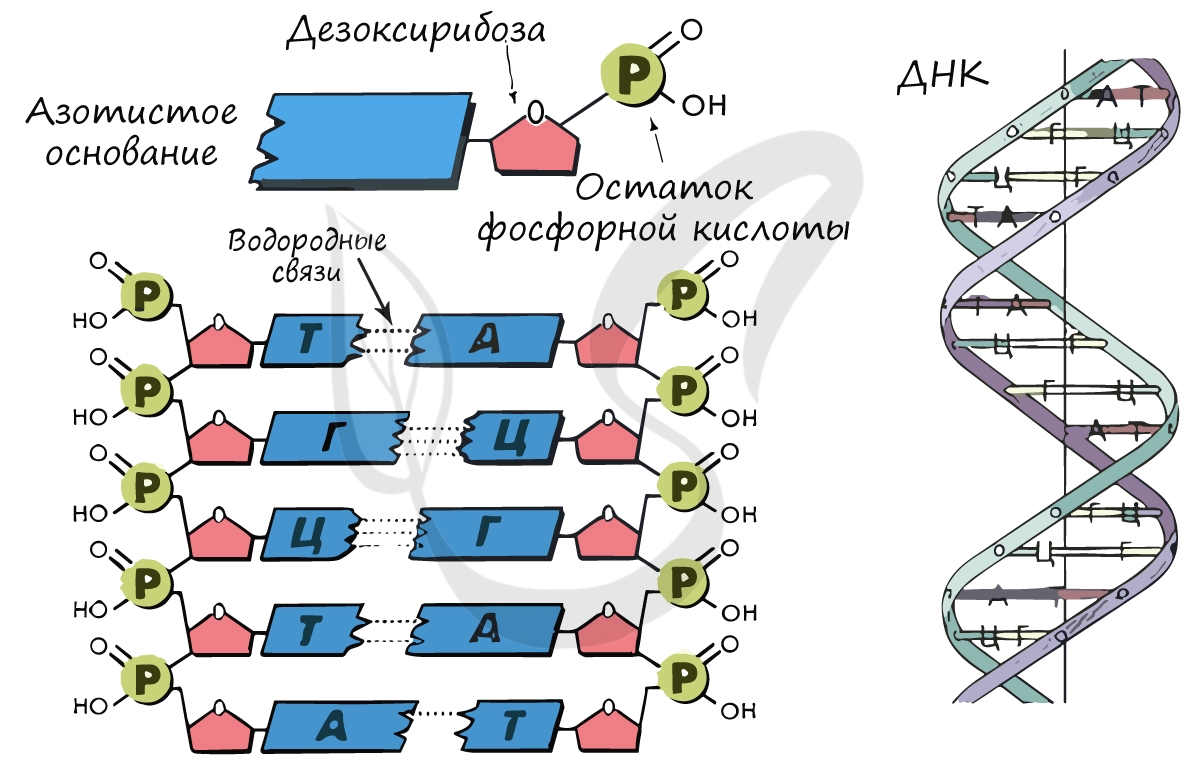
Высокомолекулярные органические соединения, представленные двумя видами: ДНК (дезоксирибонуклеиновые кислоты) и РНК (рибонуклеиновые кислоты). ДНК и РНК — биополимеры, мономером которых является нуклеотид. Запомните, что нуклеотид состоит из 3 компонентов:
- Азотистое основание
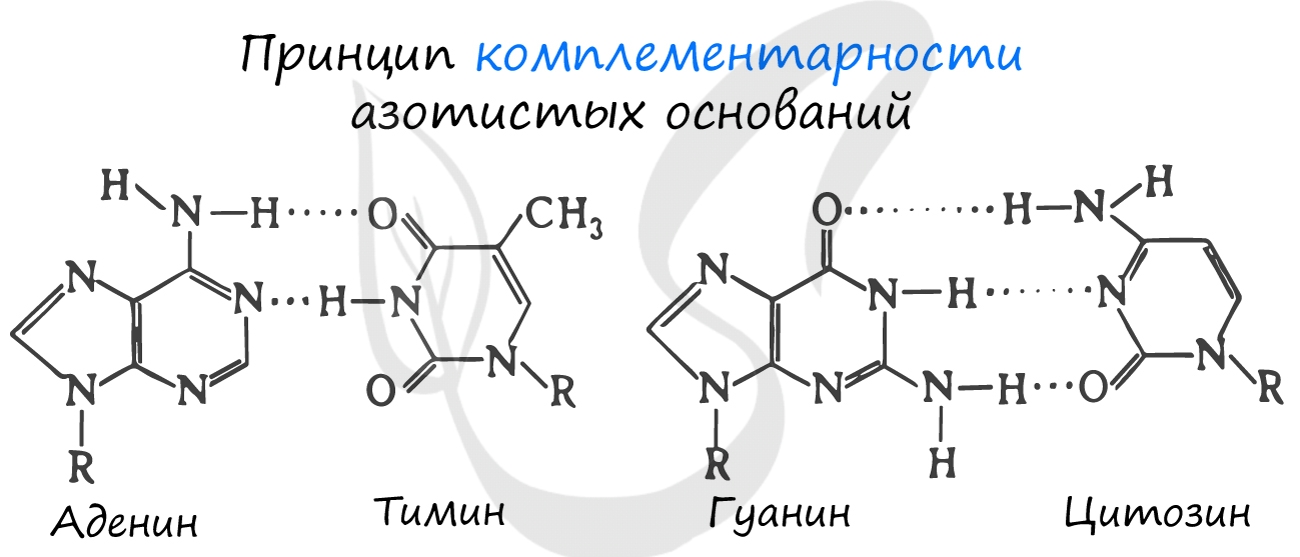
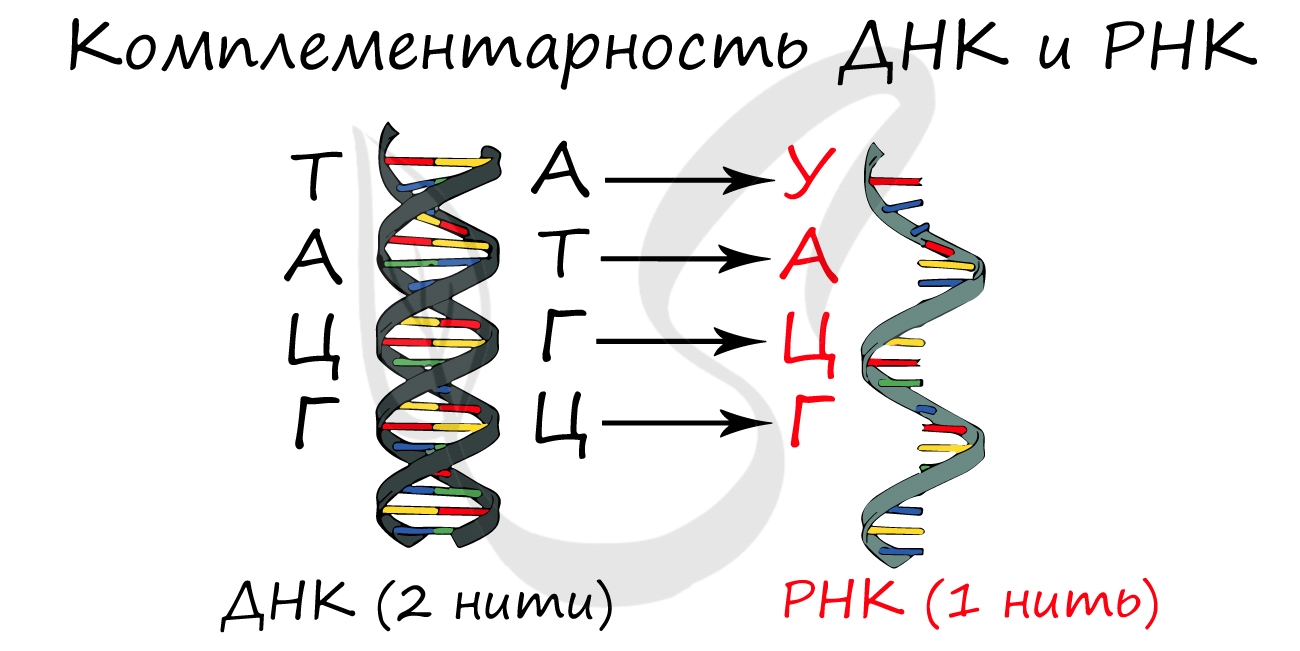
Для ДНК характерны следующие азотистые основания: аденин — тимин, гуанин — цитозин; для РНК: аденин — урацил, гуанин — цитозин. Исходя из принципа комплементарности, данные основания соответствуют друг другу, в результате чего между ними образуются связи.
Между аденином и тимином образуется 2 водородные связи, а между гуанином и цитозином — 3.
Именно по этой причине количество аденина в молекуле ДНК всегда совпадает с количеством тимина. К примеру, если в ДНК 20% аденина, то с уверенностью можно сказать, что в ней 20% тимина. Выходит на оставшиеся основания — цитозин и гуанин — остается 60%, значит, цитозин и гуанин составляют в ДНК 30% каждый. Таким нехитрым образом, зная процент содержания одного основания, можно подсчитать все остальные.
В ДНК остаток сахара — дезоксирибоза, в РНК — рибоза.
Остаток фосфорной кислоты — фосфат
Мы подробно изучили структуру ДНК (дезоксирибонуклеиновой кислоты) — двойной правозакрученной спиральной молекулы. Теперь настало время детально поговорить об РНК (рибонуклеиновой кислоте). Все виды РНК синтезируются на матрице — ДНК, различают три вида РНК:
- Рибосомальная РНК (рРНК)
Синтезируется в ядрышке. рРНК входит в состав малых и больших субъединиц рибосом. В процентном отношении рРНК составляет 80-90% всей РНК клетки.
Информационная РНК (иРНК, син. — матричная РНК, мРНК)
Синтезируется в ядре в ходе процесса транскрипции (лат. transcriptio — переписывание). Фермент РНК-полимераза строит цепь иРНК по принципу комплементарности с ДНК. Исходя из данного принципа, гуанин (Г) в молекуле ДНК соединяется с цитозином (Ц) в РНК. Далее соответственно: цитозин (Ц) — гуанин (Г), аденин (А) — урацил (У), тимин (Т) — аденин (А).
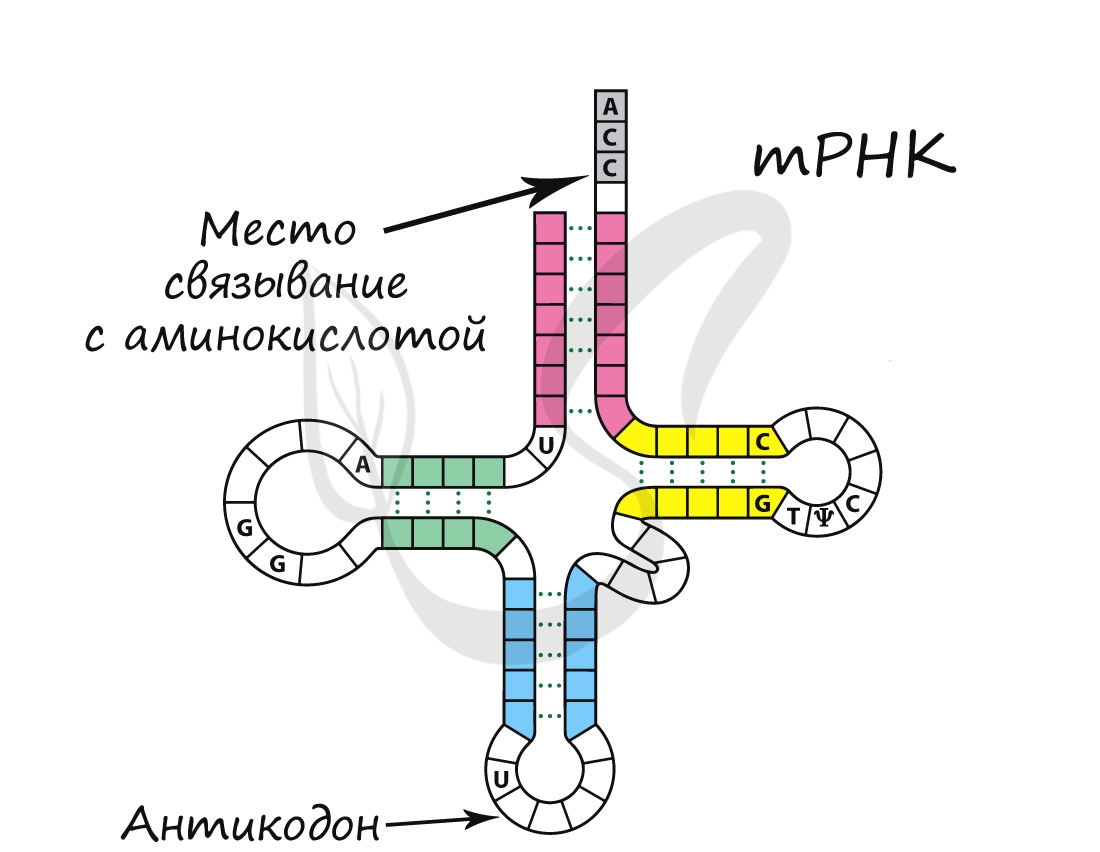
Обеспечивает транспорт аминокислоты к рибосоме во время синтеза белка. Благодаря этому становится возможным соединение аминокислот друг с другом, образуется белок. тРНК имеет характерную форму клеверного листа.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник