- Неорганическое соединение металла водой
- Неорганические вещества: примеры и свойства
- Описание
- Простые неорганические соединения: металлы
- Простые неорганические соединения: неметаллы
- Сложные неорганические соединения
- Неорганические соединения, содержащие углерод
- Свойства неорганических веществ
- Органические и неорганические вещества клетки
- НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- Полезное
- Смотреть что такое «НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ» в других словарях:
Неорганическое соединение металла водой
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов, или ряду стандартных электродных потенциалов металлов.
Электрохимический ряд напряжений металлов
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
Взаимодействие с простыми веществами
- С кислородом большинство металлов образует оксиды – амфотерные и основные:
Щелочные металлы, за исключением лития, образуют пероксиды:
С галогенами металлы образуют соли галогеноводородных кислот, например,
С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
С серой металлы образуют сульфиды – соли сероводородной кислоты:
Сплавы
Сплавами называются системы, состоящие из двух или более металлов, а также металлов и неметаллов, обладающих характерными свойства, присущими только металлическому состоянию.
Свойства сплавов – самые разнообразные и отличаются от свойств их компонентов, так, например, для того чтобы золото стало более твердым и пригодным для изготовления украшений, в него добавляют серебро, а сплав, содержащий 40 % кадмия и 60 % висмута, имеет температуру плавления 144 °С, т.е намного ниже температуры плавления его компонентов (Cd 321 °С, Bi 271 °С).
Возможны следующие типы сплавов:
- расплавленные металлы смешиваются между собой в любых соотношениях, неограниченно растворяясь друг в друге, например, Ag-Au, Ag-Cu, Cu-Ni и другие. Эти сплавы однородны по составу, обладают высокой химической стойкостью, проводят электрический ток;
- расправленные металлы смешиваются между собой в любых соотношениях, однако при охлаждении расслаиваются, и получается масса, состоящая из отдельных кристалликов компонентов, например, Pb-Sn, Bi-Cd, Ag-Pb и другие.
С углеродом образуются карбиды:
Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:
Источник
Неорганические вещества: примеры и свойства
Ежедневно человек взаимодействует с большим количеством предметов. Они изготовлены из разных материалов, имеют свою структуру и состав. Все, что окружает человека можно разделить на органическое и неорганическое. В статье рассмотрим, что представляют собой такие вещества, приведем примеры. Также определим, какие встречаются неорганические вещества в биологии.
Описание
Неорганическими называются такие вещества, в составе которых нет углерода. Они противоположны органическим. Также к этой группе относят несколько углеродосодержащих соединений, например:
- цианиды;
- оксиды углерода;
- карбонаты;
- карбиды и другие.
Примеры неорганических веществ:
- вода;
- разные кислоты (соляная, азотная, серная);
- соль;
- аммиак;
- углекислый газ;
- металлы и неметаллы.
Неорганическая группа отличается отсутствием углеродного скелета, который характерен для органических веществ. Неорганические вещества по составу принято делить на простые и сложные. Простые вещества составляют немногочисленную группу. Всего их насчитывается примерно 400.
Простые неорганические соединения: металлы
Металлы – простые вещества, соединение атомов которых основывается на металлической связи. Эти элементы имеют характерные металлические свойства: теплопроводность, электропроводность, пластичность, блеск и другие. Всего в этой группе выделяют 96 элементов. К ним относятся:
- щелочные металлы: литий, натрий, калий;
- щелочноземельные металлы: магний, стронций, кальций;
- переходные металлы: медь, серебро, золото;
- легкие металлы: алюминий, олово, свинец;
- полуметаллы: полоний, московий, нихоний;
- лантаноиды и лантан: скандий, иттрий;
- актиноиды и актиний: уран, нептуний, плутоний.
В основном в природе металлы встречаются в виде руды и соединений. Чтобы получить чистый металл без примесей, проводится его очистка. При необходимости возможно проведение легирования или другой обработки. Этим занимается специальная наука – металлургия. Она подразделяется на черную и цветную.
Простые неорганические соединения: неметаллы
Неметаллы – химические элементы, которые не обладают металлическими свойствами. Примеры неорганических веществ:
Неметаллы отличаются большим числом электронов на внешнем энергетическом уровне их атома. Это обуславливает некоторые свойства: повышается способность присоединять дополнительные электроны, проявляется более высокая окислительная активность.
В природе можно встретить неметаллы в свободном состоянии: кислород, хлор, фтор, водород. А также твердые формы: йод, фосфор, кремний, селен.
Некоторые неметаллы имеют отличительное свойство – аллотропию. То есть они могут существовать в различных модификациях и формах. Например:
- газообразный кислород имеет модификации: кислород и озон;
- твердый углерод может существовать в таких формах: алмаз, графит, стеклоуглерод и другие.
Сложные неорганические соединения
Эта группа веществ более многочисленна. Сложные соединения отличаются наличием в составе вещества нескольких химических элементов.
Рассмотрим подробнее сложные неорганические вещества. Примеры и классификация их представлены ниже в статье.
1. Оксиды – соединения, одним их элементов которых является кислород. В группу входят:
- несолеобразующие (например, монооксид углерода, оксид азота);
- солеобразующие оксиды (например, оксид натрия, оксид цинка).
2. Кислоты – вещества, в состав которых входят ионы водорода и кислотные остатки. Например, азотная кислота, серная кислота, сероводород.
3. Гидроксиды – соединения, в составе которых присутствует группа –ОН. Классификация:
- основания – растворимые и нерастворимые щелочи – гидроксид меди, гидроксид натрия;
- кислородосодержащие кислоты – диводород триоксокарбонат, водород триоксонитрат;
- амфотерные – гидроксид хрома, гидроксид меди.
4. Соли – вещества, в составе которых есть ионы металла и кислотные остатки. Классификация:
- средние: хлорид натрия, сульфид железа;
- кислые: гидрокарбонат натрия, гидросульфаты;
- основные: нитрат дигидроксохрома, нитрат гидроксохрома;
- комплексные: тетрагидроксоцинкат натрия, тетрахлороплатинат калия;
- двойные: алюмокалиевые квасцы;
- смешанные: сульфат алюминия калия, хлорид меди калия.
5. Бинарные соединения – вещества, состоящие из двух химических элементов:
- бескислородные кислоты;
- бескислородные соли и другие.
Неорганические соединения, содержащие углерод
Такие вещества традиционно относятся к группе неорганических. Примеры веществ:
- Карбонаты — эфиры и соли угольной кислоты – кальцит, доломит.
- Карбиды – соединения неметаллов и металлов с углеродом – карбид бериллия, карбид кальция.
- Цианиды – соли цианистоводородной кислоты – цианид натрия.
- Оксиды углерода – бинарное соединение углерода и кислорода – угарный и углекислый газы.
- Цианаты – являются производными от циановой кислоты – фульминовая кислота, изоциановая кислота.
- Карбонильные металлы – комплекс металла и монооксида углерода – карбонил никеля.
Свойства неорганических веществ
Все рассмотренные вещества отличаются индивидуальными химическими и физическими свойствами. В общем виде можно выделить отличительные черты каждого класса неорганических веществ:
1. Простые металлы:
- высокая тепло- и электропроводность;
- металлический блеск;
- отсутствие прозрачности;
- прочность и пластичность;
- при комнатной температуре сохраняют твердость и форму (кроме ртути).
2. Простые неметаллы:
- простые неметаллы могут быть в газообразном состоянии: водород, кислород, хлор;
- в жидком состоянии встречается бром;
- твердые неметаллы имеют немолекулярное состояние и могут образовывать кристаллы: алмаз, кремний, графит.
3. Сложные вещества:
- оксиды: вступают в реакцию с водой, кислотами и кислотными оксидами;
- кислоты: вступают в реакцию с водой, основными оксидами и щелочами;
- амфотерные оксиды: могут вступать в реакции с кислотными оксидами и основаниями;
- гидроксиды: растворяются в воде, имеют широкий диапазон температур плавления, могут менять цвет при взаимодействии с щелочами.
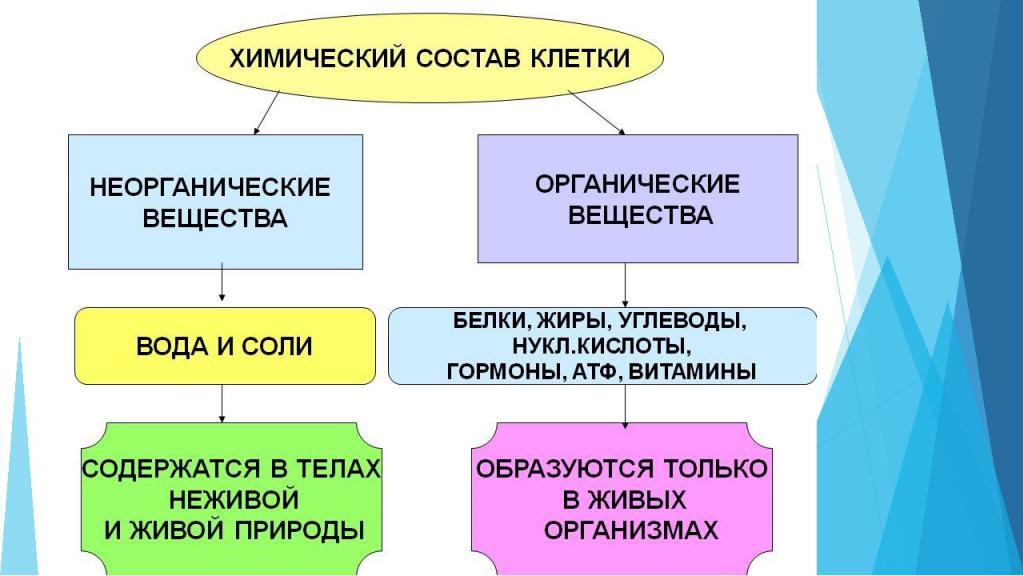
Органические и неорганические вещества клетки
Клетка любого живого организма состоит из множества компонентов. Некоторыми из них являются неорганические соединения:
- Вода. Например, количество воды в клетке составляет от 65 до 95%. Она необходима для осуществления химических реакций, перемещения компонентов, процесса терморегуляции. Также именно вода определяет объем клетки и степень ее упругости.
- Минеральные соли. Могут присутствовать в организме как в растворенном виде, так и в нерастворенном. Важную роль в процессах клетки играют катионы: калий, натрий, кальций, магний — и анионы: хлор, гидрокарбонаты, суперфосфат. Минералы необходимы для поддержания осмотического равновесия, регуляции биохимических и физических процессов, образования нервных импульсов, поддержания уровня свертываемости крови и многих других реакций.
Для поддержания жизнедеятельности важны не только неорганические вещества клетки. Органические компоненты занимают 20-30 % ее объема.
- простые органические вещества: глюкоза, аминокислоты, жирные кислоты;
- сложные органические вещества: белки, нуклеиновые кислоты, липиды, полисахариды.
Органические компоненты необходимы для выполнения защитной, энергетической функции клетки, они служат источником энергии для клеточной активности и запасают питательные вещества, проводят синтез белков, передают наследственную информацию.
В статье были рассмотрены сущность и примеры неорганических веществ, их роль в составе клетки. Можно сказать, что существование живых организмов было бы невозможным без групп органических и неорганических соединений. Они важны в каждой сфере человеческой жизни, а также в существовании каждого организма.
Источник
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое «НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ» в других словарях:
неорганические соединения — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN inorganic compounds … Справочник технического переводчика
неорганические соединения — neorganiniai junginiai statusas T sritis chemija apibrėžtis Cheminiai junginiai, išskyrus organinius junginius. atitikmenys: angl. inorganic compounds rus. неорганические соединения … Chemijos terminų aiškinamasis žodynas
Неорганические соединения — Неорганические вещества – это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
ХИМИЯ. НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — К неорганическим относятся соединения всех химических элементов, за исключением большинства соединений углерода. Кислоты, основания и соли. Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти… … Энциклопедия Кольера
Соединения природные — вещества, являющиеся промежуточными или конечными продуктами жизнедеятельности организмов. Термин условен, т.к. к С. п. обычно не относят ряд простых продуктов метаболизма (метан, уксусная кислота, этиловый спирт и др.), компоненты,… … Большая советская энциклопедия
Неорганические вещества — Неорганические вещества это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
Неорганические кислоты — Основная статья: Кислота Неорганические (минеральные) кислоты неорганические вещества, обладающие комплексом физико химических свойств, которые присущи кислотам. Вещества кислотной природы известны для большинства химических элементов за… … Википедия
НЕОРГАНИЧЕСКИЕ ПОЛИМЕРЫ — Имеют неорг. главные цепи и не содержат орг. боковых радикалов. Главные цепи построены из ковалентных или ионно ковалентных связей; в нек рых Н. п. цепочка ионно ковалентных связей может прерываться единичными сочленениями координац. характера.… … Химическая энциклопедия
Неорганические тиоцианаты — У этого термина существуют и другие значения, см. тиоцианаты. Тиоцианаты (тиоцианиды, роданиды, сульфоцианиды) соли … Википедия
Неорганические азиды — Азиды химические соединения, производные азотистоводородной кислоты HN3. Содержат одну или несколько групп N3. Содержание 1 Азиды металлов 2 Азиды неметаллов … Википедия
Источник