- Нитрат натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Гидролиз нитрата натрия
- Общие сведения о гидролизе нитрата натрия
- Гидролиз нитрата натрия
- Примеры решения задач
- 1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- Гидролиз
Нитрат натрия: способы получения и химические свойства
Нитрат натрия NaNO3 — соль щелочного металла натрия и азотной кислоты. Белое вещество, весьма гигроскопичное, которое плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 84,99; относительная плотность для тв. и ж. состояния d = 2,266; tпл = 306,5º C;
Способ получения
1. Нитрат натрия можно получить путем взаимодействия гидроксида натрия и разбавленной азотной кислоты, образуется нитрат натрия и вода:
2. В результате взаимодействия горячего гидроксида натрия, оксида азота (IV) и кислорода образуется нитрат натрия и вода:
3. В результате реакции между горячим гидроксидом натрия, оксидом натрия (IV) и кислородом, происходит образование нитрата натрия и воды:
4. При комнатной температуре, в результате взаимодействия оксида азота (IV) и натрия образуется нитрат натрия и газ оксид азота (II):
2NO2 + Na = NO↑ + NaNO3
5. При смешивании горячего пероксида водорода и нитрита азота происходит образование нитрата натрия и воды:
Качественная реакция
Качественная реакция на нитрат натрия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат натрия образует сульфат натрия, нитрат меди, газ оксид азота и воду:
Химические свойства
1. Hитрат натрия разлагается при температуре 380–500º С с образованием нитрита натрия и кислорода:
2. Н итрат натрия может реагировать с простыми веществами :
2.1. Н итрат натрия реагирует со свинцом при температуре выше 350 ºС . При этом образуется нитрит натрия и оксид свинца:
NaNO3 + Pb = NaNO2 + PbO
2.2. Нитрат натрия реагирует при комнатной температуре с цинком и разбавленной хлороводородной кислотой с образованием нитрита натрия и воды:
Источник
Гидролиз нитрата натрия
Общие сведения о гидролизе нитрата натрия
Формула – NaNO3. Тривиальные названия: натриевая/натронная/чилийская селитра. Представляет собой вещество белого цвета. Молярная масса – 85 г/моль.
Рис. 1. Внешний вид нитрата натрия.
Гидролиз нитрата натрия
Гидролизу не подвергается, т.к. в составе нет «слабого иона»:
Характер среды водного раствора – нейтральный.
Примеры решения задач
| Задание | Установите соответствие между формулой соли и типом её гидролиза: |
| Ответ | а) ацетат бария представляет собой соль, образованную слабой кислотой (уксусной) и сильным основанием (гидроксидом бария): Подвергается гидролизу по аниону. Вариант 2. б) бромид бериллия представляет собой соль, образованную слабой кислотой (бромоводородной) и слабым основанием (гидроксидом бериллия): Подвергается гидролизу по катиону и аниону. Вариант 3. в) сульфат алюминия представляет собой соль, образованную сильной кислотой (серной) и слабым основанием (гидроксидом алюминия): Гидролизуется по катиону. Вариант 1. г) фосфат натрия представляет собой соль, образованную слабой кислотой (фосфорной) и сильным основанием (гидроксидом натрия): Источник 1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи. Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н + ), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН − ). В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н + говорят, что раствор имеет кислую реакцию среды, если ОН − — щелочную реакцию среды. Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей? На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа: Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой. Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось. Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка? Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты. Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%. примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым. Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H + . Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом: S 2- + H2O ↔ HS − + OH − Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону. Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует: То есть, хлорид-ионы, не влияют на pН раствора. Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn 2+ , которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы: Zn 2+ + H2O ↔ Zn(OH) + + H + Zn(OH) + + H2O ↔ Zn(OH) + + H + Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону. Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na + соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора. Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные: 1) сильным основанием и сильной кислотой, Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу. 2) сильным основанием и слабой кислотой В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону Примеры: NaF, K2CO3, Li2S и т.д. 3) слабым основанием и сильной кислотой У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая. 4) слабым основанием и слабой кислотой. С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу. Что же значит то, что они необратимо гидролизуются? Поскольку в данном случае с водой реагируют и катионы металла (или NH4 + ) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H + , и ионы OH − , которые образуют крайне малодиссоциирующее вещество – воду (H2O). Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции: Наблюдается следующая реакция: Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой: При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу. Источник ГидролизГидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды. В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится. Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
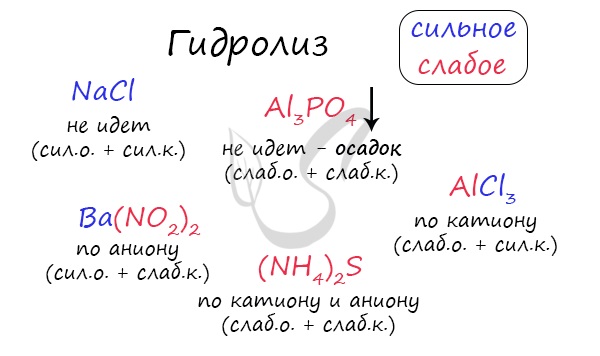
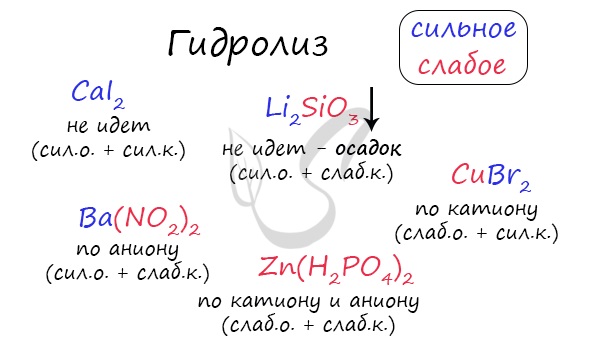
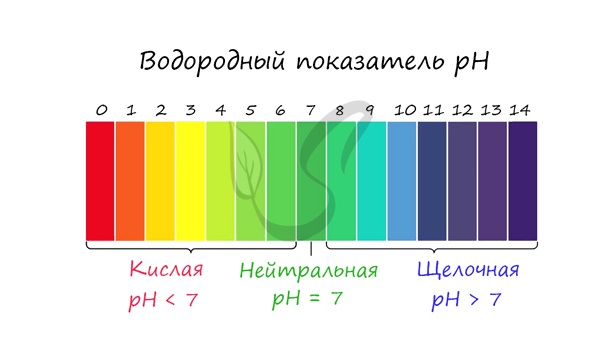
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными. При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉 По катиону, по аниону или нет гидролиза?Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3. Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3. Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит. Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3. Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4. Среда раствораСреда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора. Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная. Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры. Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4. Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение. С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH. Запомните, что кислая среда характеризуется pH 7. Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH Источник |