- Соли цинка
- Соли цинка
- Нитрат и сульфат цинка
- Комплексные соли цинка
- Гидролиз солей цинка
- Цинкаты
- Сульфид цинка
- Нитрат цинка — Zinc nitrate
- Синтез и реакции
- Приложения
- использованная литература
- Нитрат цинка взаимодействие с водой
- Гидролиз нитрата цинка
- Общие сведения о гидролизе нитрата цинка
- Гидролиз нитрата цинка
- Примеры решения задач
- Нитрат цинка
- Содержание
- Получение
- Физические свойства
Соли цинка
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Источник
Нитрат цинка — Zinc nitrate
- 7779-88-6
Y
- 19154-63-3 (тетрагидрат)
N
- 10196-18-6 (гексагидрат)
N
- 22926
Y
- EDO66F5U49
Y
297,49 г / моль (гексагидрат)
45,5 ° C (тригидрат)
36,4 ° C (гексагидрат)
125 ° C (257 ° F, 398 K) разлагается (гексагидрат)
184,3 г / 100 мл, 20 ° C (гексагидрат)


 N проверить ( что есть ?)
N проверить ( что есть ?)  Y
Y  N
NНитрат цинка — это неорганическое химическое соединение с формулой Zn (NO 3 ) 2 . Эта белая кристаллическая соль обладает высокой текучестью и обычно встречается в виде гексагидрата Zn (NO 3 ) 2 • 6H 2 O. Она растворима как в воде, так и в спирте.
Синтез и реакции
Нитрат цинка обычно получают растворением цинка в азотной кислоте , эта реакция зависит от концентрации, при этом реакция в концентрированной кислоте также приводит к образованию нитрата аммония :
Zn + 2 HNO 3 (разбавленный) → Zn (NO 3 ) 2 + H 2 O 4 Zn + 10 HNO 3 (концентрированный) → 4 Zn (NO 3 ) 2 + NH 4 NO 3 + 3 H 2 O
Приложения
Нитрат цинка не имеет широкого применения, но используется в лабораторных условиях для синтеза координационных полимеров . Его контролируемое разложение до оксида цинка также использовалось для создания различных структур на основе ZnO, включая нанопроволоки.
Может использоваться как протрава при крашении . Пример реакции дает осадок карбоната цинка :
использованная литература
Этот товар, связанный с неорганическими соединениями, является незавершенным . Вы можете помочь Википедии, расширив ее .
Источник
Нитрат цинка взаимодействие с водой
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
- Взаимодействие с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
При поджигании энергично реагирует с серой:
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
При действии паров фосфора на цинк образуются фосфиды:
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Взаимодействие со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
при сплавлении образует цинкаты:
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Взаимодействие с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Источник
Гидролиз нитрата цинка
Общие сведения о гидролизе нитрата цинка
Представляет собой бесцветные кристаллы. Молярная масса – 189 г/моль.
Рис. 1. Нитрат цинка. Внешний вид.
Гидролиз нитрата цинка
Гидролизуется по катиону. Характер среды – кислый. Теоретически возможна вторая ступень. Уравнение гидролиза имеет следующий вид:
Zn 2+ + HOH ↔ ZnOH + + H + (гидролиз по катиону);
Zn 2+ + 2NO3 — + HOH ↔ ZnOH + + 2NO3 — + H + (ионное уравнение);
Zn(OH)NO3 ↔ ZnOH + + NO3 — (диссоциация соли);
ZnOH + + HOH ↔ Zn(OH)2↓ + H + (гидролиз по катиону);
ZnOH + + NO3 — + HOH ↔ Zn(OH)2↓ + NO3 — + H + (ионное уравнение);
Примеры решения задач
| Задание | Установите соответствие между формулой соли и её отношением к гидролизу: | ||||
| Ответ | Соль силикат магния (MgSiO3) подвергается гидролизу по аниону, поскольку образована сильным основанием –гидроксидом магния и слабой кислотой – кремниевой (4). Соль хлорид серебра (AgCl)подвергается гидролизу по катиону, поскольку образована слабым основанием –гидроксидом серебра (I) и сильной кислотой – хлороводородной (соляной) (2). Соль нитрат цинка (Zn(NO3)2) подвергается гидролизу по катиону, поскольку образована слабым основанием –гидроксидом цинка и сильной кислотой – азотной (2). Соль перхлорат алюминия (Al(ClO4)3) подвергается подвергается гидролизу по катиону, поскольку образована слабым основанием –гидроксидом алюминия и сильной кислотой – хлорной (2).
Найдем массовую долю чистого (без примесей) нитрата цинка: Найдем массу нитрата цинка, не содержащего примесей: Определим количество молей нитрата цинка не содержащего примеси (молярная масса – 189 г/моль): Найдем количество молей продуктов реакции. Согласно уравнению: Рассчитаем массу образовавшегося оксида цинка (молярная масса – 81 г/моль) и объемы выделившихся газов: m(ZnO)= υ(ZnO)×M(ZnO)= 0,08×81 = 6,48 г. | ||||
| Ответ | Масса оксида цинка равна 6,48 г, объемы оксида азота (IV) и кислорода равны 1л и 3,6л, соответственно. |
| Понравился сайт? Расскажи друзьям! | |||||||||||||||||||||||||||||||||||
| Нитрат цинка | |
|---|---|
 | |
| Систематическое наименование | Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
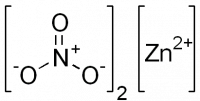
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 128 25 ; 1250 73 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES | |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Содержание
Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
ZnO + 2HNO3 → Zn(NO3)2 + H2O Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2 H2O ZnCO3 + 2HNO3 → Zn(NO3)2 + CO2↑ + H2O
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
Zn + 2N2O4 → Zn(NO3)2 + 2NO↑
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Источник






