Нитрид кальция с водой выделившийся
Газ, выделившийся при взаимодействии 7,4 г нитрида кальция с 9 г воды, полностью поглощён 200 мл 3,5%-ного раствора соляной кислоты (p= 1,05 г/мл). Определите массовую долю хлорида аммония в образовавшемся растворе. Ответ округлите до десятых.
В ответ запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения физических величин).
Данную задачу проверяют не автоматически, а вручную. Ознакомьтесь с критериями оценки, правильным решением и сами себе поставьте оценку от 0 до 4 баллов. Даже если вы ошиблись в цифровом ответе, можно получить несколько баллов за правильный ход решения. Форма для оценки находится внизу страницы.
| Содержание верного ответа и указания по оцениванию | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: • правильно записаны уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; • продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина (концентрация раствора) | 4 |
| Правильно записаны три элемента ответа | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Запишем химические реакции.
C a X 3 N X 2 + 6 H X 2 O → 3 C a ( O H ) X 2 + 2 N H X 3 \ce
3 C a ( O H ) X 2 + 2 N H X 3
7,4 г нитрида, 9г воды, что-то в избытке а что-то в недостатке. Посмотрим что.
На 1 моль нитрида нужно 6 моль воды,
на 0,05 моль — x моль воды
X=0,05*6=0,30 моль воды нужно для полной реакции нитрида. А у нас сколько воды?
n(H2O)=9/18=0,5 моль воды. Вода в избытке, считаем все по нитриду.
1 моль нитрида даёт 2 моля аммиака
0,05 моль нитрида — х моль аммиака
X=0’05*2=0,1 моль аммиака образуется в реакции нитрида кальция с водой.
N H X 3 + H C l → N H X 4 C l \ce
А сколько у нас кислоты? Как раствора, так и чистой кислоты.
210 грамм раствора HCL
А сколько в растворе чистой кислоты?
m(чист HCL)=3,5%*210г/100%=7,35 г . А сколько это молей?
n(HCl) = m(HCl чист)/ Mr(HCL)=7,35/36,5=0,2013 округляем 0,2 моль
1 моль аммиака требует для реакции 1 моль соляной кислоты
0,1 моль аммиака требует x моль соляной кислоты
x=0,1 моль. Требуется 0,1 моль соляной кислоты, а у нас 0,2 моль соляная кислота дана в избытке.
Сколько образуемся соли, хлорида аммония?
1 моль аммиака дает 1 моль хлорида аммония
0,1 моль аммиака дает x моль хлорида аммония
x=0,1 моль. Образуется 0,1 моль хлорида аммония
Общую массу вычисляем по закону сохранения вещества — масса начальная плюс вещества которые добавили. m(общ) = 210(масса раствора HCl) + 1,7(масса аммиака) никакие газы не образуются и не покидают раствор.
массовая доля = (5,35/(210+1,7) )*100%=2,527%
2,5% округлим до десятых.
В условии не сказано до какого знака округлять, но это и не машинная проверка.
Запишем химические реакции.
C a X 3 N X 2 + 6 H X 2 O → 3 C a ( O H ) X 2 + 2 N H X 3 \ce
3 C a ( O H ) X 2 + 2 N H X 3
7,4 г нитрида, 9г воды, что-то в избытке а что-то в недостатке. Посмотрим что.
На 1 моль нитрида нужно 6 моль воды,
на 0,05 моль — x моль воды
X=0,05*6=0,30 моль воды нужно для полной реакции нитрида. А у нас сколько воды?
n(H2O)=9/18=0,5 моль воды. Вода в избытке, считаем все по нитриду.
1 моль нитрида даёт 2 моля аммиака
0,05 моль нитрида — х моль аммиака
X=0’05*2=0,1 моль аммиака образуется в реакции нитрида кальция с водой.
N H X 3 + H C l → N H X 4 C l \ce
А сколько у нас кислоты? Как раствора, так и чистой кислоты.
210 грамм раствора HCL
А сколько в растворе чистой кислоты?
m(чист HCL)=3,5%*210г/100%=7,35 г . А сколько это молей?
n(HCl) = m(HCl чист)/ Mr(HCL)=7,35/36,5=0,2013 округляем 0,2 моль
1 моль аммиака требует для реакции 1 моль соляной кислоты
0,1 моль аммиака требует x моль соляной кислоты
x=0,1 моль. Требуется 0,1 моль соляной кислоты, а у нас 0,2 моль соляная кислота дана в избытке.
Сколько образуемся соли, хлорида аммония?
1 моль аммиака дает 1 моль хлорида аммония
0,1 моль аммиака дает x моль хлорида аммония
x=0,1 моль. Образуется 0,1 моль хлорида аммония
Общую массу вычисляем по закону сохранения вещества — масса начальная плюс вещества которые добавили. m(общ) = 210(масса раствора HCl) + 1,7(масса аммиака) никакие газы не образуются и не покидают раствор.
массовая доля = (5,35/(210+1,7) )*100%=2,527%
2,5% округлим до десятых.
В условии не сказано до какого знака округлять, но это и не машинная проверка.
Источник
Примеры оценивания выполнения заданий. Газ, выделившийся при взаимодействии 7,4 г нитрида кальция с 9 г воды, полностью поглощён 200 мл 3,5%-ного раствора соляной кислоты ( = 1,05 г/мл)
Газ, выделившийся при взаимодействии 7,4 г нитрида кальция с 9 г воды, полностью поглощён 200 мл 3,5%-ного раствора соляной кислоты
( 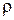
1) Составлены уравнения реакций:
2) Определено количество вещества NH3, и указано, что вода дана
в избытке:
n(H2O) = 9 / 18 = 0,5 моль, следовательно, H2O – в избытке.
3) Определено количество вещества NH4Cl, и указано, что HCl –
в избытке:
n(HCl) = 
4) Определена массовая доля NH4Cl:
m(NH4Cl) = 0,1 · 53,5 = 5,35 г
ω(NH4Cl) = 5,35 / 
В ответе допущена ошибка в записи уравнения реакции между нитридом кальция и водой. Все остальные элементы ответа выполнены верно. Оценка 3 балла.
1) в ответе экзаменуемого верно записаны уравнения реакций, о которых идёт речь в условии задания (1 балл). 2) не использована для расчётов масса нитрида кальция (0 баллов). 3) нарушена логическая взаимосвязь физических величин (0 баллов). 4) не найдена искомая физическая величина
(0 баллов). Общая оценка 1 балл.
Контрольные вопросы
1) На проверку усвоения каких элементов содержания курса химии ориентированы задания на позиции № 39 экзаменационной работы 2016 года?
2) Сформированность каких важнейших умений должен установить эксперт в процессе проверки выполнения задания № 39 экзаменационной работы 2016 года?
3) Как должен действовать эксперт в случае, если в ответе экзаменуемого использован другой алгоритм решения нежели в представленных эксперту элементах ответа?
Практические задания
Оцените выполнение задания.
При растворении пероксида лития Li2O2 в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.у.) может быть поглощён получившейся щёлочью?
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа. 1) Составлено уравнение реакции пероксида лития с водой, и рассчитано количество вещества пероксида лития: 2Li2O2 + 2H2O = 4LiOH + O2↑ n(Li2O2) = m / M = 2,3 / 46 = 0,05 моль 2) Рассчитаны количество вещества и масса гидроксида лития и кислорода: n(LiOH) = 2n(Li2O2) = 0,1 моль n(O2) = 0,5n(Li2O2) = 0,025 моль m(LiOH) = 0,1 ∙ 24 = 2,4 г m(O2) = 0,025 ∙ 32 = 0,8 г 3) Определена масса раствора, и рассчитана массовая доля гидроксида лития в нём: m(р-ра) = 2,3 + 62 – 0,8 = 63,5 г w(LiOH) = 2,4 / 63,5 = 0,038 или 3,8% 4) Записано уравнение реакции избытка углекислого газа со щёлочью, и найден объём углекислого газа: LiOH + СO2 = LiHCO3 n(CO2) = n(LiOH) = 0,1 моль V(CO2) = 0,1 · 22,4 = 2,24 л | |
| Ответ правильный и полный, содержит все названные выше элементы | |
| В ответе допущена ошибка в одном из названных выше элементов | |
| В ответе допущена ошибка в двух из названных выше элементов | |
| В ответе допущена ошибка в трёх из названных выше элементов | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
Примечание. В случае, когда в ответе содержится ошибка в вычислениях
в одном из трёх элементов (первом, втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только
на 1 балл.
Источник
Тест на гидролиз бинарных соединений и взаимное усиление гидролиза.
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. Ca2Si
- 2. CaF2
- 3. CaBr2
- 4. Ba3N2
- 5. Mg3P2
Ответ: 145
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. NaI
- 2. NaH
- 3. K3P
- 4. K4Si
- 5. RbBr
Ответ: 234
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. SrH2
- 2. NaBr
- 3. CaC2
- 4. Al4C3
- 5. Na3N
Ответ: 1345
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. Ca3N2
- 2. Cs3P
- 3. RbF
- 4. Ba2Si
- 5. K2S
Ответ: 124
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. CaC2
- 2. K3N
- 3. Li3P
- 4. BeCl2
- 5. Ba3N2
Ответ: 1235
Какие из приведенных солей не могут образоваться в растворе? Число верных ответов может оказаться любым
- 1. FeI2
- 2. FeCl3
- 3. Fe2(SO4)3
- 4. Fe2(CO3)3
- 5. FeSO4
Ответ: 4
Какие из приведенных солей не могут образоваться в растворе? Число верных ответов может оказаться любым
- 1. CrCl2
- 2. CrBr3
- 3. Cr2S3
- 4. Cr2(SO4)3
- 5. Cr2(CO3)3
Ответ: 35
Какие из приведенных солей не могут образоваться в растворе? Число верных ответов может оказаться любым
- 1. Al(NO3)3
- 2. AlI3
- 3. Al2(CO3)3
- 4. Al2S3
- 5. Al2(SO3)3
Ответ: 345
Какие из приведенных солей не могут существовать в растворе? Число верных ответов может оказаться любым
- 1. Cr(NO3)3
- 2. AlBr3
- 3. Al2S3
- 4. FeSO4
- 5. FeBr2
Ответ: 3
Какие из приведенных солей не могут существовать в растворе? Число верных ответов может оказаться любым
- 1. Al2(CO3)3
- 2. Fe(NO3)2
- 3. Fe2(CO3)3
- 4. Cr2(SO3)3
- 5. AlCl3
Ответ: 134
В каких из приведенных пар веществ при взаимодействии будет выделяться газ? Число верных ответов может оказаться любым
- 1. Ca2Si + H2O
- 2. Na3P + HCl
- 3. Mg3N2 + H2O
- 4. KCl + HBr
- 5. NaCl + H2O
Ответ: 123
В каких из приведенных пар веществ при взаимодействии не будет выделяться газ? Число верных ответов может оказаться любым
- 1. MgH2 + HCl
- 2. CaH2 + H2O
- 3. Li3N + HCl
- 4. Cs2S + HCl
- 5. CaC2 + H2O
Ответ: 3
В каких из приведенных пар веществ при взаимодействии будет выделяться газ? Число верных ответов может оказаться любым
- 1. NaCl + HI
- 2. K3P + H2O
- 3. Al4C3 + HCl
- 4. Ca3N2 + H2O
- 5. Mg2Si + HCl
Ответ: 2345
В каких из приведенных пар веществ при взаимодействии не будет выделяться газ? Число верных ответов может оказаться любым
- 1. CaC2 + H2O
- 2. Na3N + H2O
- 3. Li3N + HCl
- 4. MgBr2 + H2O
- 5. KH + HCl
Ответ: 34
В каких из приведенных пар веществ при взаимодействии будет выделяться газ? Число верных ответов может оказаться любым
- 1. Ba3P2 + H2O
- 2. CaH2 + H2O
- 3. Mg3N2 + HCl
- 4. Al4C3 + H2O
- 5. Li3P + HCl
Ответ: 1245
Запишите уравнение взаимодействия хлорида фосфора(III) с водой. Используйте в качестве разделителя левой и правой частей знак равенства.
Запишите уравнение взаимодействия хлорида фосфора(V) с водой. Используйте в качестве разделителя левой и правой частей знак равенства.
Запишите уравнение взаимодействия хлорида фосфора(V) с избытком раствора гидроксида калия. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия бромида фосфора(V) с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия бромида фосфора(III) с раствором гидроксида лития. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: PBr3 + 5LiOH = Li2HPO3 + 3LiBr + 2H2O
Запишите уравнение взаимодействия бромида фосфора(V) с раствором едкого натра. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: PBr5 + 8NaOH = Na3PO4 + 5NaBr + 4H2O
Запишите уравнение взаимодействия хлорида кремния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия бромида кремния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия иодида кремния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия хлорида кремния с раствором гидроксида лития. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: SiCl4 + 6LiOH = Li2SiO3 + 4LiCl + 3H2O
Запишите уравнение взаимодействия бромида кремния с избытком раствора гидроксида натрия. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: SiBr4 + 6NaOH = Na2SiO3 + 4NaBr + 3H2O
Запишите уравнение взаимодействия иодида кремния с раствором гидроксида калия. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида алюминия с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида алюминия с избытка раствора бромоводородной кислоты. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида алюминия с избытком водного раствора едкого натра. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида кальция с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида кальция с разбавленной серной кислотой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия силицида магния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия силицида магния с бромоводородной кислотой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: Mg2Si + 4HBr = 2MgBr2 + SiH4
Запишите уравнение взаимодействия нитрида натрия с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: Na3N + 3H2O = 3NaOH + NH3
Запишите уравнение взаимодействия нитрида калия с раствором соляной кислоты. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: K3N + 4HCl = 3KCl + NH4Cl
Запишите уравнение взаимодействия фосфида кальция с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия фосфида кальция с избытком водного раствора бромоводородной кислоты. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
При смешении хлорного железа с избытком раствора карбоната натрия выпал бурый осадок. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении бромного железа с избытком раствора питьевой соды выделился бесцветный газ. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: FeBr3 + 3NaHCO3 = Fe(OH)3 + 3NaBr + 3CO2
При смешении сульфата хрома(III) с избытком раствора сульфида калия выпал серый осадок и выделился газ с резким запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении нитрата хрома(III) с избытком раствора сульфита натрия выпал серый осадок и выделился газ с резким запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении хлорида хрома(III) с избытком раствора карбоната натрия выпал серый осадок и выделился бесцветный газ без запаха. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении бромида хрома (III) с избытком раствора гидрокарбоната натрия выпал серый осадок и выделился бесцветный газ без запаха. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: CrBr3 + 3NaHCO3 = Cr(OH)3 + 3NaBr + 3CO2
При смешении сульфата алюминия с избытком раствора сульфида натрия выпал студенистый осадок и выделился ядовитый газ с неприятным запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении раствора сульфата алюминия с избытком водного раствора сульфита калия выпал студенистый осадок и выделился газ с резким запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении нитрата алюминия с избытком раствора поташа выпал студенистый осадок и выделился газ. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении бромида алюминия с избытком раствора питьевой соды выпал студенистый осадок и выделился газ. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: AlBr3 + 3NaHCO3 = Al(OH)3 + 3NaBr + 3CO2
Запишите уравнение взаимодействия гидрида кальция с водой.
Запишите уравнение взаимодействия гидрида натрия с соляной кислотой.
Ответ: NaH + HCl = NaCl + H2
Запишите уравнение взаимодействия нитрида кальция с избытком раствора бромоводородной кислоты.
Определите объем газа, который можно получить при взаимодействии 15 г сульфида алюминия с водой. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,72
Вычислите массу осадка, образовавшегося при взаимодействии 10 г сульфида хрома (III) с водой. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 10,3
Рассчитайте массу водорода, которую можно получить, исходя из 1,2 г гидрида натрия и избытка воды. Ответ приведите в миллиграммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Ответ: 100
Определите массовую долю кислоты в растворе, полученную при смешении 20 г фосфида натрия и 200 г 18,25% раствора соляной кислоты. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,85
Вычислите суммарную массу солей, образовавшихся при взаимодействии 5 г нитрида магния с избытком раствора бромоводорода. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 37,4
Определите массу хлорида кальция, образовавшегося при взаимодействии 2,1 г гидрида кальция с 15 г 36% раствора соляной кислоты. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 5,55
Навеску сульфида алюминия с массовой долей инертных примесей 10% обработали избытком раствора иодоводородной кислоты. Выделившийся газ имеет массу 5,1 г. Определите массу исходной навески. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 8,3
Смесь гидрида кальция и фосфида кальция массой 20,3 г обработали водой. Определите массовую долю гидрида в исходной смеси, если известно, что выделилось 4,48 л фосфина. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 10,34
Смесь фосфида магния и нитрида натрия массой 21,7 г обработали 200 мл воды. Определите массовую долю щелочи в образовавшемся растворе, если известно, что массовая доля нитрида в исходной смеси 38,25%. Считать, что в условиях эксперимента все газообразные продукты полностью улетучиваются из раствора. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,13
Пояснение:
Уравнения реакций:
Na3N + 3H2O = 3NaOH + NH3
m(Na3N) = ω(Na3N) · m(смеси)/100% = 38,25% · 21,7 г/100% = 8,3 г
ν(Mg3P2) = 13,4 г / 134 г/моль = 0,1 моль
Масса раствора всегда равна сумме масс того, что смешали минус массы того, что выпало на дно в виде осадка и/или улетело в виде газа.
Таким образом, масса полученного раствора будет равна:
Находим массы того, что нам пока неизвестно:
ν(Mg(OH)2) = 3·ν(Mg3P2) = 3 · 0,1 моль = 0,3 моль, следовательно, m(Mg(OH)2) = M(Mg(OH)2) · ν(Mg(OH)2) = 58 г/моль · 0,3 моль = 17,4 г
ν(NH3) = ν(Na3N) = 0,1 моль, следовательно, m(NH3) = M(NH3) · ν(NH3) = 17 г/моль · 0,1 моль = 1,7 г
ν(PH3) = 2 · ν(Mg3P2) = 2 · 0,1 моль = 0,2 моль, следовательно, m(PH3) = m(PH3) · ν(PH3) = 34 г/моль · 0,2 моль = 6,8 г
Тогда, масса раствора, будет равна:
m(р-ра) = m(смеси) + m(H2O) – m(Mg(OH)2) – m(NH3) – m(PH3) = 21,7 г + 200 г — 17,4 г – 1,7 г – 6,8 г = 195,8 г
ν(NaOH) = 3·ν(Na3P) = 3·0,1 моль = 0,3 моль
m(NaOH) = M(NaOH) · ν(NaOH) = 40 г/моль·0,3 моль = 12 г
ω(NaOH) = 100% · m(NaOH) / m(р-ра) = 100% · 12 г/195,8 г = 6,13 г
Навеску нитрида кальция массой 14,8 г растворили в 200 г 18,25% раствора соляной кислоты. Определите массовую долю кислоты в полученном растворе. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 3,4
Вычислите массовую долю фосфорной кислоты в растворе, полученном при смешении 43,1 г бромида фосфора (V) и 160 мл воды. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 4,83
Рассчитайте массу осадка, полученного при взаимодействии 34 г хлорида кремния (IV) и 36 мл воды. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 15,6
Определите массовую долю хлорида натрия в растворе, полученном при взаимодействии 20,85 г хлорида фосфора (V) и 400 мл 10% раствора едкого натра (плотность 1,12 г/мл). Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,24
Вычислите массовую долю щелочи в растворе, полученном при взаимодействии 3,48 г бромида кремния (IV) и 35 мл 10% раствора гидроксида калия (плотность 1,12 г/мл). Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 1,31
При обработке 30 г раствора хлорида алюминия избытком сульфида натрия выпало 2,34 г осадка. Определите массовую долю хлорида алюминия в исходном растворе. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 13,35
Определите объем газа, который выделяется при обработке 16,25 г хлорида железа (III) избытком раствора поташа. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 3,36
Рассчитайте массовую долю соли в растворе, полученном при смешении 13,35 г хлорида алюминия и 300 г 10% раствора гидрокарбоната калия. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 7,64
Вычислите массу карбоната калия необходимую для полного осаждения металла из 99 мл 15% раствора хлорного железа (плотность 1,1 г/см 3 ). Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 20,7
Навеску гидрида кальция, содержащую примесь карбоната кальция, обработали водой. Выделившийся газ занимает объем 3,36 л. Если к полученной смеси добавить избыток соляной кислоты, то выделится еще 112 мл газа. Определите массовую долю гидрида в исходной смеси. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 86,3
Навеску сульфида алюминия массой 45 г, содержащего примесь серы, обработали большим количеством воды. При этом выпал осадок, а выделившийся газ имел объем 18,144 л. Определите массовую долю серы в образовавшемся осадке. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Источник





