Неорганическая химия
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
К щелочным металлам относятся s-элементы I-ой группы Периодической системы — литий, натрий, калий, рубидий,цезий и франций. .
Литий имеет два стабильных изотопа — 6 Li (мольная доля в естественном элементе 0,073) и 7 Li (0,927), натрий — один изотоп 23 Na, калий — 39 К (0,931) и 41 К (0,069). Изотоп калия с массовым числом 40 ( 40 К, мольная доля 0,0002) — радиоактивный, 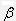
Все щелочные металлы — электронные аналоги, внешний уровень имеет строение ns 1 . По сравнению с элементами других подгрупп соответствующего периода щелочные металлы имеют наиболее низкие энергии ионизации и наибольшие радиусы атомов и ионов. В группе энергия ионизации уменьшается от лития к цезию, а радиус атома наоборот, возрастает. В соединениях проявляют степень окисления +1 и в свободном виде на Земле не встречаются. Мольная доля лития в земной коре 0,0002, натрия — 0,024 (один из наиболее распространенных элементов), калия 0,014, рубидия — 0,00007. Содержание цезия около 10 -10 , франций получен только искусственно.
Важнейшие минералы щелочных металлов — NaCl -каменная соль, или галит, Na2SO4*10H2O — глауберова соль или мирабилит, Na2B2O7*10H2O — бура, Na3AlF6 -криолит, KCl — сильвин, NaCl*KCl — сильвинит, KCl*MgCl2*6H2O — карналлит, KCl*MgSO4*3H20 — каинит.
Все щелочные металлы не имеют аллотропных и полиморфных модификаций и образуют по одному простому веществу.
В виде простых веществ — мягкие, серебристо белые металлы, цезий имеет золотисто-желтый цвет. Плотности лития, натрия и калия меньше плотности воды ( 1 г/см 3 ), температура плавления плавно уменьшается от лития (180 о С) к цезию (28 о С). Так же изменятся и температура кипения — от 1337 о С у лития до 668 о С у цезия. Твердость щелочных металлов мала — они легко режутся ножом.
В видимой области спектра в парах щелочные металлы имеют интенсивные линии излучения: натрий — желтую, литий — карминово-красную, калий — фиолетовую, рубидий — красную, цезий — голубую. Это позволяет распозновать эти металлы с помощью пламенной фотометрии.
Химические свойства
Щелочные металлы исключительно реакционноспособны и проявляют сильные восстановительные свойства. Уже при комнатной температуре они реагируют со многими неметаллами. С кислородом литий образует оксид:
Остальные щелочные металлы образуют пероксиды и надпероксиды (супероксиды), например:
В атмосфере фтора и хлора щелочные металлы самовоспламеняются, образуя галогениды:
С жидким бромом литий и натрий реагируют замедленно, остальные — о взрывом. С иодом взаимодействие протекает спокойно.
С водородом щелочные металлы реагируют при нагревании (200-400 o C), при этом образуютсяионные гидриды:
разлагающиеся водой с выделением водорода:
С азотом щелочные металлы реагируют при нагревании, образуя нитриды состава Ме3N. Литий реагирует с азотом воздуха уже при комнатной температуре, покрываясь слоем красноватого нитрида:
Щелочные металлы реагируют с водой:
литий — спокойно, натрий — энергично, калий и остальные — со взрывом — воспламеняется выделяющийся водород. Рубидий и цезий реагируют не только с жидкой водой, но и со льдом.
С кислотами щелочные металлы образуют соли, часто эти реакции сопровождаются взрывами.
Со спиртами щелочные металлы реагируют спокойно, часто для завершения реакции необходимо нагревание:
При взаимодействии лития и натрия с алюминие, оловом, ртутью образуются интерметаллические соединения. Широко распространена амальгама натрия NanHgm. Между собой щелочные металлы образуют сплавы, широкое применение имеет сплав натрия и калия, обладающий высокой теплоемкостью.
Получение щелочных металлов
Основным способом получения щелочных металлов является электролиз расплавов их соединений. Для получения лития электролизу подвергают расплав эвтектическуй смеси хлоридов лития и калия. Натрий получают электролизом расплава хлорида или гидроксида, калий — электролизом расплава смеси хлоридов натрия и калия. Смеси солей используют для понижения температуры электролиза. Реакции электролиза хлоридов и гидроксидов в общем виде выглядят так:
Кромe электролиза щелочные металлы можно получить и восстановлением оксидов и гидроксидов, например оксид лития восстанавливают кремнием при нагревании:
Расплавленный гидроксид калия восстанавливают жидким натрием:
KOH + Na = NаOH + K
Гидроксиды рубидия и цезия восстанавливают металлическим кальцием в вакууме при нагревании:
RbOH + Ca = Rb + CaO CsOH + Ca = Cs + CaO
Хранят щелочные металлы в атмосфере инертного газа, под слоем сухого керосина или обезвоженного масла. Большие количества щелочных металлов хранят в герметичной железной таре (бочке).
Щелочные металлы используют в качестве восстановителей, в качестве жидких теплоносителей, например, в ядерных реакторах, в органическом синтезе. Литий применяется производстве сплавов в качестве легирующей добавки. Пары натрия используют для наполнения газоразрядных ламп уличного освещения, которые дают свет с оранжевым оттенком.
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Гидриды щелочных металлов — соединения с ионным типом связи, сильные восстановители. Водой разлагаются с выделением водорода
При нагревании в вакууме разлагаются:
пр этом устойчивость гидридов уменьшается от лития к цезию. Рaсплавы гидридов проводят электрический ток.
Гидриды лития и натрия испльзуют для получения алюмогидридов, гидрид алюминия вводится в реакцию в виде эфирного раствора:
Алюмогидриды лития и натрия используются в качестве восстановителей, напримеp, в органическом синтезе.
Карбиды щелочных металлов имеют состав Ме2С2 . Бесцветные кристаллические вещества. Обладают высокой химической активностью. При непосредственном взаимодействии простых веществ образуется толькр карбид лития, остальные — при взаимодействии металла и ацетилена.Водой разлагаются с выделением ацетилена:
Из нитридов щелочных металлов наиболее устойчив гидрид лития, который медленно образуется при взаимодействии с азотом уже при комнтной температуре и быстро — при 250 o C. Водой нитрид лития разлагается с выделением аммиака:
Нитриды остальных щелочных металлов получают при взаимодействии паров металла с азотом в тлеющем электрическом разряде.
При взаимодействии расплавленных щелочных металлов с аммиаком образуются амиды, например:
В жидком аммиаке щелочные металлы растворяются, образуя темно-синие, хорошо проводящие электрический ток растворы.
Оксиды, пероксиды, озониды
При сгорании при атмосферном давлении литий дает только оксид Li2O , натрий — пероксид Na2O2 , остальные — надпероксиды Ме2O4 или Ме O2 . Оксид натрия можно получить только косвенным путем, например:
Оксиды щелочных металлов обладают высокой реакионной способностью, проявляют сильно выраженные основные свойства, энергично взаимодействуют с водой, образуя гидроксиды.
Пероксиды и надпероксиды — твердые вещеста, сильные окислители. При контакте с водой разлагаются:
Озониды натрия, калия, рубидия и цезия получают действием озона на твердые гидроксиды:
Озониды еще более сильные окислители, чем пероксиды и надпероксиды. Бурно реагируют с водой и разбавленной серной кислотой:
Твердые, бесцветные, гигроскопические, хорошо растворимые в воде вещества. Растворение в воде сопровождаетсявыделением большого количества теплоты. В водном растворе почти полностью диссоциированы, сильные основания. Часто гидроксиды щелочных металлов называют едкими щелочами. Термически устойчивы до температур более 1000 o C
Едкие щелочи жадно поглощают из воздуха водяные пары и углекислый газ, превращаясь в сиропообразную массу.Расплавы едких щелочей разрушают стекло и платину, поэтому щелочи плавят в железных тиглях.
Получают щелочи электролизом водных растворов хлоридов:
или обменными реациями карбоната металла и гидроксида кальция:
Наиболее широкое применение находит гидроксид натрия — для осушения газов, в органическом синтезе, в производстве искусственного волокна.
Источник
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.
Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 1 :
- Li — 2s 1
- Na — 3s 1
- K — 4s 1
- Rb — 5s 1
- Cs — 6s 1
- Fr — 7s 1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит
Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
K + O2 → KO2 (супероксид калия)
Реакции с неметаллами
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Реакция с водой
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «. в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.
Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов — смешанных оксидов (при высоких температурах — прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)
NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник









