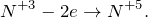KNO2 + KMnO4 + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме KNO2 + KMnO4 + H2O = ? Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. Заранее, большое спасибо!
В результате взаимодействия нитрита калия с перманганатом калия в нейтральной среде (KNO2 + KMnO4 + H2O = ?) происходит образование средней соли – нитрата калия, гидроксида калия и выпадение черного осадка оксида марганца (IV). Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода и оксиды на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы марганец и азот изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это нитрит калия).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это перманганат калия).
Источник
Нитрит калия перманганат калия вода овр
Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, cульфат лития, хлорид магния, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, cульфат лития, хлорид магния, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Запишем уравнение реакции:
Составим электронный баланс:
Азот в степени окисления +3 (нитрит калия) является восстановителем. Марганец в степени окисления +7 (перманганат калия) — окислителем.
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: — выбраны вещества, и записано уравнение окислительно-восстановительной реакции; Источник Задания 30 (2018). Окислительно-восстановительные реакции.Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: Mn +7 + 5e — → Mn +2 |⋅8 P -3 — 8e — → P +5 |⋅5 Mn +7 (KMnO4) — окислитель, P -3 (PH3) — восстановитель Второй вариант ответа: Mn +7 + 3e — → Mn +4 |⋅8 P -3 — 8e — → P +5 |⋅3 Mn +7 (KMnO4) — окислитель, P -3 (PH3) — восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: хромат натрия, серная кислота, гидрокарбонат магния, оксид фосфора(V), нитрит натрия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 N +3 — 2e — → N +5 |⋅3 N +3 (NaNO2) — восстановитель, Cr +6 (Na2CrO4) — окислитель Второй вариант ответа: Cr +6 + 3e — → Cr +3 |⋅2 N +3 — 2e — → N +5 | ⋅3 N +3 (NaNO2) — восстановитель, Cr +6 (Na2CrO4) — окислитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 S -2 — 2e — → S 0 |⋅3 Второй вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 S -2 — 2e — → S 0 |⋅3 Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфит калия, дихромат калия, серная кислота, гидроксид хрома(III), оксид кремния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: S +4 — 2е — → S +6 |⋅3 2Cr +6 + 6e — → 2Cr +3 |⋅1 Второй вариант ответа: S +4 — 2е — → S +6 |⋅3 2Cr +6 + 6e — → 2Cr +3 |⋅1 Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, иодид калия, фторид аммония, ацетат натрия, сульфат магния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: Mn +7 + 3e — → Mn +4 |⋅2 Mn +7 (KMnO4) — окислитель, I — (KI)- восстановитель Второй вариант ответа Mn +7 + 3e — → Mn +4 |⋅2 I -1 — 6e — → I +5 |⋅1 Mn +7 (KMnO4) — окислитель, I — (KI)- восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: гипохлорит натрия, гидроксид натрия, фторид цинка, оксид хрома(III), оксид кремния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Cl +1 + 2e — → Cl -1 |⋅3 2Cr +3 — 6e — → 2Cr +6 |⋅1 Cl +1 (NaClO) — окислитель, Cr +2 (Cr2O3) — восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: сера, концентрированная азотная кислота, оксид углерода(IV), фторид серебра, ацетат кальция. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. S 0 — восстановитель, N +5 (HNO3) — окислитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: фтороводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. 2Fe +2 – 2e- → 2Fe +3 |⋅3 2Cr +6 + 6e — → 2Cr +3 |⋅1 Fe +2 (FeSO4) – восстановитель, Cr +6 (K2Cr2O7) — окислитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: пероксид водорода, гидроксид калия, оксид хрома(III), фосфат серебра, сульфат аммония. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. 2O -1 +2e — → 2O -2 |⋅1 2Cr +3 – 6e — → 2Cr +6 |⋅1 Для выполнения заданий 30, 31 используйте следующий перечень веществ: дихромат калия, серная кислота, карбонат аммония, оксид кремния, нитрит калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 N +3 – 2e — → N +5 |⋅3 Второй вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 N +3 – 2e — → N +5 |⋅3 Для выполнения заданий 30, 31 используйте следующий перечень веществ: хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. 2Cr +6 + 6e — → 2Cr +3 |⋅1 2Br — — 2e — → Br2 0 |⋅3 Cr +6 (Na2CrO4) — окислитель, Br — (NaBr)- восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Mn +7 + 5e — → Mn +2 |⋅1 2Cl — — 2e — → Cl2 0 |⋅1 Mn +7 (KMnO4) — окислитель, Cl — (HCl)- восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 S -2 — 2e — → S 0 |⋅3 Второй вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 S -2 — 2e — → S 0 |⋅3 Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфат аммония, гидроксид калия, перманганат калия, нитрит калия, оксид меди(II). Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: Mn +7 + 1e — → Mn +6 |⋅2 N +3 — 2e — → N +5 |⋅1 Mn +7 (KMnO4) — перманганат калия, N +3 (KNO2) — восстановитель Второй вариант ответа: Mn +7 + 3e — → Mn +4 |⋅2 N +3 — 2e — → N +5 |⋅3 Mn +7 (KMnO4) — перманганат калия, N +3 (KNO2) — восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: концентрированная соляная кислота, оксид фосфора(V), оксид марганца(IV), фторид аммония, нитрат кальция. Допустимо использование водных растворов солей. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. 2Cl -1 — 2e — → Cl2 0 |⋅1 Mn +4 + 2e — → Mn +2 |⋅1 Cl -1 (HCl) — восстановитель, Mn +4 (MnO2) — окислитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: концентрированная соляная кислота, оксид углерода(IV), перманганат калия, фосфат калия, нитрат железа(III). Допустимо использование водных растворов солей. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Mn +7 + 5e — → Mn +2 |⋅1 2Cl — — 2e — → Cl2 0 |⋅1 Mn +7 (KMnO4) — окислитель, Cl — (HCl)- восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди(II). Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: S +4 — 2e — → S +6 |⋅1 Br2 0 + 2e — → 2Br -1 |⋅1 S +4 (Na2SO3) — восстановитель, Br2 0 — окислитель Второй вариант ответа: S +4 — 2e — → S +6 |⋅1 Br2 0 + 2e — → 2Br -1 |⋅1 S +4 (Na2SO3) — восстановитель, Br2 0 — окислитель Третий вариант ответа: Br2 0 + 2e — → 2Br -1 |⋅5 Br2 0 — 10e — → 2Br +5 |⋅1 Br2 0 является и окислителем, и восстановителем Для выполнения заданий 30, 31 используйте следующий перечень веществ: хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома(III), оксид магния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Cl +5 + 6e — → Cl -1 |⋅1 2Cr +3 — 6e — → 2Cr +6 |⋅1 Cl +5 (KClO3) — окислитель, Cr +3 (Cr2O3) — восстановитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: иодид калия, серная кислота, гидроксид алюминия, оксид марганца(IV), нитрат магния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Mn +4 + 2e — = Mn +2 |⋅1 2I — — 2e — = I2 0 |⋅1 I -1 (KI) — восстановитель, Mn +4 (MnO2) — окислитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: сероводород, концентрированная азотная кислота, сульфат алюминия, оксид фосфора(V), нитрат меди(II). Допустимо использование водных растворов солей. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. S -2 — 8e — → S +6 |⋅1 N +5 + 1e — → N +4 |⋅8 S -2 (H2S) — восстановитель, S +6 (H2SO4) — окислитель Для выполнения заданий 30, 31 используйте следующий перечень веществ: дихромат натрия, серная кислота, иодид натрия, силикат калия, нитрат магния. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Первый вариант ответа: 2Cr +6 +6e — → 2Cr +3 |⋅1 2I -1 — 2e — → I2 0 |⋅3 I -1 (NaI) — восстановитель, Cr +6 (Na2Cr2O7) — окислитель Второй вариант ответа: 2Cr +6 + 6e — → 2Cr +3 |⋅1 2I -1 — 2e — → I2 0 |⋅3 I -1 (NaI) — восстановитель, Cr +6 (Na2Cr2O7) — окислитель Источник |