- NaNO2 + KMnO4 + H2SO4 = ? уравнение реакции
- NaNO2 + KMnO4 + H2O = ? уравнение реакции
- Нитрит натрия плюс перманганат калия плюс вода
- KNO2 + KMnO4 + H2O = ? уравнение реакции
- Решение заданий занятия № 3
- Решение заданий занятия № 3.
- 1) перманганат калия с нитритом натрия в растворе гидроксида калия
- Перманганат калия – окислитель, нитрит натрия – восстановитель, среда щелочная.
- В щелочной среде перманганат восстанавливается до манганата калия (схема 1), нитрит окисляется до нитрата.
- 2KMnO4 +NaNO2 + 2KOH = NaNO3+ 2 K2MnO4+ H2O
- 5) сульфит калия с концентрированной азотной кислотой
- Cульфит калия — восстановитель, концентрированная азотная кислота – окислитель сильный. Среда кислая.
- Согласно схеме 4, концентрированная азотная кислота восстановится до NO2 , а сульфит калия окислится в сульфат калия.
- К2SO3 + 2 HNO3(конц) = К2SO4 +2NO2 +H2O
- 6) бромат калия с йодидом калия в сернокислом растворе
- Бромат калия – окислитель, иодид калия – восстановитель. Среда кислая. Кислородные соединения галогенов восстанавливаются до галогенид-ионов, галогениды окисляются до свободных галогенов.
- КВrO3 +6KI +3H2SO4 = KBr +3I2 + 3K2SO4 +3H2O
- 2КВrO3 +10KI +6H2SO4 = Br2 +5I2 + 6K2SO4 +6H2O
- 8) сульфат хрома (III) с бромом в растворе гидроксида калия
- Сульфат хрома (III) – восстановитель, бром –окислитель. Среда щелочная.
- Все соединения хрома(III) можно окислить в щелочной среде до хромата, бром восстановится в бромид ион.
- Сr2(SO4)3 +3Br2 +16KOH = 2K2CrO4 +6KBr +3K2SO4+8H2O
- 9) нитрат натрия с раствором гидроксида натрия в присутствии алюминия
- Нитрат натрия – окислитель, алюминий – восстановитель. Среда щелочная. При взаимодействии алюминия с щелочью выделяется атомарный водород, восстанавливающий нитрат — ион до аммиака:
- 3NaNO3 +5NaOH +8 Al +18H2O = 8Na +3NH3
- 10) феррат калия с водным раствором аммиака.
- Феррат калия – окислитель, аммиак – восстановитель, среда щелочная. Ферраты восстанавливаются до соединений железа (III), в щелочной среде, создаваемой раствором аммиака, получится гидроксид железа(III), аммиак окисляется до азота.
- 2К2FeO4 +2NH3 +2H2O = N2 +2Fe(OH)3 +4KOH
NaNO2 + KMnO4 + H2SO4 = ? уравнение реакции
Составьте химическое уравнение по схеме NaNO2 + KMnO4 + H2SO4 = ? Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. Заранее, большое спасибо!
В результате взаимодействия нитрита натрия с перманганатом калия в кислой среде, создаваемой серной кислотой (NaNO2 + KMnO4 + H2SO4 = ?) происходит образование средних солей – нитрата натрия, сульфатов марганца (II) и калия, а также воды. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода на ионы не распадается, т.е. не диссоциирует.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы марганец и азот изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это нитрит натрия).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это перманганат калия).
Источник
NaNO2 + KMnO4 + H2O = ? уравнение реакции
Подскажите, какое вещество образуется в результате окисления нитрита натрия перманганатом калия в нейтральной среде (NaNO2 + KMnO4 + H2O = ?). Приведите основные физические параметры твердого продукта реакции, расскажите о химических свойствах и его способах получения.
При окислении нитрита натрия перманганатом калия в нейтральной среде (NaNO2 + KMnO4 + H2O = ?) происходит образование средней соли нитрата натрия, гидроксида калия, а также выпадение осадка черного цвета – диоксида марганца. Молекулярное уравнение реакции имеет вид:
Оксид марганца (IV) представляет собой твердое вещество черного цвета с коричневым оттенком, кристаллы которого при нагревании разлагаются.
Не реагирует с водой. Из раствора осаждается в виде гидрата состава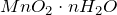
Проявляет окислительно-восстановительные свойства:
В промышленных масштабах диоксид марганца получают из природного минерала пиролюзита.
Источник
Нитрит натрия плюс перманганат калия плюс вода
Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, cульфат лития, хлорид магния, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, cульфат лития, хлорид магния, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Запишем уравнение реакции:
Составим электронный баланс:
Азот в степени окисления +3 (нитрит калия) является восстановителем. Марганец в степени окисления +7 (перманганат калия) — окислителем.
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: — выбраны вещества, и записано уравнение окислительно-восстановительной реакции; Источник KNO2 + KMnO4 + H2O = ? уравнение реакцииСоставьте химическое уравнение по схеме KNO2 + KMnO4 + H2O = ? Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. Заранее, большое спасибо! В результате взаимодействия нитрита калия с перманганатом калия в нейтральной среде (KNO2 + KMnO4 + H2O = ?) происходит образование средней соли – нитрата калия, гидроксида калия и выпадение черного осадка оксида марганца (IV). Молекулярное уравнение реакции имеет вид: Запишем ионные уравнения, учитывая, что вода и оксиды на ионы не распадаются, т.е. не диссоциируют. Первое уравнение называют полным ионным, а второе – сокращенным ионным. Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это нитрит калия). Источник Решение заданий занятия № 3Решение заданий занятия № 3.(Обоснования и ответы взяты из решения Ольги Эдуардовны Сикорской) 1) перманганат калия с нитритом натрия в растворе гидроксида калияПерманганат калия – окислитель, нитрит натрия – восстановитель, среда щелочная.В щелочной среде перманганат восстанавливается до манганата калия (схема 1), нитрит окисляется до нитрата.2KMnO4 +NaNO2 + 2KOH = NaNO3+ 2 K2MnO4+ H2OЭто задание все выполнили без ошибок. 2) сероводород с водным раствором хромата калия; Хромат калия – окислитель, сероводород – восстановитель, среда будет близка к нейтральной, так как сероводород – очень слабая кислота, а растворимость сероводорода незначительная. В нейтральной среде хромат восстанавливается до гидроксида хрома (III) (схема 3), а сероводород окисляется до серы (схема 7) 2K2CrO4 + 3H2S + 2H2O = 3S + 2Cr(OH)3 + 4KOH В этом задании были допущены ошибки, некоторые посчитали, что продуктом окисления сероводорода будет сульфат-ион. 3) алюминий с очень разбавленной азотной кислотой (см. таблицу 1) Алюминий – восстановитель, азотная кислота – окислитель. Среда кислая. Согласно таблице 1, азотная кислота восстановится до иона аммония, алюминий окислится до Аl 3+ 8Al +30HNO3 = 3NH4NO3 + 8Al(NO3)3 +9H2O Это задание все выполнили без ошибок. 4) фосфор с концентрированной серной кислотой Фосфор – восстановитель, серная кислота концентрированная – сильный окислитель. Среда кислая. Согласно схеме 6, серная кислота восстановится в SO2 , a фосфор окислится до фосфорной кислоты. 2Р +5Н2SO4(конц) = 5SO2 +2H3PO4 +2H2O В качестве продукта можно было записать метафосфорную кислоту, особенно, если концентрацию серной кислоты считать близкой к 100%. Многие посчитали, что продуктом окисления фосфора будет фосфористая кислота. Возможно, если фосфора избыток, а серной кислоты – недостаток, и она не очень концентрированная, так может получиться. Но фосфористая кислота легко окисляется до фосфорной. 5) сульфит калия с концентрированной азотной кислотойCульфит калия — восстановитель, концентрированная азотная кислота – окислитель сильный. Среда кислая.Согласно схеме 4, концентрированная азотная кислота восстановится до NO2 , а сульфит калия окислится в сульфат калия.К2SO3 + 2 HNO3(конц) = К2SO4 +2NO2 +H2OВ некоторых работах как продукт восстановления концентрированной азотной кислоты указан NO. 6) бромат калия с йодидом калия в сернокислом раствореБромат калия – окислитель, иодид калия – восстановитель. Среда кислая. Кислородные соединения галогенов восстанавливаются до галогенид-ионов, галогениды окисляются до свободных галогенов.КВrO3 +6KI +3H2SO4 = KBr +3I2 + 3K2SO4 +3H2OНекоторые участники мастер-класса не ограничились материалами лекции, заглянули в справочники и нашли информацию о том, что в кислой среде бромат восстановится до свободного брома: 2КВrO3 +10KI +6H2SO4 = Br2 +5I2 + 6K2SO4 +6H2OВозникает вопрос: как правильно? Мы на него не сможем однозначно ответить: это зависит от соотношения реагентов, их концентраций. В заданиях С1 ЕГЭ выполнить задание так, как задумано составителями помогут ключевые вещества, присутствующие в схеме. В целом, при проверке заданий С1 правильным считается решение, соответствующее условию и не противоречащее здравому смыслу. В материалах занятия № 4 вы увидите, что возможно несколько правильных решений одного и того же задания. В этом задании было допущено много ошибок при составлении формулы бромата: ВrO –– гипобромит; ВrO2– – бромит; ВrO3– – бромат; ВrO4 –– пербромат. 7) сульфат железа (II) с концентрированной серной кислотой Cульфат железа (II) –восстановитель, концентрированная серная кислота – окислитель. Среда кислая. Согласно схеме 6, концентрированная серная кислота восстановится до SO2, а сульфат железа (II) окислится в сульфат железа (III). 2FeSO4 + 2H2SO4(конц) = Fe2(SO4)3 +SO2+2H2O Некоторые указали в качестве продукта восстановления серной кислоты серу, но она тут же будет окисляться серной кислотой до сернистого газа. 8) сульфат хрома (III) с бромом в растворе гидроксида калияСульфат хрома (III) – восстановитель, бром –окислитель. Среда щелочная.Все соединения хрома(III) можно окислить в щелочной среде до хромата, бром восстановится в бромид ион.Сr2(SO4)3 +3Br2 +16KOH = 2K2CrO4 +6KBr +3K2SO4+8H2OВ некоторых работах среди продуктов оказались серная и бромоводородная кислоты, они тут же нейтрализуются гидроксидом калия до соответствующих солей. 9) нитрат натрия с раствором гидроксида натрия в присутствии алюминияНитрат натрия – окислитель, алюминий – восстановитель. Среда щелочная. При взаимодействии алюминия с щелочью выделяется атомарный водород, восстанавливающий нитрат — ион до аммиака:3NaNO3 +5NaOH +8 Al +18H2O = 8Na |




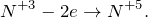

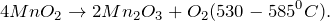
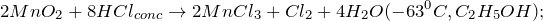
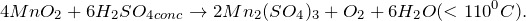
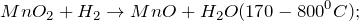
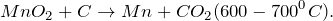





 +3NH3
+3NH3


